Написать уравнения реакций, используя метод электронного
Или протонно-кислородного баланса
Sn + H2SO4(к) = SnSO4 + SO2↑ + ?
Sn + H2SO4(гор.к) = Sn(SO4)2 + SO2↑ + ?
Sn + H2SO4(к) + HCl(к) = ? + SO2↑ + Cl2↑ + ?
Sn + HNO3(3%) = ? + NH4NO3 + ?
Sn +HNO3(30%) = SnО2↓ + NO↑ + ?
Sn + HNO3(>60%) = SnО2↓ + NO2↑ + ?
Sn + HNO3(>60%) + Н2О = Н2[Sn(OH)6] + NO2↑
SnCl2(p) + K2CrO4(p) + HCl = CrCl3 + ?+ SnCl4 + ?
SnCl2(p) + KMnO4(p) + HCl (р) = SnCl4 + MnCl2 + ?+ ?
Pb + HNO3(30%) = ? + NO↑ + ?
PbО2 + HNO3(p) + Н2О2 = ? + O2↑ + ?
PbО2 + MnSO4(k) + H2SO4(p) = HMnO4 + ?↓ + ?
PbS(т) + HNO3(k) = ? + S↓ + ? + NO↑
PbS(т) + H2SO4(k) = ?↓+ SO2↑ + S↓ + ?
Лабораторная работа № 33
Мышьяк, сурьма, висмут [14]
Внимание! Соединения мышьяка очень ядовиты! Необходимо все работы с мышьяковистыми соединениями проводить под тягой! Остатки растворов сливать в специальные банки. При окончании работы руки вымыть с мылом.
сурьмянистого водорода. Написать уравнения всех протекающих в этом опыте реакций и объяснить их.
Оксид сурьмы (Ш). 1. К 10 мл солянокислого раствора хлорида сурьмы прилить раствор соды до слабощелочной реакции. Что наблюдается? Нагреть реакционную смесь до удаления пузырьков углекислого газа. Дать осадку осесть, промыть путем декантации несколько раз горячей водой.
2. Испытать отношение оксида сурьмы (Ш) к воде, к растворам кислот и щелочей. Написать уравнения реакций. К какому классу оксидов относится оксида сурьмы (Ш)?
З. Испытать раствор антимонита натрия Na[Sb(OH)6] нитратом серебра. Что выпадает в осадок? Какие свойства проявляет сурьма (Ш) в этой реакции?
Свойства оксида сурьмы ( V). В две пробирки поместить немного оксида сурьмы (V) и испытать отношение ее к 10%-ному раствору щелочи и концентрированной соляной кислоте, Что наблюдается? Написать уравнения реакций.
Висмут
Получение висмута. Из имеющихся в лаборатории растворов солей висмута получить висмут, восстановлением из его соли цинком и испытать отношение полученного висмута к кислотам.
В каких условиях можно получить висмут из его соединений, взяв в качестве восстановителя соединения олова (П)? Написать уравнения реакций.
Свойства соединений висмута (III). 1. Испытать отношение солей висмута к воде. Написать уравнения реакций.
2. Получить гидроксид и сульфид висмута, ознакомиться с их отношеним к растворам кислот и щелочей. Написать уравнения реакций.
Получение и свойства соединений висмута (V). 1. Получить гидроксид висмута (III) и обработать ее при нагревании раствором персульфата калия. Что наблюдается? Написать уравнение реакции. Промыть осадок методом декантации.
2. Приготовить в пробирке раствор, содержащий 1-2 капли раствора нитрата марганца, 1-2 капли концентрированного раствора азотной кислоты, 2-3 капли воды. Охладить раствор и внести в него порошок висмутата калия. Что наблюдается? На какие свойства соединений висмута (V) указывает данная реакция? Написать уравнение реакции.
Контрольные вопросы
Написать уравнения реакций, используя метод электронного
или протонно-кислородного баланса
Sb + HNO3(к) = Sb2O5.H2O↓+ NO2 + ?
Sb + HNO3(р) = Sb2O3.H2O↓+ NO
Bi + HNO3(р) = Bi(NO3)3 + NO + ?
Э + HNO3(k) + HCl(k) = ЭCl3 + NO+ ? (Э = Bi, As)
Sb + HNO3(k) +HCl(k) = H[SbCl6] + NO +?
As + H2SO4(к, гор) = As2O3↓ + SO2+ ?
Э + H2SO4(к, холод) = Э2(SO4)3 + SO2 + ?
Sb2O3(т) + HNO3(к) = Sb2O5 + NO2+ ?
Sb2O5(т) + HCl(k) = SbCl3 + Cl2 + ?
КaBiO3(р) + MnSO4(р) + H2SO4(р) = Bi2(SO4)3 + KMnO4+ ?+ ?
КaBiO3(р) + Mn(NO3)3(р)+HNO3 (р) = Bi(NO3)3 + KMnO4 + KNO3 + ?
NaBiO3(р) + NH4Cl(р) + H2O = NaCl + Bi(OH)3↓ + N2 + NaOH
As + HNO3(к) = H3AsO4 + NO2↑ + H2O
AsH3 + HNO3(к) = H3AsO4 + NO2↑ + ?
Э2O3 + HNO3(к) + H2O = H3ЭO4 + NO2↑ (Э = As, Sb)
As2O3 + HNO3(60-70%) + H2O = H3AsO4 + NO2↑ + NO↑
H3AsO4 + NH3(г) + H2O = (NH4)3AsO4 .3H2O↓
H3AsO4 + HI(к) = As2O3↓ + I2 + ?
H3AsO4 + HI(к) = HAsO2↓ + I2 + ?
Bi(OH)3 + KMnO4 + КOH(k) = KBiO3↓+ K2MnO4 + ?
Bi(OH)3 + K2S2O8 + КOH(k) = KBiO3↓+ K2SO4 + ?
Bi(OH)3 + Na2[Sn(OH)4] (р) = Bi↓+ Na2[Sn(OH)6]
Лабораторная работа № 34
Качественное определение ионов d-элементоа [14]
Реакции на ион Cu 2+ . В пробирку внести 1 мл раствора соли меди (II) и добавить по каплям раствор щелочи до выделения осадка. Отметить цвет осадка. Растворяется ли осадок Cu(OH)2 в разбавленных растворах кислот и концентрированных растворах щелочей? Учесть, что ион [Cu(OH)4]2- малоустойчив и может разрушиться с образованием Cu(OH)2¯ при разбавлении водой.
В две пробирки внести по 1 мл раствора соли меди (II). В первую добавить раствор аммиака до образования осадка основной соли CuOH)2SO4¯.
Отметить цвет осадка. Затем добавить раствор аммиака до растворения осадка и окрашивания раствора в интенсивно – синий цвет:
(CuOH)2SO4+8NH4OH=2[Cu(NH3)4]2++ SO 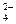 +2OH- + 8H2O
+2OH- + 8H2O
Во вторую пробирку добавить по каплям раствор соли (NH4)2CO3 до образования осадка основной соли зеленовато-голубого цвета, который растворяется в избытке (NH4)2CO3:
2CuCl+2(NH4)2CO3 + H2O = (CuOH)2CO3 ¯ + 4NH4Cl+CO2,
(CuOH)2CO3 + 4(NH4)2CO3 ® 2[Cu(NH3)4]CO3 + 3CO2 + 5H2O
Реакции на ион Zn 2+ . В две пробирки внести по 1 мл раствора соли цинка. В первую добавить по каплям раствор щелочи до выпадения белого аморфного осадка. Осадок разделить на три части. К первой части добавить избыток раствора щелочи, ко второй части – 2 н. раствор HCl, к третьей части - раствор аммиака. Что наблюдается?
По способности растворяться в растворе аммиака Zn(OH)2 отличается от Cr(OH)3, Fe(OH)3 , Fe(OH)2, которые нерастворимы в избытке аммиака.
Zn(OH)2+4NH4OH=[Zn(NH3)4](OH)2+4H2O
Во вторую пробирку добавить 1 мл раствора Na2S. Наблюдать образование белого осадка ZnS. Написать уравнение реакции.
Реакции на ион Cd 2+ . В две пробирки внести по 1 мл раствора соли кадмия. В первую добавить по каплям раствор щелочи до выпадения белого осадка Cd(OH). Осадок разделить на три части и испытать его на отношение к растворам: кислоты, избытка щелочи и аммиака.
Cd(OH)2+2HCl®CdCl2+2H2O,
Cd(OH)2+4NH4OH=[Cd(NH3)4](OH)2+H2O
Осадок нерастворим в избытке раствора щелочи.
Во вторую пробирку добавить 1 мл раствора Na2S. Наблюдать выпадения ярко-желтого или желто-оранжевого осадка, растворимого в разбавленной HNO3 и концентрированной HCl при нагревании. Написать уравнения реакций.
Реакция на ион Cr 3+ . В пробирку внести 1 мл раствора соли хрома (III) и добавить по каплям раствор аммиака до выпадения осадка серо-зеленого цвета:
CrCl3+3NH4OH®Cr(OH)3¯+3NH4Cl
Испытать отношение осадка к растворам кислот и щелочей. Отметить цвет растворов:
Cr(OH)3+3HCl®[Cr(H2O)6]Cl3 – сине-фиолетовый
Cr(OH)3+3NaOH®Na3[Cr(OH)6] - зеленый
Реакции на ион Fe 2+ . В четыре пробирки внести по 1 мл раствора соли Fe(II). В первую добавить по каплям раствор щелочи до выпадения осадка белого цвета, быстро переходящий в зеленый а затем в красно-бурый (Fe(OH)2®Fe(OH)3).
FeCl2 + 2NaOH = Fe(OH)2¯ + 2NaCl
4Fe(OH)2+O2+H2O=4Fe(OH)3¯
Во вторую пробирку добавить раствор Na2S. Наблюдать выпадения осадка черного цвета FeS, растворимый в разбавленных растворах кислот.
В третью пробирку добавить раствор гексоцианоферрата (III) калия. Наблюдать образования осадка синего цвета:
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2KCl
В четвертую пробирку добавить растворы H2SO4 и KMnO4. Наблюдать обесцвечивание раствора:
5FeCl2 + KMnO4 + 4H2SO4 = 5FeCl3 + MnSO4 + 4H2O
Реакции на ион Fe 3+ . В четыре пробирки внести по 1 мл раствора соли железа (III). В первую добавить по каплям раствор щелочи или раствор аммиака до образования осадка красно-бурого цвета:
FeCl3 + 3NaOH =Fe(OH)3¯ + 3NaCl
или
FeCl3 + 3NH4OH = Fe(OH)3¯ + 3NH4Cl
Во вторую пробирку добавить раствор KSCN или NH4SCN. Наблюдать окрашивание раствора в кроваво- красный цвет.
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl
В третью добавить раствор гексацианоферрата (II) калия. Наблюдать образование синего осадка:
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + 3KCl
В четвертую добавить раствор KI. Наблюдать образование раствора желто-коричневого цвета:
2FeCl3 + 2KI®2FeCl2 + 2KCl + I2
Добавить 2-3 капли раствора крахмала. Что наблюдается?
Реакция на ион Co 2+ . В две пробирки внести по 1 мл раствора соли кобальта (II). В первую по каплям добавить раствор щелочи до появления осадка розового цвета, переходящий в осадок синего цвета (aCo(OH)2®b-Co(OH)2). Затем к осадку добавить 3% раствор H2O2 и наблюдать образование осадка темно-коричневого цвета:
CoCl2 + 2NaOH ® Co(OH)2¯ + 2NaCl,
2Co(OH)2 + H2O2 = 2Co(OH)3¯
Во вторую пробирку добавить раствор уксусной кислоты и столько же насыщенного раствора KNO2. Выпадает осадок желтого цвета:
CoCl2+2CH3COOH+7KNO2+K3[Co(NO2)6] ¯+2CH3COOK+H2O+NO+2KCl
Реакция на ион Ni 2+ . В две пробирки внести по 1 мл раствора соли никеля (II). В первую добавить раствор щелочи. Наблюдать выпадения осадка зеленного цвета. К осадку добавить 3-4 капли бромной воды и нагреть. Образуется осадок черного цвета:
2Ni(OH)2 + Br2 + 2H2O = 2Ni(OH)3¯ + 2HBr
Во вторую пробирку добавить по каплям аммиачный раствор диметилглиоксима до образования осадка розово-красного цвета:
NiCl2 + 2NH3 + 2C4H8N2O2 = 2NH4Cl + Ni(C4H7N2O2)2¯
Контрольные вопросы
Дата добавления: 2019-07-15; просмотров: 202; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
