МЕТОД ИОНООБМЕННОЙ ХРОМАТОГРАФИИ
Принцип метода. В основе разделения соединений методом ионообменной хроматографии лежат реакции ионного обмена между анализируемыми соединениями и сорбентами-ионитами, имеющими в своем составе ионизируемые группировки.
Сильные иониты, функциональные группы которых образованы сильными кислотами или основаниями, могут быть ионизированы полностью во всем диапазоне рабочих значений pH (3 – 11). Слабые иониты, функциональные группы которых образованы слабыми кислотами или основаниями, могут быть ионизированы не полностью и лишь в ограниченной области значений pH. При работе с белками в качестве сорбентов используют иониты, обладающие высокой степенью гидрофильности.
Белки могут быть разделены как на катионитах, так и на анионитах. Выбор типа ионита определяется изоэлектрическими точками хроматографируемого материала и устойчивостью белка в определенной зоне значение pH.
Эффективная сорбция белков происходит при значениях pH, отстоящих не менее чем на единицу от рI. В области pH < рI – 1 белки можно хроматографировать на катионитах, а в области pH > рI + 1 — на анионитах. Хроматографию на анионитах ведут в таких системах, где диссоциируемым компонентом является катион (буферы: трис, пиридин, имидазод и др.), а для катионитов диссоциируемым компонентом является анион (ацетатный, фосфатный, бикарбонатный буфер и др.).
При ионообменной хроматографии смесь белков сорбируется в верхней части колонки и затем вытесняется веществами, уменьшающими их сорбцию на ионите. Изменение pH и ионной силы элюирующего буферного раствора можно проводить путем создания ступенчатой или градиентной элюции.
|
|
|
Реактивы: 1.0,5 н раствор НСl.
2.0,5 н раствор NаОН.
3. ДЭАЭ-целлюлоза – 10 г.
4. 0,02 моль/л, 0,1 моль/л и 0,5 моль/л растворы натрий-ацетатного буфера, pH 5,65.
5. 0,3 н раствор NаС1, приготовленный на 0,02 моль/л натрий-ацетатном буфере.
6. 0,5 н раствор NаС1, приготовленный на 0,5 моль/л натрий-ацетатном буфере.
Ход работы: Навеску порошка сорбента (около 10 г ДЭАЭ-целлюлозы) суспендируют в 50-кратном объеме дистиллированной воды, перемешивают и оставляют набухать на ночь. Слой жидкости над ионообменником декантируют, снова заливают дистиллированной водой, перемешивают и через 2 ч верхний слой жидкости декантируют вместе с неосевшими мелкими частицами. К оставшемуся осадку приливают 50-кратный объем 0,5 н NаОН, тщательно перемешивают и через 1 ч ионит фильтруют через воронку Бухнера. Осадок на воронке промывают водой до pH 7,0. Затем ионит перемешивают в 50-кратном объеме 0,5 н НСl и через 30 – 60 мин отмывают дистиллированной водой примерно до pH 5,0. На следующем этапе ДЭАЭ-целлюлозу повторной обработкой щелочью переводят в ОН–-форму. Для этого его суспендируют в 50-кратном объеме 0,5 н NаОН, перемешивают и через час отмывают дистиллированной водой до pH воды. После фильтрования сорбент отмывают дистиллированной водой до тех пор, пока pH промывной жидкости не достигнет величины 5,4 – 5,6.
|
|
|
Для освобождения от мелких и крупных частиц ее суспендируют дважды в избытке 0,1 моль/л натрий-ацетатного буферного раствора (рН 5,65), выдерживая каждый раз в буфере по 30 мин. Избыток жидкости удаляют декантацией. После второго суспендирования смесь вносят в колонку.
Хроматографическую колонку подготавливают и заполняют аналогично тому, как это описано для гель-фильтрации. По окончании заполнения колонки ионит уплотняют либо поршнем до получения постоянной высоты столба геля. Затем колонку уравновешивают исходным элюирующим буферным раствором (0,02 моль/л натрий-ацетатным буфером с pH 5,65), медленно пропуская его через колонку до тех пор, пока pH выходящего из колонки раствора не будет равен исходному. Количество раствора, необходимого для уравновешивания, составляет около 8 общих объемов колонки.
|
|
|
В качестве объекта исследования используют сыворотку крови крыс или другой биологический материал. Для удаления солей из сыворотки ее диализируют против исходного буферного раствора (0,02 моль/л натрий-ацетатным буфером с pH 5,65) . Для этого сыворотку разводят в 2 раза упомянутым буферным раствором, помещают в диализный мешочек и диализируют против того же буфера в течение не менее 12 ч (можно оставлять на ночь). В отдиализированном растворе определяют содержание белка биуретовым методом, после чего 75 мг белка наносят на колонку в объеме 2 мл. Колонку промывают 0,02 моль/л натрий-ацетатным буфером с pH 5,65 до тех пор, пока оптическая плотность не станет равной фоновому значению.
Элюирование белков с колонки проводят буферными растворами с линейным градиентом NаС1, меняя концентрацию последнего от 0 до 0,3 моль/л. Прибор для создания линейного градиента представлен на рис. 5. В смеситель (сосуд 2) помещают 250 мл 0,02 моль/л натрий-ацетатного буфера (pH 5,65), а в резервуар (сосуд 1) – 250 мл этого же раствора, но содержащего 0,3 моль/л NаС1. Наиболее прочно адсорбированные белки дополнительно элюируют 0,5 моль/л раствором NаС1 в 0,5 моль/л ацетатном буфере (pH 5,65). При этом скорость протекания растворов через колонку не должна превышать 15 – 20 мл/ч. Элюат собирают порциями по 3 мл.
|
|
|
Содержание белка определяют спектрофотометрически при 280 нм. На основании данных, полученных при определении содержания белка в отдельных порциях элюата, строят профиль элюции. Рассчитывают процентное содержание белка в отдельных фракциях.
Для идентификации белков, элюируемых с колонки, содержимое пробирок, соответствующее отдельным пикам на кривой элюции, объединяют, подвергают диализу, лиофилизируют и исследуют с помощью электрофореза на бумаге или в полиакриламидном геле.
По окончании работы ионообменники следует регенерировать. Для этого к использованному сорбенту добавляют 30-кратный объем 0,2 – 0,5 н раствора NаОН, перемешивают до получения однородной суспензии и фильтруют на воронке Бюхнера. Обработку щелочью проводят дважды. После этого ионит отмывают водой до нейтральной реакции фильтрата. Регенерированный ионообменник уравновешивают соответствующим буферным раствором.
 |
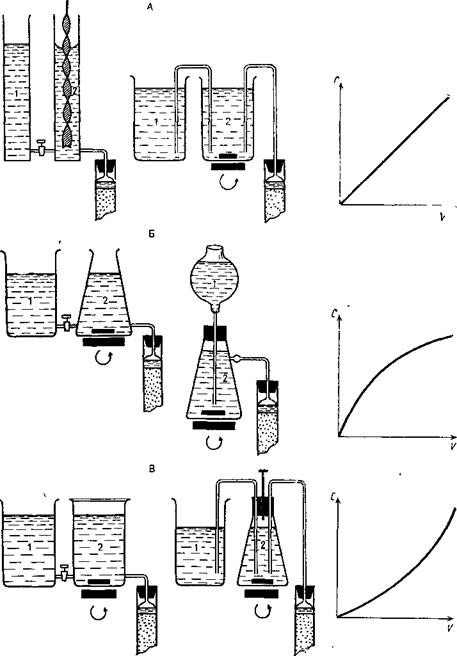
Рис. 5. Приборы для создания градиента концентрации:
а – линейного, б – выпуклого, в - вогнутого
2.2.3. МЕТОД АДСОРБЦИОННОЙ ХРОМАТОГРАФИИ
Принцип метода. Метод основан на адсорбции фракционируемых соединений на сорбенте происходит под действием межмолекулярных сил.
Из большого числа поверхностно-активных веществ, используемых в качестве сорбентов при адсорбционной хроматографии, в белковой химии широкое применение получили гели фосфата кальция. В настоящее время в хроматографии белков чаще используют особую форму фосфата кальция – гидроксилапатит (Са5ОН(РО4)3). Эта форма более устойчива в широкой области pH и обладает большей стабильностью. Гидроксилапатит готовят смешиванием растворов хлорида кальция и двузамещенного фосфата натрия. Образующийся осадок двузамещенного фосфата кальция под действием концентрированной щелочи гидролизуется в новую разновидность фосфата кальция – гидроксилапатит.
Реактивы: 1. 0,5 моль/л раствор СаС12.
2. 0,5 моль/л раствор Nа2НРО4.
3. Силикагель – навеска 0,5 г.
4. 40 % раствор NаОН.
5. 0,01; 0,02; 0,06; 0,08; 0,15; 0,3 моль/л натрий-фосфатный буфер (pH 6,8).
6. 0,7 моль/л калий фосфатный буфер (рН 6,8).
7. Сывороточный альбумин – навеска 20 мг.
Ход работы.0,5 г порошка силикагеля суспендируют в 25 мл дистиллированной воды и оставляют до полного его набухания. Набухший гель дважды промывают водой, удаляя избыток жидкости декантацией. Промытый осадок переносят в стеклянный сосуд-смеситель, содержащий 100 мл дистиллированной воды.
Одновременно в этот сосуд с помощью двух перистальтических насосов приливают по 0,5 л 0,5 моль/л СаС12 и 0,5 моль/л Nа2НРО4 со скоростью 0,5 – 0,6 мл/мин. При этом смесь тщательно и осторожно перемешивают механической мешалкой.
Образовавшийся осадок после 30-минутного выстаивания промывают 4 раза водой, каждый раз удаляя избыток жидкости декантацией. Затем промытый осадок суспендируют в 1 л воды и к суспензии добавляют 25 мл 40 % раствора NаОН. Смесь нагревают на кипящей водяной бане до 98°С и выдерживают при этой температуре в течение 1 ч. Чтобы избежать местного перегрева и разрушения кристаллов геля, смесь во время нагревания периодически осторожно перемешивают вручную.
После нагревания осадку дают отстояться, жидкость над осадком, не дожидаясь ее охлаждения, декантируют, а осадок промывают 4 раза дистиллированной водой (по 1 л) до достижения нейтральной реакции среды в промывных водах. Время осаждения кристаллов при этом 10 мин. Промытый осадок суспендируют в литре 0,01 моль/л натрий-фосфатного буферного раствора (pH 6,8) и нагревают на кипящей водяной бане до 98 °С.
Жидкость над осадком декантируют, а к осадку приливают 1л натрий-фосфатного буфера. Полученную смесь инкубируют в течение 5 мин. при 98 °С. Надосадочную жидкость заменяют новой порцией этого же буфера и нагревают полученную суспензию в тех же условиях еще 15 мин.
Надосадочную жидкость отсасывают. Полученный гидроксилапатит осторожно суспендируют в 0,01 моль/л натрий-фосфатного буфера c pH 6,8 и через 10 мин жидкость над гелем декантируют. Операцию повторяют трижды.
После этого гель суспендируют в небольшом объеме 0,01 моль/л натрий-фосфатного буфера c pH 6,8.
Колонку размером 2×20 см подготавливают так, как это описано для метода гель-фильтрации, и заполняют густой взвесью геля фосфата кальция до тех пор, пока высота столба геля не достигнет 15 см. Необходимо, чтобы верхний слой геля имел гладкую горизонтальную поверхность.
Колонку соединяют с резервуаром, заполненным 0,01 моль/л фосфатным буферным раствором, pH 6,8. Скорость тока жидкости устанавливают равной 5 мл/мин.
Сывороточный альбумин (20 мг) растворяют в 1 мл раствора 0,01 моль/л натрий-фосфатного буфера с pH 6,8 и ставят на диализ против того же буферного раствора с двухкратной сменой буфера не менее чем на 4 ч. Проводить диализ более 20 ч не рекомендуется, так как имеется опасность частичной денатурации белка.
Колонку перед нанесением пробы уравновешивают 300 – 450 мл 0,01 моль/л натрий-фосфатного буфера (pH 6,8). На поверхность геля наносят 3 мл сыворотки крови, разведенной в 2 раза этим же буфером или 3 мл отдиализированного раствора альбумина. Колонку промывают 0,01 моль/л натрий-фосфатным буферным раствором с pH 6,8.
Далее проводят элюирование белков с колонки и исследование полученных фракций. При работе с колонками, заполненными гидроксилапатитом, рекомендуют ступенчатое повышение ионной силы.
Для разделения белков сыворотки крови используют следующую серию буферных растворов с постоянной величиной pH (6,8).
1. Натрий-фосфатный буферный раствор 0,01 моль/л – 60 мл.
2. То же 0,06 моль/л – 30 мл.
3. » 0,08 моль/л – 50 мл.
4. » 0,15 моль/л – 30 мл.
5. » 0,30 моль/л – 30 мл.
6. Калий-фосфатный буферный раствор 0,70 моль/л – 100 мл.
При хроматографировании сывороточного альбумина используют следующие буферные растворы с pH 6,8 в указанных количествах.
1. Натрий-фосфатный буферный раствор 0,02 моль/л – 24 мл.
2. То же 0,07 моль/л – 20 мл.
3. » 0,11 моль/л – 20 мл.
4. » 0,40 моль/л – 30 мл.
Вытекающий из колонки элюат собирают порциями по 3 мл. Содержание белка во фракциях определяют спектрофотометрически по поглощению при 280 нм. Строят профиль элюции белковых фракций. Зная количество белка, нанесенного на колонку, рассчитывают относительное содержание белка (в %) в отдельных фракциях.
Дата добавления: 2019-02-26; просмотров: 533; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
