Обнаружение ионов серебра (I)
Ионы серебра (I) в растворе можно обнаружить при приливании раствора, содержащего хлорид-ионы: AgNO3 + NaCl = AgCl↓ + NaNO3;
Ag+ + Cl- = AgCl↓;
наблюдается выпадение характерного белого творожистого осадка, который нерастворим в воде и кислотах.
Соли серебра.
Нитрат серебра AgNO3 (ляпис) – кристаллы белого цвета. Обладает прижигающим и вяжущим действием. На коже оставляет след. Используется в производстве фотоматериалов, в гальванотехнике.
Используется в качестве реактива для определения ионов: а) галогенов AgNO3 + NaГ →Ag Г + NaNO3 Ag+ + Cl– → AgCl↓ - белый творожистый
Ag+ + Br– → AgBr↓ - светло-желтый творожистый
Ag+ + I– → AgI↓ - темно-желтый творожистый
б) фосфат-ионов: 3Ag++PO43– → Ag3PO4↓ – кристаллический желтый осадок
в) хромат-ионов: 3Ag++CrO42– → Ag2CrO4↓ - кирпично-красный осадок
Фторид серебра(I) AgF – порошок желтого цвета, единственный растворимый в воде галогенид серебра. Применяют как составную часть люитнофоров и фторирующий агент при синтезе фторуглеродов.
Хлорид серебра(I) AgCl – твердое вещество белого цвета. Под действием света разлагается на серебро и хлор. 2AgCl 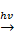 2Ag + Cl2↑ Используется в качестве фотоматериала.
2Ag + Cl2↑ Используется в качестве фотоматериала.
|
|
|
Бромид серебра (I) AgBr - кристаллическое вещество светло-желтого цвета. Используется при изготовлении фотобумаги, кино- и фотопленки.
Хромат серебра (I) Ag 2 CrO 4 и дихромат серебра(I) Ag 2 Cr 2 O 7 - темно-красные кристаллические вещества. Применяются в качестве красителей при изготовлении керамики.
Характеристика ртути и её соединений
История не знает имени первооткрывателя ртути, это металл, известный с древнейших времен. В Древнем Египте металлическую ртуть и киноварь использовали еще в III тысячелетии до нашей эры. Индусы знали ртуть во II–I вв. до н.э., знали о ней и в Древнем Риме. Ртуть была главным металлом алхимиков, они считали её женским началом, матерью металлов, основой философского камня.
Происхождение русского названия ртуть не ясно. Латинское название «гидраргирум» происходит от «гидрос» – вода и «аргентим» – серебро и означает «жидкое серебро».
Распространенность в природе
Ртуть принадлежит к числу редких и рассеянных элементов.Иногда встречается самородная ртуть, в виде озер или амальгам с золотом, серебром и палладием. Наиболее известен минерал ярко-красного цвета - киноварь HgS.
|
|
|
Положение в ПСХЭ Д.И. Менделеева
· Находится в VI периоде, во II группе, в побочной подгруппе
· d-элемент - валентные электроны 5d106s22. В образовании химических связей участвуют только 4s2 электроны, поскольку конфигурация d10 является очень устойчивой.
· В соединениях для ртути характерны степени окисления +1 и +2.
Физические свойства.
Ртуть – серебристо-белый, единственный жидкий при нормальных условиях металл, очень ядовит. Самая тяжелая из всех жидкостей, её плотность 13,6 г/см3. Температура плавления -39 °С, температура кипения 357 °С. Плохо проводит тепло и электрический ток. Пары ртути при высоких температурах излучают голубовато-зеленый цвет, богатый ультрафиолетовыми лучами. В твердом состоянии легко режется ножом и куется. Растворяет многие металлы, образуя сплавы – амальгамы.
Химические свойства
Ртуть - малоактивный металл, в сухом воздухе устойчива, подобно благородным металлам.
VIII. Взаимодействие с простыми веществами.
1. Окисляется кислородом при t> 3000С: 2Hg + O2 = 2HgO (оксид ртути (II))
2. Легко взаимодействует с серой при н.у.: Hg + S = HgS (сульфида ртути (II))
3. При н.у. реагирует с галогенами: Hg + Cl2 = HgCl2.
|
|
|
4. При нагревании – с фосфором: 3Hg + 2P = Hg3P2 (фосфид ртути (II))
5. Ртуть не взаимодействует: с водородом, азотом, бором, кремнием, углеродом.
II. Взаимодействие со сложными веществами.
1. Ртуть не взаимодействует: с водой, щелочами и неокисляющими кислотами, т.к. в электрохимическом ряду напряжений металлов ртуть находится после водорода.
2. Взаимодействие с кислотами
Растворяется в разбавленной и концентрированной азотной кислоте и концентрированной серной кислоте: Hg + 4HNO3 (конц.) = Hg(NO3)2 + 2NO2 + 2H2O,
6Hg + 8HNO3 (разб.) = 3Hg2(NO3)2 + 2NO + 4H2O,
Hg + 2H2SO4 = HgSO4 + SO2 + 2H2O;
при избытке ртути образуется сульфат ртути (I):2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O.
3. Взаимодействие с солями
Ртуть взаимодействует с солями ртути (II) с образованием солей ртути (I):
Hg + Hg(NO3)2 = Hg2(NO3)2,
Hg + HgCl2 = Hg2Cl2.
4. Другие металлы, из-за малой активности, вытеснять из растворов не может.
Способы получения ртути
Ртуть получают пирометаллургическим методом из киновари, прокаливая ее на воздухе или нагревая с железом: HgS + O2 = Hg + SO2,
HgS + Fe = Hg + FeS.
пары ртути отводят в специальные холодильники и улавливают.
Применение. Металлическая ртуть используется для изготовления катодов при электрохимическом получении едких щелочей и хлора, в производстве люминесцентных ламп, термометров, барометров, манометров и других измерительных приборов.
|
|
|
Соединения ртути
Соединения ртути (I)
Ртуть – единственный металл, способный образовывать устойчивый двухатомный катион  , в котором атомы связаны между собой ковалентной связью –Hg – Hg – . Каждый атом ртути образует две связи, но формально в соединениях
, в котором атомы связаны между собой ковалентной связью –Hg – Hg – . Каждый атом ртути образует две связи, но формально в соединениях  степень окисления ртути принимают равной +1.
степень окисления ртути принимают равной +1.
Известны черный оксид Hg2O, галогениды Hg2Г2 , некоторые соли. Большинство солей нерастворимо в воде, хорошо растворяется только нитрат ртути (I) Hg2(NO3)2, который является основным исходным веществом для получения других соединений ртути (I).
Соединения  в зависимости от условий проявляют окислительные и восстановительные свойства:
в зависимости от условий проявляют окислительные и восстановительные свойства:
а) под действием окислителей соединения  легко переходят в производные Hg2+:
легко переходят в производные Hg2+:
Hg2Cl2 + Cl2 = 2HgCl2;
б) при воздействии восстановителей соединения  восстанавливаются до металлической ртути: Hg2Cl2 + SO2 + 2H2O = H2SO4 + Hg + 2HCl.
восстанавливаются до металлической ртути: Hg2Cl2 + SO2 + 2H2O = H2SO4 + Hg + 2HCl.
Соединения ртути (I) склонны к диспропорционированию с выделением свободной ртути и образованием соединений ртути (II):  = Hg + Hg2+.
= Hg + Hg2+.
По этой причине невозможно получить по обменным реакциям Hg2S, Hg2(CN)2. Более устойчивы Hg2Cl2, Hg2SO4.
Практическое значение имеет хлорид ртути (I) Hg2Cl2 – каломель. Её получают по обменной реакции: Hg2(NO3)2 + 2NaCl = Hg2Cl2 + 2NaNO3.
Или при нагревании сулемы со ртутью: HgCl2 + Hg = Hg2Cl2
Каломель – белое кристаллическое вещество, в воде не растворяется, при температуре около 400°С возгоняется. Каломель применяется для изготовления каломельных электродов в электрохимии и в медицине, в качестве легкого слабительного.
Соединения ртути (II)
Для ртути (II) известны оксид HgO, галогениды HgГ2 и соли.
Оксид ртути (II) HgO существует в двух формах – красной и желтой, обе формы имеют одинаковую структуру, цвет зависит от размера кристаллов: при размерах до 4 мкм цвет оксида желтый, выше 8 мкм – красный.
Красная форма образуется при осторожном нагревании нитрата ртути (II) при 350 °С:
2Hg(NO3)2 = 2HgO + 4NO2 + O2.
Желтая – при добавлении щелочей к раствору соли Hg (II) :
Hg(NO3)2 + 2NaOH = HgO + 2NaNO3 + H2O.
Оксид ртути (II) обладает только основными свойствами, растворяется в кислотах:
HgO + 2HNO3 = Hg(NO3)2 + H2O.
Гидроксид ртути (II) Hg(OH)2 не выделен, он разлагается в момент образования на оксид и воду.
Хлорид ртути (II) HgCl2– сулема – образуется при нагревании смеси сульфата ртути (II) с хлоридом натрия: HgSO4 + 2NaCl = HgCl2 + Na2SO4.
Сулема – бесцветное кристаллическое вещество, плотность 5,44 г/см3, температура плавления 277°С, плохо растворима в воде. Сулема применяется для дезинфекции и для протравливания семян, используется в медицине, как катализатор в органическом синтезе.
Фульмиат ртути (II) Hg(CNO)2, соль гремучей кислоты, его называют гремучей ртутью. Это первое взрывчатое вещество, при ударе мгновенно разлагается: Hg(CNO)2 = Hg + N2 + 2CO. Используется в капсюлях патронов и снарядов в качестве детонаторов.
Дата добавления: 2019-02-22; просмотров: 2032; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
