Соединения трёхвалентного железа
Оксид железа ( III ) Fe 2 O 3
Физические свойства: твердое вещество красно-коричневого цвета.
Химические свойства: Fe2O3 – амфотерный оксид.
1. Взаимодействует с кислотами, как основной оксид: Fe2O3 + 6HCl → 2 FeCl3 + 3H2O
2. Взаимодействует со щелочами, как кислотный оксид: Fe2O3 + 2NaOH  2NaFeO2 + H2O
2NaFeO2 + H2O
феррит натрия
3. Восстанавливается водородом, углеродом, оксидом углерода(II): Fe2О3 + H2  2 FeО + H2O
2 FeО + H2O
Fe2О3 + 3H2  2 Fe + 3H2O
2 Fe + 3H2O
4. В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI): Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O.
5. При температуре выше 1400°С разлагается: 6Fe2O3 = 4Fe3O4 + O2.
Получение.
1. При разложении гидроксида железа(III): 2 Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
2. При обжиге пирита: 4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Гидроксид железа ( III ) Fe ( OH )3
Физические свойства: твердое вещество красно-бурого цвета, нерастворимое в воде.
Химические свойства: Fe(OH)3 – амфотерный гидроксид.
1. Взаимодействует с кислотами, как нерастворимое основание:
2Fe(OH)3 + 3H2SO4 →Fe2(SO4)3 + 6H2O
|
|
|
2. Взаимодействует со щелочами, как нерастворимая кислота:
Fe(OH)3 + KOH(тв) 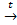 KFeO2+ 2H2O
KFeO2+ 2H2O
Fе(ОН)3 + 3КОН(конц) → К3[Fе(ОН)6]
3. Взаимодействует с карбонатами щелочных металлов при сплавлении:
2Fe(OH)3 + Na2CO3  2NaFeO2 + CO2 + 3H2O
2NaFeO2 + CO2 + 3H2O
4. В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6NaBr + 8H2O
5. При нагревании легко разлагается: 2Fe(ОН)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Получение.
1. Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка:
Fe(NO3)3 + 3KOH ® Fe(OH)3¯ + 3KNO3
Качественные реакции на Fe3+
1. При действии гексацианоферрата (II) калия K4[Fe(CN)6] (жёлтой кровяной соли) на растворы солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
4FeCl3 +3K4[Fe(CN)6] ® Fe4[Fe(CN)6]3¯ + 12KCl
2. При добавлении к раствору, содержащему ионы Fe3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
|
|
|
FeCl3 + 3KCNS « 3КCl + Fe(CNS)3
Соли железа (III). Железо (III) образует соли со многими анионами. Соли кристаллизуются в виде бурых кристаллогидратов: Fe(NO3)3·6H2O, FeCl3·6H2O, NaFe(SO4)2·12H2O (железные квасцы) и др.
· В растворе соли железа (III) устойчивы, Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду: Fe3+ + H2O = FeOH2+ + H+.
· Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III): Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4.
· Проявляют все свойства солей.
· Обладают преимущественно восстановительными свойствами:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
Дата добавления: 2019-02-22; просмотров: 727; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
