Применение железа и его соединений
Чистое железо применяется в качестве катализатора и для изготовления магнитных лент.
Более 90 % всего производимого железа используется в виде сплавов чугуна и сталей. Сплавы железа – основа большого количества конструкционных материалов.
Оксиды железа используются в качестве сырья для доменного процесса, как пигмент в составе красок и эмалей.
Нитраты железа (II) и (III) применяются в качестве коагулянтов в процессе очистки сточных вод, протравы для крашения шерсти.
Хлорид железа (III) используется в качестве катализатора в органическом синтезе, в процессе травления печатных плат, применяется в аналитической химии.
Сульфат железа (II) применяется в качестве компонента электролита в гальванотехнике, в сельском хозяйстве для борьбы с вредителями.
Комплексные соединения железа с неорганическими лигандами используются в цветной фотографии.
Медь и её соединения
Медь – один из металлов, известных человеку с доисторических времен. Каменный век сменился медным, медный – бронзовым. Распространению меди способствовало её свойство образовывать самородки, а также способность к холодной ковке и относительная простота выплавки из богатых руд. Латинское название меди «купрум» происходит от названия острова Крит, где древние греки добывали медную руду.
Распространенность в природе
Медь встречается в природе в самородном состоянии, а также в виде сульфидов и кислородсодержащих соединений. Образует более 250 минералов, наиболее распространенными являются: Сu2S – медный блеск, FeCuS2 – халькопирит, СuS – ковеллин, (СuOH)2СO3 – малахит. Медные руды кроме меди содержат золото, серебро, цинк, свинец, селен, железо, никель, молибден и др.
|
|
|
Медь также содержится в морской и речной воде, участвует в физиологических процессах в живых организмах.
Положение в ПСХЭ Д.И. Менделеева
· Находится в IV периоде, в I группе, в побочной подгруппе
· В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1.
· В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства.
Медь — пластичный, розовато-красный металл с металлическим блеском, тонкие пленки меди при просвечивании имеют зеленовато-голубой цвет. Ковкий, пластичный, обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Tплавл= 10830С. ρ = 8,96г/см3. На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
|
|
|
Химические свойства.
СО: 0,+1,+2 В химическом отношении медь – малоактивный металл. В сухом воздухе устойчива, во влажном покрывается зеленоватым налетом карбоната гидроксомеди(II):
2Cu + O2 + H2O + CO2 → (CuOH)2CO3
Взаимодействие с простыми веществами.
1. C кислородом в зависимости от температуры образует два оксида: 2Cu + O2 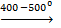 2CuO
2CuO
4Cu + O2 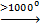 2Cu2O
2Cu2O
2. Взаимодействует с неметаллами при высоких температурах: а) с серой Cu + S 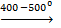 CuS 2Cu + S
CuS 2Cu + S 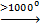 Cu2S
Cu2S
б) с галогенами:
· При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 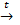 CuBr2; Cu + Cl2
CuBr2; Cu + Cl2 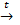 CuCl2
CuCl2
· с йодом – образуется йодид меди (I): 2Cu + I2 = 2CuI.
3. Медь не реагирует с водородом, азотом, углеродом и кремнием.
Дата добавления: 2019-02-22; просмотров: 754; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
