Соединения двухвалентной меди
Оксид меди ( II ) С uO
Физические свойства: твердое вещество черного цвета, нерастворимое в воде.
Химические свойства: СuO – имеет слабовыраженные амфотерные свойства с преобладанием основных.
1. Взаимодействует с кислотами при нагревании: CuO + H2SO4 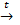 CuSO4 + H2O
CuSO4 + H2O
2. При сплавлении со щелочами образует купраты: CuO + 2KOH = K2CuO2 + H2O.
3. Легко восстанавливается водородом и другими восстановителями до меди:
СuO + Н2 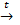 Сu + H2O
Сu + H2O
CuO + CO 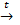 Cu + CO2;
Cu + CO2;
CuO + Mg 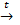 Cu + MgO.
Cu + MgO.
4. При нагревании разлагается с образованием оксида меди(I): 4СuO  2Сu2O + О2↑
2Сu2O + О2↑
5. Окислитель. Окисляет спирты до альдегидов: С2Н5ОН + СuO 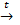 СН3СОН + Сu↓ + H2O
СН3СОН + Сu↓ + H2O
Получение.
1. При окислении меди: 2Cu + O2 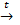 2CuO
2CuO
2. При разложении гидроксида меди(II): Cu(OH)2 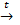 CuO + H2O
CuO + H2O
3. При разложении некоторых солей: Cu2(OH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
Малахит
Гидроксид меди ( II ) Cu ( OH )2
Физические свойства: твердое вещество синего цвета, нерастворимое в воде.
Химические свойства: Cu(OH)2 – слабое основание. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
1. Взаимодействует с кислотами: Cu(OH)2 + 2HCl → CuCl2 + 2H2O
2. В водных растворах щелочей образует неустойчивые ярко-синие гидроксокомплексы:
|
|
|
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
3. Растворяется в растворе аммиака с образованием комплексного соединения:
Cu(OH)2 + 4NH3 → [Cu(HN3)4](OH)2
4. При нагревании разлагается: Cu(OH)2 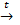 CuO + H2O
CuO + H2O
5. Проявляя основные свойства, взаимодействует с углекислым газом образованием основного карбоната меди (II) – малахита:
6. 2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
7. Слабый окислитель. Окисляет альдегиды до карбоновых кислот:
СН3СОН + 2Cu(OH)2  СН3СООН + Сu2O↓ + 2H2O
СН3СООН + Сu2O↓ + 2H2O
Получение.
1. Образуется при действии щелочей на соли меди (II): CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
2. Кристаллический гидроксид меди (II) образуется при введении гидроксида натрия или калия в аммиачный раствор сульфата меди (II):
[Cu(NH3)4]SO4 + 2NaOH = Cu(OH)2↓ + 4NH3 + Na2SO4.
Применение меди и её соединений
Металлическая медь используется при производстве проводов, кабелей, шин, токопроводящих частей электроустановок, применяется в медицине, сельском хозяйстве, в качестве пигментов, катализаторов и др.
Широко используются сплавы меди (бронза, латунь, мельхиор и др.) для изготовления художественных изделий.
|
|
|
Оксид меди (I) применяется в качестве пигмента в производстве стекла, керамики и глазурей.
Оксид меди (II) применяется в качестве пигмента для стекла, керамики, эмалей, для приготовления электролитов в гальванотехнике, а также для получения оксидных катализаторов.
Хлорид меди (I) является поглотителем газов в процессе очистки ацетилена, а также оксида углерода в газовом анализе, катализатором в органической технологии, антиоксидантом для растворов целлюлозы.
Хлорид меди (II) применяется в процессах омеднения металлов, в качестве катализатора крекинг-процесса, в процессе крашения тканей.
Гидроксид меди (II) используется в качестве пигмента для стекла, эмалей, глазурей, протравы в процессе крашения, стабилизатора нейлона и др.
Пятиводный сульфат меди (II) применяется в качестве протравы в процессе крашения текстильных материалов, компонента электролита при рафинировании металлической меди, пестицида, антисептика и вяжущего лекарственного средства, пигмента в красках и др.
Дата добавления: 2019-02-22; просмотров: 525; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
