Взаимодействие с хлороводородом
При высоких температурах реагирует с хлороводородом: 2Ag + 2HCl = 2AgCl + H2.
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов серебро расположено после водорода, поэтому оно не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата серебра (I) и оксида азота (II):
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей серебра (I) и продуктов восстановления кислот:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O;
Ag +2HNO3 = AgNO3 + NO2 + H2O.
Взаимодействие с цианидами
В растворе цианида натрия в присутствии кислорода воздуха серебро растворяется с образованием дицианоаргентата (I) натрия:
4Ag + 8NaCN + O2 + 2H2O = 4Na[Ag(CN)2] + 4NaOH.
Получение серебра
· Для отделения серебра от пустой породы используется цианидный метод. Метод основан на растворении серебра в растворе цианида натрия за счет окисления кислородом воздуха и перехода в анионный комплекс, с последующим вытеснением цинковой пылью по обменной реакции: 2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag.
· Основную часть серебра получают попутно с другими металлами при переработке их руд. Отделяют серебро от примесей электролизом.
Применение.
Металлическое серебро используется:
· для изготовления специального химического оборудования и аппаратуры
· для пищевой промышленности
|
|
|
· на покрытие радиодеталей, на серебрение проводов в высокочастотной радиотехнике, стекла, керамики в электронной аппаратуре,
· на производство серебряно-цинковых аккумуляторов,
· используется в медицине (для дезинфекции слизистых оболочек используют растворы протаргола и колларгола, которые представляют собой коллоидное серебро).
· как дезинфицирующее вещество, в основном для обеззараживания воды.
· для изготовления ювелирных изделий.
· как катализатор в реакциях окисления, например при производстве формальдегида из метанола.
· в качестве катализатора в фильтрах противогазов.
Соединения серебра
Оксид серебра (I) - Ag2O
Физические свойства:
Оксид серебра (I) Ag2O – темно-коричневый порошок, плохо растворим в воде, при 300°С разлагается.
Химические свойства. Имеет выраженные основные свойства.
1. В воде плохо растворяется, но придает ей слабощелочную реакцию:
Ag2O + H2O = 2Ag+ + 2OH-.
2. При нагревании до 300°С разлагается на кислород и серебро: 2Ag2O = 4Ag + O2↑.
3. С щелочами не взаимодействует, в водных растворах аммиака образует гидроксид диамминсеребра (I): Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH.
|
|
|
4. В разбавленной серной кислоте растворяется, образуя сульфат серебра (I):
Ag2O + H2SO4 = Ag2SO4 + H2O.
5. Проявляет восстановительные свойства: Перекись водорода легко восстанавливается Ag2O уже при комнатной температуре: Ag2O + Н2O2 = 2Ag + Н2O + O2.
6. Проявляет окислительные свойства. Окислительное действие оксида серебра объясняется тем, что это вещество является оксидом благородного металла, поэтому оксид неустойчив и при наличии восстановителя он легко отдает кислород, вследствие чего происходит выделение (восстановление) металлического серебра.
а) Водород, оксид углерода (II), многие металлы восстанавливают Ag2O до металлического Ag.
Ag2O + Н2 = 2Ag + Н2O
Ag2O + СO = 2Ag + СO2.
б) окисляет органические вещества(альдегиды, муравьиную к-ту, глюкозу):
- альдегиды: HCOH + Ag2O 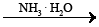 HCOOH + 2Ag↓.
HCOOH + 2Ag↓.
HCOH + 2[Ag(NH3)2]OH → HCOOH + 2Ag + 4NH3 + H2O
7. Взаимодействует с алкинами с концевой тройной связью:
СН≡ СН + Ag2O 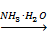 AgC≡ CAg + H2O
AgC≡ CAg + H2O
Получение.
1. Оксид серебра (I) получают осторожным нагреванием гидроксида серебра:
2AgOH = Ag2O + H2O.
2. При взаимодействии нитрата серебра со щелочью. Образующийся при этом гидроксид серебра(I), разлагается на оксид серебра и воду:
|
|
|
2AgNO3 +2NaOH —> Ag2O + H2O + 2NaNO3
3. При окислении серебра озоном: 8Ag + 2O3—> 4Ag2O+ O2
Гидроксид серебра (I) AgOH
не выделен в индивидуальном виде, это неустойчивое соединение, из растворов не образуется. При взаимодействии солей серебра (I) с щелочами в растворе образуется гидратированный оксид Ag2O·nH2O.
Дата добавления: 2019-02-22; просмотров: 675; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
