Положение в ПСХЭ Д.И. Менделеева
· Находится в IV периоде, в VIII группе, в побочной подгруппе
· Валентные электроны: 3d64s2
· Наиболее типичные степени окисления: +2 и +3. При этом наиболее устойчива степень окисления +3, чем +2, поскольку на 3d-оболочке существует всего один лишний электрон сверх устойчивой d5-конфигурации. В жестких окислительных условиях проявляет степень окисления +6.
Физические свойства.
Железо – сравнительно мягкий, ковкий металл серебристого цвета, пластичный, намагничивается. Электро- и теплопроводность в 6 раз ниже, чем у меди. Tплавл=15390С. ρ = 7,87г/см3.
Химические свойства.
В химическом отношении железо относится к металлам средней активности
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
I . Взаимодействие с простыми веществами.
1. Горит в кислороде, образуя окалину - оксид железа (II,III): 3Fe + 2O2 → Fe3O4(FeO•Fe2O3)
2. Во влажном воздухе окисляется с образованием гидроксида железа(III) – ржавчины:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
3. Железо реагирует с неметаллами при нагревании: а) с галогенами 2Fe + 3Br2  2FeBr3
2FeBr3
б) с серой Fe + S  FeS
FeS
|
|
|
в) с азотом 4Fe + N2  2Fe2N
2Fe2N
г) с фосфором 3Fe + P  Fe3P
Fe3P
д) с углеродом 3Fe + С  Fe3С
Fe3С
II . Взаимодействие со сложными веществами.
1. При высокой температуре (700–900°C) реагирует с парами воды: 3Fe + 4H2O  Fe3O4 + 4H2 ↑
Fe3O4 + 4H2 ↑
2. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4(разб.) → FeSO4 + H2↑
3. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3: 2Fe + 6H2SO4(конц.)  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
4. При взаимодействии с щелочными расплавами сильных окислителей, проявляет СО +6:
Fe + KClO3 + 2KOH = K2FeO4 + KCl + H2O
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O
5. Железо вытесняет металлы, стоящие правее него в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
6. Для железа характерно образование карбонилов, в которых железо имеет СО, равную 0.
|
|
|
Fe + 5CO 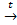 Fe(CO)5
Fe(CO)5
Получение.
1. Восстановлением из оксидов углём или оксидом углерода (II): FeO + C  Fe + CO
Fe + CO
Fe2O3 + 3CO  2Fe + 3CO2
2Fe + 3CO2
Соединения двухвалентного железа
О ксид железа ( II ) FeO
Физические свойства: твердое вещество черного цвета, нерастворимое в воде, в мелкораздробленном состоянии воспламеняется.
Химические свойства: FeО – основной оксид
1. Взаимодействует с кислотами: FeO + 2HCl = FeCl2 + H2O
2. При сильном нагревании окисляется водой: 3FeО + H2O 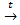 Fe3О4 + H2↑
Fe3О4 + H2↑
3. Окисляется кислородом до оксидов с более высокой СО: 4FeО + O2  Fe2О3
Fe2О3
6 FeО + O2  2Fe3О4
2Fe3О4
4. Восстанавливается водородом, углеродом, оксидом углерода(II) до железа: FeO + C  Fe + CO
Fe + CO
5. Проявляет восстановительные свойства: 3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O.
Получение.
1. При частичном восстановлении оксидов Fe3О4 и Fe2О3: Fe2О3 + H2  2 FeО + H2O
2 FeО + H2O
Fe3О4 + H2 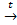 3 FeО + H2O
3 FeО + H2O
Гидроксид железа (II) Fe(OH)2
|
|
|
Физические свойства: в свежеосажденном виде имеет серовато-зеленую окраску, в воде не растворяется, быстро темнеет вследствие окисления:
Химические свойства: Fe(OH)2 – слабое основание. Проявляет слабовыраженные амфотерные свойства с преобладанием основных
1. Взаимодействует с сильными кислотами: Fe(OH)2 + H2SO4→FeSO4 + 2H2O
2. Взаимодействует с концентрированными растворами щелочей при нагревании с образованием тетрагидроксоферрата (II): Fe(OH)2 + 2NaOH  Na2[Fe(OH)4]
Na2[Fe(OH)4]
3. При нагревании разлагается: Fe(OH)2  FeO + H2O
FeO + H2O
4. На воздухе окисляется до Fe(OH)3: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
5. Проявляет восстановительные свойства, при взаимодействии с азотной или концентрированной серной кислотой образуются соли железа (III): 2Fe(OH)2 + 4H2SO4 = Fe2(SO4)3 + SO2 + 6H2O.
Получение.
1. Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeCl2 + 2KOH → 2KCl + Fе(OH)2↓
Качественная реакция на Fe2+
При действии гексацианоферрата (III) калия K3[Fe(CN)6] (красной кровяной соли) на растворы солей двухвалентного железа образуется синий осадок (турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] ® Fe3[Fe(CN)6]2¯ + 3K2SO4
Соли железа (II). Железо (II) образует соли практически со всеми анионами. Обычно соли кристаллизуются в виде зеленых кристаллогидратов: Fe(NO3)2·6H2O, FeSO4·7H2O, FeBr2·6H2O, (NH4)2Fe(SO4)2·6H2O (соль Мора) и др.
|
|
|
· Растворы солей имеют бледно-зеленую окраску и, вследствие гидролиза, кислую среду:
Fe2+ + H2O = FeOH+ + H+.
· Проявляют все свойства солей.
· При стоянии на воздухе медленно окисляются растворенным кислородом до солей железа (III):
4FeCl2 + O2 + 2H2O = 4FeOHCl2.
Дата добавления: 2019-02-22; просмотров: 462; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
