II. Взаимодействие со сложными веществами.
1. В раскалённом состоянии реагирует с парами воды: 2Cr + 3H2O 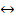 Cr2O3 + 3H2
Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+. Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты: 2 Сr + 6 Н2SО4(конц)  Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц)  Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Сr(NО3)3 + 3 NO2↑ + 3 Н2О
4. При нагревании взаимодействует с сероводородом, образуя сульфид хрома(II):
Cr + H2S(г) 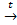 CrS + H2↑
CrS + H2↑
5. Взаимодействие с щелочными реагентами:
а)не растворяется в водных растворах щелочей, медленно реагирует с расплавами с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2.
б) Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O.
6. Восстановление металлов из оксидов и солей
Хром вытесняет менее активные металлы из оксидов и растворов их солей:
2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Получение.
1. Алюминотермия: Cr2O3 + 2Al  Al2O3 + 2Cr
Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом: CrO + Н2  Cr + H2O
Cr + H2O
|
|
|
Применение.
Хром используется в качестве легирующей добавки в различных сортах сталей. Хром придает сталям твердость и прочность. Из хромсодержащих сталей изготавливают лопатки газовых турбин и детали реактивных двигателей. Применяется для хромирования изделий.
Соединения хрома
Соединения двухвалентного хрома
Оксид хрома ( II ) CrO
Физические свойства: твердое нерастворимое в воде вещество ярко-красного или черного цвета. При обычной температуре устойчив на воздухе, выше 100°С окисляется:
Химические свойства. CrO – основной оксид.
1. Взаимодействует с кислотами: CrO + 2HCl → CrCl2 + 2H2O
2. Легко окисляется на воздухе при нагревании до оксида хрома (III): 4CrO + O2  2 Cr2O3
2 Cr2O3
3. Восстанавливается водородом до хрома: CrO + Н2  Cr + H2O
Cr + H2O
Получение.
1. При окислении амальгамы хрома на воздухе: 2Cr + O2  2 CrO
2 CrO
2. При прокаливании Сr(ОН)2 в отсутствие кислорода: Сr(ОН)2 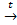 CrO + H2O
CrO + H2O
Cr2O3 + 3Н2  2Cr + 3H2O
2Cr + 3H2O
Г идроксид хрома ( II ) Сr(ОН)2
Физические свойства: твердое нерастворимое в воде вещество желтого цвета.
Химические свойства. Сr(ОН)2 – слабое основание.
1. Взаимодействует только с концентрированными кислотами, образуя соли хрома (II) синего цвета: Cr(OH)2 + 2HCl → CrCl2 + 2H2O
|
|
|
С разбавленными кислотами и щелочами не взаимодействует.
2. Легко окисляется в присутствии влаги кислородом воздуха в Сr(ОН)3:
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
3. При прокаливании разлагается:
а) без доступа воздуха: Сr(ОН)2 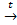 CrO + H2O
CrO + H2O
б) в присутствии кислорода: 4Сr(ОН)2  2 Cr2O3 + 4H2O
2 Cr2O3 + 4H2O
Получение.
1. Действием щелочи на растворы солей Cr(II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
Соли хрома (II). Известны галогениды хрома (II), сульфат и перхлорат, растворы солей окрашены в синий цвет.
1. Все соли хрома (II) – сильные восстановители, в растворах окисляются кислородом воздуха:
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O
2. при отсутствии окислителя восстанавливают даже воду, разлагая её с выделением водорода:
2CrCl2 + 2H2O = 2CrOHCl2 + H2.
3. Получаются при восстановлении солей хрома (III) водородом в момент выделения:
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2H2.
4. Галогениды образуются при взаимодействии простых веществ.
Соединения трёхвалентного хрома
У хрома степень окисления +3 является наиболее устойчивой.
Оксид хрома ( III ) Cr 2 O 3
Физические свойства: темно-зеленое тугоплавкое вещество, нерастворимое в воде.
Химические свойства. Химически инертен. В воде, кислотах и щелочах не растворяется. С трудом растворяется в сильных кислотах при длительном нагревании.
|
|
|
Cr2O3 , полученный осторожным обезвоживанием свежеосажденного Сr(ОН)3, химически активен – проявляет амфотерные свойства.
1. Взаимодействует с кислотами, как основной оксид: Cr2O3 + 6HCl  2 CrCl3 + 3H2O
2 CrCl3 + 3H2O
2. Взаимодействует со щелочами, как кислотный оксид: Cr2O3 + 2NaOH  2NaCrO2 + H2O
2NaCrO2 + H2O
Хромит натрия
Cr2O3 + 2NaOH + 3H2O→2Na3[Сr(ОН)6]
Гексагидроксохромат(III) натрия
3. При сплавлении с карбонатами щелочных металлов образует хромиты, проявляя кислотные свойства: Cr2O3 + Na2CO3  2NaCrO2 + CO2.
2NaCrO2 + CO2.
4. Взаимодействует с кислотными и основными оксидами: Cr2O3 + СаО  Са(CrO2)2
Са(CrO2)2
Cr2O3 + SO3  Cr2(SO4)3
Cr2(SO4)3
5. При высокой температуре восстанавливается водородом, кальцием, углеродом до хрома:
|
|
|
Cr2O3 + 3Н2  2Cr + 3H2O
2Cr + 3H2O
Получение.
1. При окислении хрома: 4Cr + 3O2  2Cr2O3
2Cr2O3
2. При разложении гидроксида хрома (III): 2Сr(ОН)3  Cr2O3 + 3H2O
Cr2O3 + 3H2O
3. При термическом разложении дихромата аммония: (NH4)2Cr2O7  Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
Гидроксид хрома ( III ) Cr ( OH )3
Физические свойства: нерастворимое в воде вещество зелёного цвета.
Химические свойства. Сr(ОН)3 – амфотерный гидроксид
1. Взаимодействует с кислотами, как нерастворимое основание:
2Cr(OH)3 + 3H2SO4 →Cr2(SO4)3 + 6H2O
2. Взаимодействует со щелочами, как нерастворимая кислота: Cr(OH)3 + 3NaOH = Na3[Cr(OH)6].
Cr(OH)3 + KOH(кр)  KCrO2+ 2H2O
KCrO2+ 2H2O
(хромит калия)
3. При нагревании легко разлагается: 2Сr(ОН)3  Cr2O3 + 3H2O
Cr2O3 + 3H2O
Получение.
1. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета: Сr2(SО4)3 + 6NaОН → 2 Сr(ОН)3↓ + 3 Na2SО4,
2. При пропускании углекислого газа через щелочной раствор гексагидроксохромата (III) натрия: Na3[Cr(OH)6] + 3СО2 = Cr(OH)3 + 3NaHCO3.
Соли хрома (III).Хром в степени окисления +3 образует два типа солей, в которые входит в состав
катиона и аниона.
1. Хромиты устойчивы в щелочной среде, в кислой разрушаются:
NaCrO2 + HCl + H2O = Cr(OH)3 + NaCl;
в избытке кислоты: NaCrO2 + 4HCl = CrCl3 + NaCl + 2H2O.
2. Соли Cr3+ проявляют все свойства солей, большинство из них хорошо растворимы в воде и гидролизуются.
Соединения хрома (III) проявляют окислительные и восстановительные свойства:
2CrCl3 + 3H2O2 + 10 KOH = 2K2CrO4 + 6KCl + 8H2O (Cr3+ – восстановитель)
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2H2 (Cr3+ – окислитель)
Соединения шестивалентного хрома
Оксид хрома ( VI ) CrO 3
Физические свойства: твердое вещество темно-красного цвета, хорошо растворимое в воде. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях. Ядовит!
Химические свойства. CrO3 – кислотный оксид. Очень сильный окислитель.
1. Взаимодействует с водой, образуя кислоты: CrO3 + H2O → H2CrO4 хромовая кислота
2 CrO3 + H2O → H2Cr2O7 дихромовая кислота
2. Взаимодействует со щелочами, образуя соли желтого цвета-хроматы:
CrO3 + 2KOH → K2CrO4 + H2O
3. Реагирует с основными оксидами: CrO3 + BaO = BaCrO4
4. Оксид хрома (VI) – очень сильный окислитель, окисляет фосфор, углерод и серу, многие органические вещества:
4CrO3 + 3C = 2Cr2O3 + 3CO2;
4CrO3 + C2H5OH + 6H2SO4 = 2Cr2(SO4)3 + 2CO2 + 9H2O.
5. Термически неустойчив: 4 CrO3 → 2Cr2O3 + 3O2 ↑
Получение.
1. Получают из хромата (или дихромата) калия действием H2SO4(конц.).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
Гидроксид ы хрома ( V I) H2CrO4 - хромовая кислота , H2Cr2O7 - дихромовая кислота
Хромовые кислоты в свободном состоянии не выделены, в растворе проявляют свойства сильных кислот.
В растворе хромовых кислот существует равновесие: 2H2CrO4 = H2Cr2O7 + H2O.
Обе кислоты неустойчивы, при попытке их выделения в чистом виде распадаются на воду и оксид хрома (VI). Однако соли их вполне устойчивы.
Хроматы – соли хромовых кислот. Хроматы – соли хромовой кислоты – имеют в своем составе анион CrO42- и обладают желтой окраской, дихроматы – соли дихромовой кислоты – содержат анион Cr2O72- оранжевого цвета.
1. Хроматы устойчивы в щелочной среде, а дихроматы – в кислой.  Хроматы в кислой среде переходят в дихроматы, а дихроматы в щелочной среде – в хроматы, эти явления сопровождаются соответствующим изменением окраски раствора.
Хроматы в кислой среде переходят в дихроматы, а дихроматы в щелочной среде – в хроматы, эти явления сопровождаются соответствующим изменением окраски раствора.
|
|
|
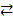 Cr2O72- + H2O. Cr2O72- + 2ОН–
Cr2O72- + H2O. Cr2O72- + 2ОН– 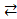 2CrO42- + H2O
2CrO42- + H2O
|
2K2CrO4 + H2SO4 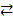 K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + КОН
K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + КОН 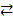 2K2CrO4 + H2O
2K2CrO4 + H2O
2. Хроматы и особенно дихроматы - сильные окислители, восстанавливаются до соединений хрома (III).
· В нейтральной среде образуется гидроксид хрома (III):
K2Cr2O7 + 3Н2S + H2O = 2Cr(OH)3 + 3S↓ + 2KOH
· в кислой соли хрома (III):
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O;
· в щелочной – производные анионного комплекса [Cr(OH)6]3-:
2K2CrO4 + 3(NH4)2S + 2KOH + 2H2O = 2K3[Cr(OH)6] + 3S + 6NH3.
Применение соединений хрома
Оксид хрома (II) применяется в качестве адсорбента для очистки углеводородов от кислорода.
Оксид хрома (III) служит пигментом лаков и красок, применяется в качестве абразивного материала.
Дихромат калия используется в качестве окислителя в органическом синтезе, протравы при крашении, компонентов состава для спичек, ингибиторов коррозии металлов и сплавов.
Дата добавления: 2019-02-22; просмотров: 607; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
