Характеристика цинка и его соединений
Сплав меди и цинка – латунь – был получен намного раньше, чем металлический цинк: самые древние латунные предметы, сделанные примерно в 1500 г. до н.э., найдены при раскопках в Палестине. Цинк входит в состав еще одного древнего сплава – бронзы. Точная дата открытия цинка и имя его первооткрывателя не установлено. Известно, что в Индии его получали еще в V в. до н.э., получение металлического цинка описано у римского историка Страбона в 60–20 гг. до н.э., в XIII в. Марко Поло описал получение цинка в Персии, о нем писали в XVI в. Парацельс и Агрикола. Первое промышленное производство цинка началось в 1743 г. в Бристоле.
Название происходит от латинского слова, означающего «бельмо» или «белый налет».
Распространенность в природе
В свободном состоянии в природе не встречается. Образует более 70 минералов, важнейшими из которых являются: сфалерит (цинковая обманка) ZnS, смитсонит ZnCO3, каламин Zn4(OH)2Si2O7 · H2O, цинкит ZnO, виллемит Zn2SiO4, франклинит ZnFe2O4. Цинк содержится в океанической воде.
Положение в ПСХЭ Д.И. Менделеева
· Находится в IV периоде, во II группе, в побочной подгруппе
· d-элемент - валентные электроны 3d104s2. В образовании химических связей участвуют только 4s2 электроны, поскольку конфигурация d10 является очень устойчивой.
· В соединениях для цинка характерна степень окисления +2.
Физические свойства.
Цинк – голубовато-белый металл, хрупкий при комнатной температуре, при нагревании до 100–150 °С становится пластичным и прокатывается в тонкие листы и проволоку, при 200–250 °С снова становится хрупким. Температура плавления 420°С, температура кипения 906°С, плотность 7,13 г/см3. На воздухе серебро покрывается плотной тонкой пленкой оксида цинка.
|
|
|
Химические свойства цинка
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
IV. Взаимодействие с простыми веществами.
1. Взаимодействие с неметаллами
а) При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка: 2Zn + O2 = 2ZnO.
б) При поджигании энергично реагирует с серой: Zn + S = ZnS.
в) С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора: Zn + Cl2 = ZnCl2.
г) При действии паров фосфора на цинк образуются фосфиды: Zn + 2P = ZnP2 или
3Zn + 2P = Zn3P2.
д) Цинк не взаимодействует: с водородом, азотом, бором, кремнием, углеродом.
V. Взаимодействие со сложными веществами.
|
|
|
1. Взаимодействие с водой - при нагревании, с парами воды: Zn + H2O(пар) = ZnO + H2↑
2. Взаимодействие с сероводородом: при нагревании: Zn + H2S = ZnS + H2↑
3. Взаимодействие с кислотами:
а) вытесняет водород из неокисляющих кислот: Zn + 2HCl = ZnCl2 + H2;
Zn + H2SO4 = ZnSO4 + H2.
б) взаимодействует с разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O.
в) реагирует с концентрированными серной и азотной кислотами:
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
4. Взаимодействие со щелочами: Реагирует с растворами щелочей с образованием гидроксокомплексов: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты: Zn + 2KOH = K2ZnO2 + H2.
Взаимодействие с аммиаком
а) С газообразным - при 550–600°С образуя нитрид цинка: 3Zn + 2NH3 = Zn3N2 + 3H2;
б) в водном растворе - образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O = [Zn(NH3)4](OH)2 + H2.
Взаимодействие с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов: Zn + CuSO4 = Cu + ZnSO4;
|
|
|
Zn + CuO = Cu + ZnO.
Способы получения цинка
Для получения металлического цинка используют гидро- и пирометаллургический процесс.
При переработке цинковых руд в результате их обогащения получают цинковый концентрат, который подвергают обжигу: 2ZnS + 3O2 = 2ZnO + 2SO2
Затем из оксида цинка получают металлический цинк двумя способами.
Пирометаллургический процесс
Оксид цинка восстанавливают коксом при температуре 1250–1350°С: ZnO + C = Zn + CO;
Гидрометаллургический процесс
Оксид цинка растворяют в серной кислоте: ZnO + H2SO4 = ZnSO4 + H2O;
Полученный раствор сульфата цинка подвергают электролизу, на катоде выделяется цинк:
ZnSO4 + 2H2O 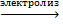 Zn + O2 + Н2 + H2SO4.
Zn + O2 + Н2 + H2SO4.
Применение.
Металлический цинк используется в качестве антикоррозионного покрытия железа и стали, применяется в аккумуляторах и типографском деле. В металлургии используется для отделения свинца от серебра и золота, для выделения кадмия, индия, золота из растворов, в качестве восстановителя в органическом синтезе.
Соединения цинка
Оксид цинка (II) ZnO
– белые кристаллы, при нагревании приобретают желтую окраску. Тугоплавкий (tпл =20000C). Плохо растворим в воде.
Химические свойства. ZnO – амфотерный оксид. С водой не взаимодействует.
|
|
|
1. Реагирует с растворами кислот и щелочей: ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
2. При сплавлении с оксидами металлов образует цинкаты: ZnO + CoO = CoZnO2.
3. При взаимодействии с оксидами неметаллов образует соли: 2ZnO + SiO2 = Zn2SiO4,
ZnO + B2O3 = Zn(BO2)2.
4. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом: ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O.
Получение.
1. При горении металлического цинка: 2Zn + O2 = 2ZnO;
2. При термическом разложении солей: ZnCO3 = ZnO + CO2.
Применение. Оксид цинка применяется в качестве белого пигмента красок, является активатором вулканизации и наполнителем в резиновой промышленности, используется в косметической промышленности и в медицине.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Zn(OH)2 = ZnO + H2O.
Дата добавления: 2019-02-22; просмотров: 494; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
