КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ ПРОЦЕССОВ УСТАНОВЛЕНИЯ РАВНОВЕСИЯ В СТАТИСТИЧЕСКИХ СИСТЕМАХ
НАЗНАЧЕНИЕ
Учебная программа "ЭНТРОПИЯ" предназначена для изучения понятия энтропии и процессов установления равновесия в статистических системах методом компьютерного моделирования. Она рассчитана на выполнение лабораторной работы в течение 2-4 часов.
Программа написана на алгоритмическом языке PASCAL и требует использования IBM совместимых компьютеров с мониторами CGA, EGA, VGA. Для работы программы необходимо, чтобы вместе с рабочим файлом (entropy.exe) в той же директории находилcя файл cga.bgi.
ЦЕЛЬ РАБОТЫ
Исследовать:
поведение энтропии в процессе установления равновесия и в состоянии
равновесия;
зависимость времени установления равновесия от длины пробега частицы и числа частиц;
зависимость величины флуктуаций энтропии в состоянии равновесия от числа частиц.
КРАТКАЯ ТЕОРИЯ
Самым детальным описанием состояния макроскопической системы является задание координат и импульсов всех частиц. Такое описание состояния системы называется микросостоянием. Если координаты и импульсы задавать с допусками ∆x, ∆y, ∆z, ∆px , ∆py и ∆pz , то указание микросостояния каждой частицы равносильно указанию ячейки, как в обычном (координатном) пространстве, так и в пространстве импульсов. Пространство шести измерений, осями которого являются координаты и компоненты импульса называется фазовым пространством для частицы. Для N частиц фазовое пространство содержит 6N измерений (удвоенное число степеней свободы). Микросостояние всей системы в фазовом пространстве задается одной точкой (или ячейкой).
|
|
|
Состояние термодинамической системы может быть также задано при помощи макроскопических параметров, характеризующих систему в целом: объёма, давления, температуры и т.д. Такое описание называется макросостоянием.
Если система находится в состоянии термодинамического равновесия, то её макросостоняие не изменяется. Частицы же все время перемещаются и изменяют свой импульс. Это соответствует изменению положения точки в фазовом пространстве. Следовательно, всякое макросостояние может быть реализовано множеством микроскопических способов. Число микросостояний, посредством которых может быть реализовано данное макросостояние, называется статистическим весом W макросостояния.
Рассмотрим пример. Ради простоты разобьём пространство всего на две ячейки (правую и левую половину сосуда). Импульс частицы учитывать не будем.
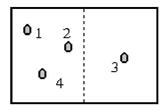
Рис.1
Распределение N молекул между левой и правой половинами сосуда (n1 :n2).
Различные макросостояния будем отличать по тому, сколько частиц содержится в правой и левой половинах объёма соответственно. Микросостояния будут отличаться тем, какие частицы содержатся в той или иной половине сосуда. Для подсчёта статистического веса каждого макросостояния, например, W(n1 : n2) (что означает: слева находится n1 частиц, справа n2= N- n1), можно применить следующие соображения. Начнём переставлять частицы местами. Для N частиц возможно
|
|
|
N! = N⋅(N - 1)⋅...⋅1 (1)
перестановок. Однако перестановки в пределах каждой половины сосуда не дадут нового микросостояния. Их число равно n1! и n2! соответственно. Поэтому полное число микросостояний для макросостояния (n1 : n2) равно
W(n1 : n2) = N! / (n1 !⋅n2 !). (2)
Каждая молекула может быть помещена в сосуд двумя способами, а N молекул - 2⋅2⋅2⋅... = 2N , т.е. всего микросостояний возможно 2N. В статистической физике доказывается, что все микросостояния равновероятны. Поэтому вероятность каждого макросостояния будет пропорциональна статистическому весу и в нашей модели равна
P(n1 : n2) = W(n1 :n2) / 2N . (3)
Пусть N=4. Рассмотрим различные макросостояния и способы их реализации.
Таблица 1. Варианты распределения 4 молекул в сосуде.
| Макросостояние: число молекул слева:справа | Микросостояния: номера молекул слева/справа | Статистический вес W | Вероятность P |
| 0:4 | - / 1, 2, 3, 4 | 1 | 1/16 |
| 1:3 | 1/ 2, 3, 4 2/ 1, 3, 4 3/ 1, 2, 4 4/ 1, 2, 3 | 1·2·3·4/(1·1·2·3)=4 | 1/4 |
| 2:2 | 1, 2 / 3, 4 1, 3 / 2, 4 1,4 / 2, 3 2,3 / 1, 4 2,4 / 1, 3 3,4 / 1, 2 | 1·2·3·4/(1·2·1·2)=6 | 6/16 |
| 3:1 | аналогично 1:3 | 4 | 1/4 |
| 4:0 | аналогично 0:4 | 1 | 1/16 |
Статистический вес, как мера вероятности макроскопического состояния обладает рядом неудобств. Во-первых, статистический вес реальных систем выражается огромными числами. Во-вторых, статистический вес не обладает свойствами аддитивности. Статистический вес двух подсистем равен произведению статистических весов каждой подсистемы W = W1⋅W2 Взяв логарифм от правой и левой части получим, что логарифм статистического веса - аддитивная величина ln(W) = ln(W1) + ln(W2) Величина
|
|
|
S = k⋅ln(W), (4)
где k - постоянная Больцмана, называется энтропией системы. Энтропия, как и статистический вес, является мерой вероятности состояния: чем больше статистический вес (и вероятность), тем больше энтропия. Энтропия является аддитивной величиной:
S = S1 + S2. (5)
В термодинамике изменение энтропии при квазистатическом процессе выражается через количество теплоты, полученное системой
|
|
|
dS = δ Q / T. (6)
Действительно, подвод тепла приводит либо к увеличению объёма газа, либо к повышению его температуры (т.е. "расширению" газа в импульсном пространстве). Оба процесса приводят к увеличению числа ячеек в фазовом пространстве и, следовательно, к росту статистического веса. Природа необратимости термодинамических процессов состоит в том, что переходы к состоянию с большим статистическим весом являются намного более вероятными, чем обратные. Следовательно, в таких системах будет наблюдаться возрастание энтропии, а в состоянии равновесия она будет оставаться постоянной (с точностью до малых случайных флуктуаций!). Это утверждение носит название второго начала термодинамики.
ОПИСАНИЕ МОДЕЛИ
Представленная программа моделирует хаотическое движение N невзаимодействующих частиц и их перераспределение между двумя половинами объема. На каждом шаге для каждой молекулы длина пробега от 0 до некоторого максимального значения и направление движения задаются случайным образом.
После каждого шага определяется число частиц в каждой половине объема, вычисляются статистический вес и энтропия состояния. Полученные значения выводятся на табло и график. На экране отображается также движение всех "молекул".
Изменяемыми параметрами являются число частиц N (от 4 до 40), максимальная длина свободного пробега (в пикселах) а также продолжительность опыта (до 250 шагов).
Первоначально все молекулы находятся в левой части объема, затем в результате хаотического движения происходит установление равновесного состояния.
Запуск программы осуществляется командой
entropy.exe <ENTER>
Работа производится в диалоговом режиме, все указания выдаются на экран.
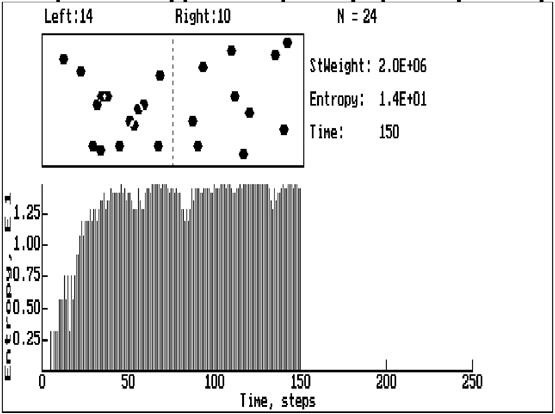
Рис 2. Рабочий экран модели.
ЗАДАНИЯ
1. Выбрав произвольно N (рекомендуем 10-16) и задавая последовательно 4-5 значений максимальной длины свободного пробега (от 10 до 50 пиксел), наблюдать процесс установления равновесия. Равновесие считать установившимся, когда молекулы достаточно равномерно распределятся в сосуде.
Запишите время релаксации для каждого опыта (в шагах). (Время релаксации определяется приближенно.) Обратите внимание на изменение характера поведения энтропии после установления равновесия. (Рекомендуемая продолжительность опыта - 100-150 шагов).
2. Для фиксированной длины свободного пробега аналогично исследовать зависимость времени релаксации от числа частиц (4-5 опытов)
3. Сравнить величину равновесных флуктуаций энтропии для различного числа частиц (3-4 опыта). Для выделения состояния равновесия необходимо после окончания опыта по запросу программы указать время релаксации, после которого равновесие можно считать установившимся. Мерой флуктуаций являются среднеквадратичное отклонение d S
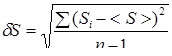 (7)
(7)
где <S> - среднее значение энтропии, и коэффициент вариации
ε = d S / <S> (8)
вычисляются программой в конце каждого опыта (запишите в отчет!).
В этих опытах для быстрого установления равновесия рекомендуем установить большую длину свободного пробега (40 - 50). Время опыта рекомендуем установить максимальным (250 шагов).
4. Распечатать картинку одного из опытов (при наличии принтера)(по п. 2) и вклеить его в отчет, или изобразить на графике примерный ход энтропии в процессе установления равновесия.
Сформулируйте письменно выводы:
1. Как время релаксации зависит от длины свободного пробега? От числа частиц?
2. Охарактеризуйте изменение энтропии до и после установления равновесия. Наблюдается ли самопроизвольное уменьшение энтропии после установления равновесия?
3. Как относительная величина флуктуаций зависит от числа частиц?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое микроскопическое и макроскопическое состояния? Рассмотрите случай распределения n частиц по двум половинам сосуда:
а. Две частицы из разных половин поменяли местами. Изменится ли макроскопическое состояние системы? Микроскопическое состояние системы?
б. Две частицы в одной половине сосуда поменяли местами. Изменится ли макроскопическое состояние системы? Микроскопическое состояние системы?
в) Частицу переместили из одной половины сосуда в другую. Охарактеризуйте изменение состояния системы.
2. Вычислить статистический вес состояний:
а) слева - 4 частицы, справа - 2 (условно 4 : 2).
б) (3:3)
Какое состояние более вероятно?
3. Какая существует связь между статистическим весом и энтропией? Как вычисляется статистический вес и энтропия системы, состоящей из двух (или нескольких) подсистем? Как вероятность P макросостояния связана с его статистическим весом W? Как отношение вероятностей P2 / P1 двух макросостояний связано с разностью энтропий в этих состояниях S = S2 - S1 ?
4. Как вычисляется изменение энтропии в термодинамике для равновесных процессов? Объясните изменение энтропии с точки зрения статистической физики:
при изотермическом расширении,
при изохорном нагревании,
при адиабатическом процессе.
ЛИТЕРАТУРА
[1] §§ 80, 81;
[3] §§ 49-51, 58-59; [5] 6.7, 6.11-6.15.
ЛАБОРАТОРНАЯ РАБОТА № 2-14
Дата добавления: 2019-02-12; просмотров: 177; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
