ПОСТРОЕНИЕ КРИВОЙ ФАЗОВОГО РАВНОВЕСИЯ ВОДЫ
ЦЕЛЬ. Построить кривую фазового равновесия воды. Определить теплоту испарения.
ОБОРУДОВАНИЕ. Лабораторный комплекс ЛКТ-1, модуль "Газ-жидкость".
КРАТКАЯ ТЕОРИЯ
Фазой называется макроскопическая физически однородная часть вещества, отделенная от остальных частей системы границами раздела, так что она может быть извлечена из системы механическим путем.
При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие двух фаз может иметь место лишь в определенном интервале температур, причем каждому значению температуры Т соответствует вполне определенное давление Р, при котором возможно равновесие. Таким образом, состояния равновесия двух фаз изобразятся на диаграмме (Р,Т) линией:
Р = f(Т). (1)
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества тепла, которое называется скрытой теплотой перехода. Такие переходы называются фазовыми переходами первого рода.
В жидкостях при любой температуре имеется некоторое количество молекул, энергия которых оказывается достаточной для того, чтобы преодолеть притяжение к другим молекулам, покинуть поверхность жидкости и перейти в газообразную фазу. Переход жидкости в газообразное состояние называется испарением.
|
|
|
При испарении жидкость покидают наиболее быстрые молекулы, вследствие чего средняя энергия оставшихся молекул уменьшается, жидкость охлаждается. Чтобы поддерживать температуру испаряющейся жидкости неизменной, к нему нужно непрерывно подводить тепло.
Тепло q, которое необходимо сообщить единице массы вещества для того, чтобы превратить ее в пар, находящийся при той же температуре, какую имело вещество до испарения, называется удельной теплотой испарения.
Рассмотрим процесс установления равновесия между жидкостью и ее паром. Пусть в закрытом сосуде заключена некоторая масса жидкости, над которой находится ее пар. Объем сосуда остается неизменным, а температура поддерживается постоянной. Происходит непрерывный обмен молекулами между этими двумя фазами.
Когда число молекул, переходящих из жидкости в пар, равно числу молекул, переходящих из пара в жидкость, наступает состояние динамического (или статистического равновесия), в котором количество вещества в каждой фазе в среднем остается неизменным. Это и есть состояние фазового равновесия. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением насыщенного пара.
|
|
|
Состояние вещества можно изобразить точкой на плоскости Т- Р (рис.1)
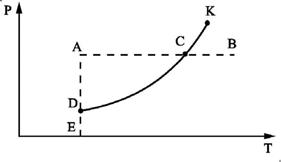
Рис. 1
Каждая точка этой плоскости соответствует однородному (однофазному) состоянию вещества - либо жидкости, либо ее пару. На линии DK эти фазы находятся в равновесии друг с другом. Каждая точка линии DK изображает либо жидкость, либо ее пар, либо смесь этих фаз в любых пропорциях.
Уравнение кривой DK представляется в виде Р = Р(Т) и показывает зависимость давления насыщенного пара от температуры. Кривая DK называется кривой равновесия жидкости и ее насыщенного пара или кривой испарения.
Пусть давление на изобаре АВ меньше критического. В точке А вещество находится в жидком состоянии. Здесь давление Р = ЕА выше давления насыщенного пара Р = ЕD при той же температуре. Под таким давлением пар существовать не может. При нагревании жидкости при постоянном давлении в точке С пересечения изобары АВ с кривой испарения DK начнется испарение жидкости. Во время испарения температура жидкости и ее насыщенного пара будет оставаться неизменной, пока вся жидкость не испарится. Изображающая точка при дальнейшем нагревании будет перемещаться вдоль отрезка СВ - этому соответствует нагревание пара.
|
|
|
Следствием обрыва кривой испарения в критической точке К является непрерывность жидкого и газообразного состояний вещества.
Найдем наклон кривой испарения. Для этого вычислим производную давления насыщенного пара по температуре dP/dT. При смещении вдоль кривой испарения, так как условием равновесия фаз является равенство их удельных термодинамических потенциалов
ϕ1 (Р,Т) = ϕ2 (Р,Т) , (2)
имеем: dϕ1 = dϕ2 .
Так как потенциал Ф=U-TS + PV, (3)
и dϕ = -SdT + VdP, тогда V1dP - S1dT = V2dP - S2dT,
или 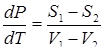 (4)
(4)
где S1, V1 ; S2, V2 - удельные энтропии и удельные объемы пара и жидкости.
Фазовые превращения сопровождаются скачкообразными изменениями энтропии. При таких превращениях поглощается или выделяется тепло. Например, при переходе единицы массы вещества из газообразного состояния 1 в жидкое состояние 2 выделяется тепло
q = T(S1 - S2). (5)
При обратном переходе такое же тепло поглощается. Тепло q в общем случае называется удельной теплотой фазового превращения. Используя (4) и (5), получим:
|
|
|
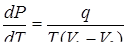 -- (6)
-- (6)
Это выражение называется уравнением Клапейрона-Клаузиуса.
Если известны зависимости от температуры удельной теплоты испарения q и удельных объемов V1 и V2, то (6) можно проинтегрировать и найти зависимость давления насыщенного пара от температуры.
В грубом приближении удельным объемом жидкости по сравнению с удельным объемом пара можно пренебречь. Будем считать, что к пару применимо уравнение состояния Клапейрона PV = 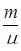 RT .
RT .
Тогда 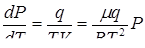 , (7)
, (7)
или 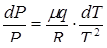
Откуда удельная теплота испарения
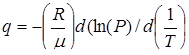 (8)
(8)
где R = 8,31 Дж/(моль · K)- универсальная газовая постоянная;
µ - молярная масса.
МЕТОДИКА ЭКСПЕРИМЕНТА
Фазовое равновесие воды исследуется на модуле 02 "Газ - жидкость", основным элементом которого является автоклав (см.рис.2).
В полость корпуса автоклава через верхнее отверстие наливают дистиллированную или кипяченую воду до уровня ho, соответствующему нулевому делению шкалы 8. Вода заполняет всю широкую нижнюю часть полости и входит в нижнюю часть канала. При закрывании канала пробкой в нем образуется герметизированная заполненная воздухом полость, начальный объем Vo которой определяется площадью S0 сечения канала, начальным уровнем жидкости ho(определяется по шкале мерной трубки) и уровнем нижнего торца пробки h1 (определяется конструкцией прибора)
V0 = S0 (h1 - ho). (9)
При нагревании корпуса, а вместе с ним и его содержимого, до температуры Т, воздух в канале расширяется, кроме того, к нему добавляются пары воды. Вода из полости вытесняется в мерную трубку, где поднимается до нового уровня h. Объем вытесненной жидкости:
V = S (h - h0), (10)
где S - площадь сечения канала трубки.
Суммарное давление воздуха Рв и паров Рп практически равно атмосферному давлению Р0 = 100 кПа. Таким образом,
Рв = Р o - Рп .
АВТОКЛАВ
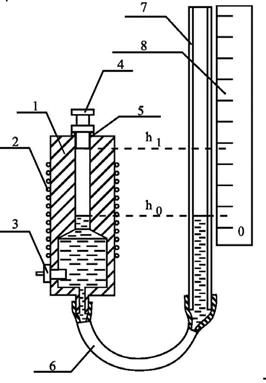
1 - металлический корпус; 2 - наргевательная обмотка;
3 - датчик температуры; 4 - пробка; 5 - уплотнительное кольцо;
6 - шланг; 7 - мерная трубка; 8 - измерительная шкала.
Рис. 2
Используя уравнение объединенного газового закона для воздуха
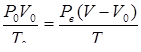 ,
,
находим давление пара
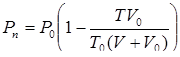 (11)
(11)
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Установите модуль 02 ГАЗ - ЖИДКОСТЬ" в рабочей зоне каркаса и подключите разъем "ТЕРМОСТАТ" модуля к одноименному разъему ИСТ - 1.
2. Тумблер "АВТОКЛАВ/РЕЗОНАТОР" установите в среднее положение.
3. Тумблер выбора режима измерений поставьте в положение (напряжение). Установить ручкой плавной регулировки на ИСТ-1 рабочее напряжение 30 ± 1 В.
4. Переключите тумблер выбора режима на измерение температуры.
5. Включить тумблер датчика Д1 на ИСТ-1.
6. Тумблер "АВТОКЛАВ/РЕЗОНАТОР" установите в положение "АВТОКЛАВ" на модуле 02. При подаче напряжения на нагреватель течет ток и повышается температура.
7. Регулятором "ТЕМП" задается требуемое значение температуры, начиная, приблизительно, с 400С.
8. Достигнув нужной температуры, выждите 1-2 минуты, запишите температуру Т и уровень жидкости h.
Уровень воды в мерной трубке измеряйте в диапазоне температур от комнатной (Тo) до 90-950С. Шаг измерений: 10 градусов при температуре до 800С и 2-3 градуса при температуре выше 800С.
Перед каждым измерением выдерживайте постоянное значение температуры 1-2 минуты. Всего должно быть 10-11 измерений.
После достижения конечной максимальной температуры 90-950С, поверните ручку напряжения нагрева до нуля. Регулятор "ТЕМП" переведите в нулевое положение (загорится красная лампочка). Выключите датчик Д1. Переведите тумблер "АВТОКЛАВ/РЕЗОНАТОР" в среднее положение. Отключите от сети ИСТ-1.
9. Результаты измерений занесите в таблицу.
h0 = 0 см; h1 = 6,27 см; S0 = 0,28 см2; V0 = 1,75 см3.
| to, C | Т, K | h, см | V, см3 | РП, кПа | q, МДж/кг |
| Комнатная | |||||
10. Используя полученные значения для V и Рп , вычисляемые по формулам (10) и (11), соответственно, определите удельную теплоту испарения q. Как следует из (8), для двух значений Рп1 и рп2 и соответствующим им температур Т1и Т2 , можно записать:
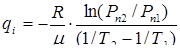 , (12)
, (12)
где R - универсальная газовая постоянная;
μ = 18 · 10-3 кг/моль - молярная масса воды.
Результат вычисления q заносите в таблицу.
11. Дальше подобным образом сравниваются второе и третье измерения, и т.д. Результаты qi заносятся в таблицу.
По данным температуры Т, давления пара Рп и удельной теплоты испарения q постройте в соответствующих масштабах кривые Рп = Рп(Т) и q = q(Т).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется фазой? Какие вы знаете фазы?
2. При каких условиях наступает равновесие фаз? Как изображается равновесие фаз?
3. Как происходит испарение? Нарисуйте кривую равновесия
жидкости и пара.
4. Получите уравнение Клапейрона-Клаузиуса.
5. Как определить удельную теплоту испарения воды?
6. Выведите выражение для определения давления насыщенного пара.
ЛИТЕРАТУРА
[I] §§ 111-116;
[2]; [3] §§ 114,118;
[5] 17.1-17.6;
[II] стр. 266-269;
[13] стр. 111-118.
ЛАБОРАТОРНАЯ РАБОТА № 2-12
Дата добавления: 2019-02-12; просмотров: 393; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
