ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ВОЗДУХА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
ЦЕЛЬ. Определить показатель адиабаты для воздуха.
ОБОРУДОВАНИЕ. Баллон, ручной насос, манометр.
КРАТКАЯ ТЕОРИЯ
Теоретические основы I начала термодинамики.
Первое начало термодинамики выражает принцип сохранения энергии для тех макроскопических явлений, в которых одним из существенных параметров, определяющих состояние тел, является температура.
В теоретических методах термодинамики широко используются так называемые квазистатические или квазиравновесные процессы, т.е. идеализированные процессы, состоящие из непрерывно следующих друг за другом состояний равновесия.
В термодинамике равновесные состояния макроскопических систем описываются с помощью небольшого числа различных макроскопических параметров. Термодинамически равновесное состояние газа, например, в отсутствии внешних полей полностью определяется его массой, химической природой, давлением и температурой. Объем V, в котором заключен газ, не является независимым параметром, и может быть вычислен из уравнения состояния. Для идеального газа, в котором взаимодействием молекул между собой можно пренебречь, состояние описывается уравнением Менделеева-Клапейрона:
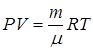 (1)
(1)
где Р,V, m - основные термодинамические параметры газа;
R - универсальная газовая постоянная.
Внутренней энергией какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле. В понятие внутренней энергии газа включаются кинетическая энергия хаотического движения молекул, потенциальная энергия взаимодействия между молекулами и внутримолекулярная энергия (двумя последними энергиями для идеального газа можно пренебречь). Изменение внутренней энергии при переходе системы из одного состояния в другое будет всегда равно разности значений внутренней энергии в этих состояниях, независимо от пути или процесса (совокупности процессов), приведших к переходу системы из одного состояния в другое. Внутренняя энергия произвольной массы т идеального газа будет равна:
|
|
|
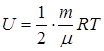 (2)
(2)
где i- число степеней свободы молекул газа.
Для одноатомного газа i= 3, что отражает возможность поступательно перемещаться вдоль пространственных координатных осей x , y , z .
Для двухатомного газа i= 5, к трем поступательным степеням свободы добавляются две вращательные. Для трехатомных и многоатомных молекул газа i = 6. Здесь добавляются три вращательные степени свободы. Если атомы в молекуле связаны не жестко, то возможны колебания вдоль связей, что дополнительно увеличивает число степеней свободы молекулы. Число колебательных степеней свободы определяется числом атомов в молекуле и ее структурой.
|
|
|
Макроскопическая работа, совершаемая газом при подводе тепла к системе, определяется выражением:
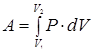 (3)
(3)
Работа определяется заданием начального и конечного состояний системы. Ее величина зависит также от способа или "пути" перехода системы из начального состояния в конечное. Как следует из (3) , работа газа равна площади фигуры, ограниченной графиком Р= f(V), изохорами V = V1, V = V2, а также осью абсцисс.
Количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Q = D U + A. (4)
Равенство (4) выражает закон сохранения энергии и представляет собой содержание первого начала термодинамики. Если Q > 0, то к системе подводится тепло, если Q < 0 - отводится.
Дата добавления: 2019-02-12; просмотров: 324; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
