ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
ЦЕЛЬ. Экспериментальное определение универсальной газовой постоянной и постоянной Больцмана.
ОБОРУДОВАНИЕ. Лабораторный комплекс ЛКТ-1; баллон с резиновым шлангом и зажимом; весы с разновесами; соединительные силиконовые шланги.
КРАТКАЯ ТЕОРИЯ
Давление Р,оказываемое газом на стенки сосуда, обусловлено тем, что молекулы при своем хаотическом движении сталкиваются не только друг с другом, но и со стенками сосуда. Эти столкновения определяют силу, испытываемую стенкой со стороны газа. Средняя сила, действующая на единицу площади, и есть давление. Давление газа будет тем больше, чем больше концентрация молекул и скорость их теплового движения. Следовательно, такой макроскопический параметр газа, каким является давление, зависит от поведения отдельных молекул, т.е. от микроскопических параметров теплового движения. Количественная связь между давлением газа и микроскопическими параметрами молекул устанавливается в молекулярно-кинетической теории идеальных газов. Основное уравнение МКТ имеет вид:
 , (1)
, (1)
где n - число молекул в единице объема,
<v2> - среднее значение квадрата скорости молекул.
Одной из важных величин, характеризующих макросистему, является энергия U. В случае идеального газа, состоящего из N атомов, совершающих поступательное хаотическое движение,
 , (2)
, (2)
|
|
|
где <E> - средняя кинетическая энергия поступательного движения одной молекулы,
N – число молекул в атоме,
m о - масса одной молекулы.
Поскольку энергия есть величина аддитивная, U является функцией объема V . Заметим, что давление  . Действительно, с учетом (2) выражение (1) можно переписать:
. Действительно, с учетом (2) выражение (1) можно переписать:
 (3)
(3)
Средняя кинетическая энергия движения молекул определяет другой важный параметр состояния газа - температуру Т. Как известно, средняя энергия молекулы одноатомного идеального газа равна:
 (4)
(4)
где k - коэффициент пропорциональности, устанавливающий связь между температурой, выраженной в единицах энергии (джоули), и температурой, выраженной в градусах. Коэффициент k называется постоянной Больцмана. Подставим (4) в (3), находим:

откуда:  (5)
(5)
Мы получили уравнение классического идеального газа. Оно связывает давление, объем и температуру газа. Так как в уравнение (5) не входит никакой величины, характеризующей природу конкретного газа, то оно пригодно для любых классических идеальных газов (при выводе мы пренебрегли взаимодействием атомов, лишив тем самым газ его "индивидуальности").
|
|
|
Получим уравнение состояния для 1 моля идеального газа. В одном моле газа содержится атомов

Указанное число N А называют постоянной Авогадро. Тогда для 1 моля уравнение (5) примет вид:
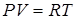 , (6)
, (6)
где R = NА. k - называют универсальной газовой постоянной. Она имеет размерность [Дж/моль·К].
Для произвольной массы газа уравнение (5) принимает вид:
 , (7)
, (7)
где m - масса взятого газа,
 - его молярная масса.
- его молярная масса.
В данной работе предлагается использовать уравнение (7) для экспериментального определения универсальной газовой постоянной.
МЕТОДИКА ЭКСПЕРИМЕНТА
В баллоне объемом V при комнатной температуре Т находится воздух массой m1. Давление воздуха - Р1, оно равно атмосферному (~ 105 Па). Состояние газа в баллоне описывается уравнением:
 . (8)
. (8)
Будем медленно накачивать воздух в баллон, увеличивая давление газа до Р2. В новом состоянии уравнение (7) будет иметь вид:
 , (9)
, (9)
|
|
|
где m2 - масса газа в баллоне в новом состоянии.
При медленном накачивании процесс протекает изотермически вследствие
теплообмена с окружающей средой. Таким образом, можно считать, что:
 . (10)
. (10)
Объем баллона также остается неизменным
 . (11)
. (11)
Решая совместно (8) и (9) с учетом (10) - (11), находим:
 (12)
(12)
Получим искомую рабочую формулу
 (13)
(13)
Определив экспериментально газовую постоянную R, можно вычислить постоянную Больцмана:
 (14)
(14)
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Внимание: Перед выполнением работы ознакомьтесь с устройством лабораторного комплекса ЛКТ-1, принципом работы газогенератора и его измерительной системы (см. инструкцию).
1. При помощи силиконовых шлангов произведите соединение в газогенераторе, по схеме с манометром высокого давления (см. инструкцию).
|
|
|
2. Определите взвешиванием массу m1 баллона объемом V , внутри которого воздух при атмосферном давлении P1.
3. Подключите баллон объемом V1 = 2,05 л к компрессору с манометром M1. (Наденьте шланг баллона на штуцер над указателем [К]). Включите тумблер питания. Кран компрессора должен находиться в положении "закрыто".
4. Вращая ручку плавной регулировки, медленно повышайте давление воздуха. За изменением давления следите по манометру. Шкала манометра проградуирована в миллиметрах ртутного столба. Давление ∆P = 300 мм рт.ст. соответствует 40 кПа. Манометр показывает разницу между атмосферным давлением и давлением в баллоне - ∆P.
5. Доведите дополнительное давление до значения ∆P = 150 мм.рт.ст. Закройте кран на шланге баллона. Вновь произведите взвешивание баллона. Новое значение давления P2 = P1 + ∆P и массы m2 занесите в таблицу:
| m1 | m2 | V | T | P1 | 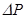
| P2 | R | 
|
6. Повторите пп.3-5, увеличивая ∆P до250-300 мм рт.ст. и производя измерения через каждые 50 мм рт.ст.
7. Произведите аналогичные измерения с баллонами другого объема (V2 = 1,55 л; V3 = 1,3 л).
8. Рассчитайте по формуле (13) универсальную газовую постоянную. Произведите статистическую обработку данных. Запишите результат в виде:
 .
.
Сравните полученный результат с табличными данными.
9. Используя экспериментальное значение R, вычислите по формуле
(14) постоянную Больцмана.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Сформулируйте основные положения молекулярно-кинетической
теории газов.
2. Выведите основное уравнение МКТ.
3. В чем заключается физический смысл давления и температуры газа с точки зрения молекулярно-кинетической теории?
4. Выведите формулу (7).
5. Какой физический смысл имеет постоянная Больцмана?
6. Как можно определить объем сосуда по изменению давления в нем за счет увеличения числа молекул газа?
7. Выведите рабочую формулу (13).
ЛИТЕРАТУРА
[1] §§ 7- 9, 59; [3] §§ 5,7-11; [5] 1.16; [6] §§ 85-86.
ЛАБОРАТОРНАЯ РАБОТА № 2-03
Дата добавления: 2019-02-12; просмотров: 1663; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
