Заключительный (городской) этап. Практический тур
Класс
Автор задания – Хлебникова Л.А.
Вариант
Практическое задание:
В четырех стаканчиках без этикеток находятся бесцветные кристаллические вещества: K2CO3, MgCl2∙6H2O, Ba(NO3)2, Al2(SO4)3∙18H2O (в каждом стаканчике одно вещество). Используя воду и набор чистых пробирок, определите содержимое каждого стаканчика.
Теоретические вопросы:
1. Предложите ход анализа, с помощью которого можно определить содержимое каждого стаканчика.
2. Напишите уравнения протекающих химических реакций.
Вариант
Практическое задание:
В четырех стаканчиках без этикеток находятся бесцветные кристаллические вещества: K2CO3, Mg(NO3)2∙6H2O, BaCl2, Al2(SO4)3∙18H2O. Используя воду и набор чистых пробирок, определите содержимое каждого стаканчика.
Теоретические вопросы:
1. Предложите ход анализа, с помощью которого можно определить содержимое каждого стаканчика.
2. Напишите уравнения протекающих химических реакций.
Класс
Авторы задания – Тойкка Ю.Н., Скрипкин М.Ю.
Практическое задание:
В четырёх стаканчиках без надписей находятся четыре вещества из следующего набора: Fe3O4, Co3O4, CuO, MgO, ZnO, Al2O3 (в каждом стаканчике одно вещество). Используя соляную кислоту, водные растворы аммиака, едкого натра и иодида калия, а также бумажные фильтры и индикаторную бумагу, определите содержимое стаканчиков. Проведите реакции, подтверждающие результаты определения.
|
|
|
Оборудование: набор пробирок, штатив для пробирок, стеклянная палочка, нагревательная плитка.
Теоретические вопросы:
1. Предложите наиболее рациональную схему определения содержимого каждого стаканчика. Опишите признаки проводимых реакций, включая цвета растворов и осадков.
2. Напишите уравнения реакций, подтверждающие результаты определения.
Класс
Авторы задания – Тойкка Ю.Н., Скрипкин М.Ю.
Практическое задание:
В выданном Вам стаканчике содержится смесь пяти твердых солей из следующего списка: хлорид цинка, нитрат кобальта, нитрат алюминия, основный карбонат магния, основный карбонат никеля, сульфид меди. Выделите каждый металл в виде индивидуального соединения и идентифицируйте соответствующие катионы с помощью качественных реакций. Продемонстрируйте дежурному преподавателю, что Вами получены целевые вещества.
Реактивы: соляная кислота, уксусная кислота, диметилглиоксим, водные растворы гидроксида натрия, аммиака, серной кислоты, карбоната натрия.
Оборудование: набор пробирок, стеклянная палочка, спиртовка (или плитка), штатив с кольцом, воронки, фильтровальная бумага, индикаторная бумага.
Теоретические вопросы:
1. Опишите ход разделения веществ, находящихся в стаканчике.
|
|
|
2. Предложите реакции для идентификации катионов выделенных веществ.
3. Приведите уравнения соответствующих реакций.
Класс
Автор задания – Скрипкин М.Ю.
Практическое задание:
В колбах без надписей находятся водные растворы следующих веществ: глюкоза, сорбит (гексан-1,2,3,4,5,6-гексол), тартрат калия (калиевая соль 2,3-дигидроксибутандиовой кислоты), оксалат калия.
1. Проведите качественный анализ содержимого колб.
2. После проверки результатов качественного анализа, определите содержание глюкозы в соответствующей колбе.
Реактивы: раствор медного купороса, раствор гидроксида натрия ~ 0,1 М, раствор серной (или соляной) кислоты ~ 0,1 М, раствор иода (в иодиде калия) 0,1 М, раствор тиосульфата натрия 0,1 М, крахмал.
Оборудование: набор пробирок, бюретка, пипетки Мора, колбы для титрования с пробками, груши резиновые, мерный цилиндр, спиртовка (или нагревательная плитка).
Теоретические вопросы:
1. Используя приведенные выше реактивы и необходимое оборудование, предложите ход качественного анализа, с помощью которого можно определить содержимое каждой колбы.
2. Предложите ход количественного анализа, с помощью которого можно определить концентрацию глюкозы.
|
|
|
3. Напишите уравнения всех проводимых реакций.
4. Выведите формулу для расчета массы (г) глюкозы в колбе.
Решения задач
Отборочный (районный) этап. Теоретический тур
Класс
I вариант
№ 1
Количество вещества молекулярного фтора: ν(F2) = 16,8 / 22,4 = 0,75 моль.
Количество вещества атомарного фтора: ν(F) = 0,75∙2 = 1,5 моль.
Число атомов фтора: N(F) = 6,02∙1023∙1,5 = 9,03∙1023 атомов.
Атом фтора содержит 9 электронов, значит общее число электронов в 16,8 л фтора:
N(e) = 9∙9,03∙1023 = 8,127∙1024 электронов.
Так как число протонов в атоме фтора равно числу электронов, то, очевидно, что протонов в 16,8 л фтора столько же, сколько и электронов (N(p) = 8,127∙1024).
Рекомендации к оцениванию:
1) Количество вещества молекулярного фтора 1 балл
2) Количество вещества атомарного фтора 1 балл
3) Число атомов фтора 1 балл
4) Число электронов 1 балл
|
|
|
5) Число протонов 1 балл
ИТОГО 5 баллов
№ 2
Рассчитаем, какая масса йода содержится в 1 кг настойки: m(I2) = 1000∙0,05 = 50,0 г.
Молярная масса I2 равна: M(I2) = 127∙2 = 254 г/моль.
Количество вещества молекулярного йода: ν(I2) = 50,0/254 = 0,197 моль.
Так как в молекуле йода два атома иода, а в иодиде калия – один, то для получения 0,197 моль йода необходимо взять в два раза большее количество вещества иодида калия, т.е. 0,394 моль.
Молярная масса KI равна: M(KI) = 127 + 39 = 166 г/моль.
Тогда необходимая для получения настойки масса иодида калия: m(KI) = 0,394∙166 = 65,4 г.
Рекомендации к оцениванию:
1) Масса I2 1 балл
2) Количество вещества I2 1,5 балла
3) Количество вещества KI 1 балл
4) Масса KI 1,5 балла
Замечание: если ход решения правильный, но из-за округления получена другая масса иодида калия (от 65,3 до 66,4 г), то за задачу выставляется полный балл.
ИТОГО 5 баллов
№ 3
А) Уравнение реакции: С3Н8 + 5О2 = 3СО2 + 4Н2О.
Б) Рассчитаем количество вещества пропана и его объём.
Молярная масса пропана: M(С3Н8) = 12∙3 + 8∙1 = 44 г/моль.
Количество вещества пропана: ν(С3Н8) = 100000/44 = 2273 моль.
Объём пропана: V(С3Н8) = 2273∙22,4 = 50915 л.
Тогда имеющегося пропана хватит на 50915/224 ≈ 227 дней.
В) Пропан является более легколетучим (три атома углерода, M = 44 г/моль, температура кипения –42 °С), чем бутан (четыре атома углерода, M = 58 г/моль, температура кипения –1 °С), и легче испаряется, что необходимо для использования в котле. В летний период применение смесей с высоким содержанием пропана противопоказано, поскольку в этом случае высокая температура вызывает чрезмерное повышение давления в газовом Рекомендации к оцениванию:
1) Уравнение реакции 1 балл
2) Количество вещества пропана 1,5 балла
3) Объём пропана 1 балл
4) Количество дней 0,5 балла
5) Ответ на последний вопрос 1 балл
ИТОГО 5 баллов
№ 4
А) Пусть масса амальгамы 10 г. Тогда по условию m(Hg) = m(Cu) = 5 г, соответствующие количества:
ν(Hg) = 5/201 = 0,025 моль ν(Cu) = 5/64 = 0,078 моль
Соотношение числа молей металлов в амальгаме:
ν(Hg) : ν(Cu) = 0,025 : 0,078 = 1 : 3.1
Б) При взаимодействии ртути с серой образуется сульфид ртути (II):
Hg + S = HgS
В) При взаимодействии ртути с раствором хлорида железа (III) образуются хлориды ртути (II) и железа (II):
Hg + 2FeCl3 = HgCl2 + 2FeCl2
Основную часть ртути можно собрать с помощью образования амальгамы, но не всю. Оставшуюся часть лучше обработать раствором хлорида железа (III). Реакция с серой (твердое вещество) идет существенно медленнее.
Рекомендации к оцениванию:
1) Соотношение числа молей металлов 1,5 балла
2) Уравнение реакции образования сульфида ртути 1 балл
3) Уравнение реакции взаимодействия ртути с хлоридом железа (III) 1,5 балла
4) Оценка эффективности способов 1 балл
ИТОГО 5 баллов
№ 5
А) Уравнение реакции: Zn + H2SO4 = ZnSO4 + H2.
Б) Количество вещества цинка: ν(Zn) = 20/65 = 0,31 моль.
Количество вещества кислоты: ν(H2SO4) = 200∙0,2/98 = 0,41 моль.
Цинк находится в недостатке, соответственно, он прореагирует полностью, а 0,1 моль серной кислоты останется. По уравнению реакции количество вещества водорода равно количеству вещества цинка, т.е. получилось 0,31 моль водорода. Его объём 0,31∙22,4 = 6,9 л.
В) Водород легче воздуха, поэтому его собирают в положении «дном вверх».
Г) Так как объём водорода больше объёма сосуда, то водород вытеснит из него весь воздух, то есть займёт весь сосуд 5,0 л.
Рекомендации к оцениванию:
1) Уравнение реакции 1 балл
2) Расчет объёма газа 2 балла
3) Положение сосуда (с объяснением) 1 балл
4) Ответ на последний вопрос 1 балл
ИТОГО 5 баллов
II вариант
№ 1
Количество вещества молекулярного брома: ν(Br2) = 40/160 = 0,25 моль.
Количество вещества атомарного брома: ν(Br) = 0,25∙2 = 0,5 моль.
Число атомов брома: N(Br) = 6,02∙1023∙0,5 = 3,01∙1023 атомов.
Атом брома содержит 35 электронов, значит общее число электронов в 40,0 г брома:
N(e) = 35∙3,01∙1023 = 1,05∙1025 электронов.
Так как число протонов в атоме брома равно числу электронов, то, очевидно, что протонов в 40,0 г брома столько же, сколько и электронов (N(p) = 1,05∙1025).
Рекомендации к оцениванию:
1) Количество вещества молекулярного брома 1 балл
2) Количество вещества атомарного брома 1 балл
3) Число атомов брома 1 балл
4) Число электронов 1 балл
5) Число протонов 1 балл
ИТОГО 5 баллов
№ 2
Рассчитаем, какая масса йода содержится в 1 кг настойки: m(I2) = 1000∙0,04 = 40,0 г.
Молярная масса I2 равна: M(I2) = 127∙2 = 254 г/моль.
Количество вещества молекулярного йода: ν(I2) = 40,0/254 = 0,157 моль.
Так как в молекуле йода два атома иода, а в иодиде натрия – один, то для получения 0,157 моль йода необходимо взять в два раза большее количество вещества иодида натрия, т.е. 0,314 моль.
Молярная масса NaI равна: M(NaI) = 127 + 23 = 150 г/моль.
Тогда необходимая для получения настойки масса иодида натрия: m(NaI) = 0,314∙150 = 47,1 г
Рекомендации к оцениванию:
1) Масса I2 1 балл
2) Количество вещества I2 1,5 балла
3) Количество вещества NaI 1 балл
4) Масса NaI 1,5 балла
Замечание: если ход решения правильный, но из-за округления получена другая масса иодида натрия (от 47,0 до 48,0 г), то за задачу выставляется полный балл.
ИТОГО 5 баллов
№ 3
А) Уравнение реакции: 2С4Н10 + 13О2 = 8СО2 + 10Н2О.
Б) Рассчитаем количество вещества бутана и его объём.
Молярная масса бутана: M(С4Н10) = 12∙4 + 10∙1 = 58 г/моль.
Количество вещества бутана: ν(С4Н10) = 100000/58 = 1724 моль.
Объём бутана: V(С4Н10) = 1724∙22,4 = 38618 л.
Тогда имеющегося бутана хватит на 38618/224 ≈ 172 дня.
В) Пропан является более легколетучим (три атома углерода, M = 44 г/моль, температура кипения –42 °С), чем бутан (четыре атома углерода, M = 58 г/моль, температура кипения –1 °С), и легче испаряется, что необходимо для использования в котле. В зимний период бутан будет плохо испаряться, поэтому используют смеси с более высоким содержанием легколетучего пропана.
Рекомендации к оцениванию:
1) Уравнение реакции 1 балл
2) Количество вещества бутана 1,5 балла
3) Объём бутана 1 балл
4) Количество дней 0,5 балла
5) Ответ на последний вопрос 1 балл
ИТОГО 5 баллов
№ 4
А) Пусть масса амальгамы 10 г. Тогда по условию m(Hg) = m(Al) = 5 г, соответствующие количества:
ν(Hg) = 5/201 = 0,025 моль ν(Al) = 5/27 = 0,185 моль
Соотношение числа молей металлов в амальгаме:
ν(Hg) : ν(Al) = 0,025 : 0,185 = 1 : 7.4
Б) При взаимодействии ртути с серой образуется сульфид ртути (II):
Hg + S = HgS
В) При взаимодействии ртути с раствором хлорида железа (III) образуются хлориды ртути (II) и железа (II):
Hg + 2FeCl3 = HgCl2 + 2FeCl2
Основную часть ртути можно собрать с помощью образования амальгамы, но не всю. Оставшуюся часть лучше обработать раствором хлорида железа (III). Реакция с серой (твердое вещество) идет существенно медленнее.
Рекомендации к оцениванию:
1) Соотношение числа молей металлов 1,5 балла
2) Уравнение реакции образования сульфида ртути 1 балл
3) Уравнение реакции взаимодействия ртути с хлоридом железа (III) 1,5 балла
4) Оценка эффективности способов 1 балл
ИТОГО 5 баллов
№ 5
А) Уравнение реакции: Mg + 2HCl = MgCl2 + H2.
Б) Количество вещества магния: ν(Mg) = 5/24 = 0,21 моль.
Количество вещества кислоты: ν(HCl) = 200∙0,1/36,5 = 0,48 моль.
Магний находится в недостатке, соответственно, он прореагирует полностью, а 0,06 моль хлороводородной кислоты останется. По уравнению реакции количество вещества водорода равно количеству вещества магния, т.е. получилось 0,21 моль водорода. Его объём 0,21∙22,4 = 4,7 л.
В) Водород легче воздуха, поэтому его собирают в положении «дном вверх».
Г) Так как объём водорода больше объёма сосуда, то водород вытеснит из него весь воздух, то есть займёт весь сосуд 3,0 л.
Рекомендации к оцениванию:
1) Уравнение реакции 1 балл
2) Расчет объёма газа 2 балла
3) Положение сосуда (с объяснением) 1 балл
4) Ответ на последний вопрос 1 балл
ИТОГО 5 баллов
Класс
I вариант
№ 1
1) Н2 + O2 – может существовать при комнатной температуре в отсутствие источников зажигания (искра, открытое пламя).
При горении или при высокой температуре (около 500 °С) происходит реакция:
2H2 + O2 = 2H2O, которая при температуре выше 600 °С протекает со взрывом.
2) H2 + Cl2 – может существовать в темноте при комнатной температуре.
На рассеянном свету и при слабом нагревании происходит реакция: H2 + Cl2 = 2HCl, которая при высокой температуре и ярком освещении протекает со взрывом.
3) N2 + H2 – может существовать в широком диапазоне температур.
При высокой температуре (от 400 °С) и давлении (от 100 атм) в присутствии катализатора (пористое железо) реагируют с образованием аммиака:
N2 + 3H2 = 2NH3
4) СО2 + HCl – может существовать при любых условиях.
5) NH3 + HBr – реагируют друг с другом с образованием соли – бромида аммония:
NH3 + HBr = NH4Br
Однако смесь может существовать при температурах выше 350–400 °С, так как при таких температурах соли аммония разлагаются на аммиак и кислоту.
Рекомендации к оцениванию:
1) За правильный ответ по каждому пункту по 1 баллу 1∙5 = 5 баллов
Замечание: если в пункте есть уравнение реакции, то 0,5 балла за уравнение с условиями протекания и 0,5 балла за условия существования.
ИТОГО 5 баллов
№ 2
Уравнения реакций:
MgCO3 + H2SO4 = MgSO4 + H2O + СО2 (1)
NaHCO3 + 1/2H2SO4 = 1/2Na2SO4 + H2O + СО2 (2)
Масса раствора серной кислоты: 129∙1,14 = 147,0 г.
Масса серной кислоты в растворе: 147,0∙0,2 = 29,4 г.
Количество вещества серной кислоты в растворе: 29,4/98 = 0,3 моль.
Так как молярные массы карбоната магния и гидрокарбоната натрия одинаковы (84 г/моль), то равным массам солей соответствуют равные количества вещества. Обозначим количество вещества каждой из солей через а. На основе приведенных уравнений реакций (1 и 2) получаем уравнение:
а + 0,5а = 0,3
Откуда а = 0,2. Количество вещества углекислого газа равно количеству вещества солей, т.е. равно 0,4 моль. Отсюда объем выделившегося газа: 0,4∙22,4 = 8,96 л.
При добавлении избытка раствора нитрата бария протекают реакции:
MgSO4 + Ba(NO3)2 = BaSO4 + Mg(NO3)2 (3)
Na2SO4 + Ba(NO3)2 = BaSO4 + 2NaNO3 (4)
Из уравнений реакций 3 и 4 видно, что образуется 0,3 моль сульфата бария (количество вещества сульфата бария равно количеству вещества серной кислоты).
Масса сульфата бария равна: 0,3∙233 = 69,9 г.
Рекомендации к оцениванию:
1) Уравнения реакций по 0,5 балла 0,5∙4 = 2 балла
2) Объем газа 2 балла
3) Масса осадка 1 балл
ИТОГО 5 баллов
№ 3
Возможный вариант решения:
А) 4FeSO4 = 2Fe2O3 + 4SO2↑ + O2↑ (прокаливание)
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Б) FeSO4 + K2S = FeS↓ + K2SO4
FeS + 4HNO3(разб.) = Fe(NO3)3 + NO↑ + S↓ + 2H2O
В) FeSO4 + Zn = ZnSO4 + Fe
Fe + 4HNO3(разб.) = Fe(NO3)3 + NO↑ + 2H2O
Рекомендации к оцениванию:
1) За вариант А 1,5 балла
2) За вариант Б 1,5 балла
3) За вариант В 2 балла
ИТОГО 5 баллов
№ 4
Уравнение реакции диссоциации: HF = H+ + F–
В 100 мл исходного раствора содержится 0,001 моль HF.
Количество вещества фтороводородной кислоты, распавшейся на ионы:
0,001∙0,12 = 0,00012 моль.
Количество вещества Н+ равно: 0,00012 моль или 1,2∙10-4 моль.
Число ионов Н+равно: 1,2∙10-4∙6,02∙1023 = 7,224∙1019.
Рекомендации к оцениванию:
1) Уравнение реакции диссоциации 1 балл
2) Количество вещества 2 балла
3) Число ионов 2 балла
Замечание: если уравнение реакции не приведено, но все дальнейшие вычисления выполнены и получено правильное значение числа ионов, то за задачу ставится полный балл.
ИТОГО 5 баллов
№ 5
Уравнение реакции нейтрализации в общем виде:
HAn + NaOH = NaAn + H2O
Количество вещества NaOH в растворе: 0,5/1000∙80 = 0,04 моль.
Масса кислоты в растворе: 30∙0,134 = 4,02 г.
По уравнению реакции количество вещества кислоты равно количеству вещества гидроксида натрия. Тогда молярная масса кислоты равняется: М = 4,02/0,04 = 100,5 г/моль.
Молярная масса кислотного остатка (Аn): 100,5 – 1 = 99,5 г/моль.
Рассмотрим варианты строения кислотного остатка:
Аn = Э, Аr(Э) = 99,5. Элемента с такой атомной массой в VII группе нет.
Аn = ЭО, Аr(Э) = 99,5 – 16 = 83,5 « « «
Аn = ЭО2, Аr(Э) = 99,5 – 32 = 67,5 « « «
Аn = ЭО3, Аr(Э) = 99,5 – 48 = 51,5 « « «
Аn = ЭО4, Аr(Э) = 99,5 – 64 = 35,5. Это атомная масса хлора.
Формула кислоты: HCl О4 (хлорная кислота).
Рекомендации к оцениванию:
1) Молярная масса кислотного остатка с обоснованием 3 балла
2) Формула кислоты с анализом 2 балла
Замечание: формула кислоты без анализа или проверки 1 балл.
ИТОГО 5 баллов
II вариант
№ 1
1) N2 + O2 – может существовать в широком диапазоне температур (такая смесь – основной компонент воздуха). При высоких температурах (1200–1300 °C) или в электрическом разряде реагируют с образованием оксида азота (II):
N2 + O2 = 2NO
2) O2 + Cl2 – может существовать при любых условиях.
3) H2 + F2 – реагируют друг с другом со взрывом даже при низких температурах и в отсутствие освещения с образованием фтороводорода. Такая смесь существовать не может.
H2 + F2 = 2HF
4) SO2 + O2 – может существовать в широком диапазоне температур. При высокой температуре (от 400 °С) в присутствии катализатора (V2O5, Pt или Fe2O3) реагируют с образованием оксида серы (VI):
2SO2 + O2 = 2SO3
5) NH3 + HCl – реагируют друг с другом при любых условиях с образованием соли – хлорида аммония. Такая смесь существовать не может.
NH3 + HCl = NH4Cl
Однако смесь может существовать при температурах выше 350–400 °С, так как при таких температурах соли аммония разлагаются на аммиак и кислоту.
Рекомендации к оцениванию:
1) За правильный ответ по каждому пункту по 1 баллу 1∙5 = 5 баллов
Замечание: если в пункте есть уравнение реакции, то 0,5 балла за уравнение с условиями протекания и 0,5 балла за условия существования.
ИТОГО 5 баллов
№ 2
Уравнения реакций:
NaHCO3 + HCl = NaCl + H2O + СО2 (1)
MgCO3 + 2HCl = MgCl2 + H2O + СО2 (2)
Масса раствора соляной кислоты: 99,5∙1,1 = 109,5 г.
Масса соляной кислоты в растворе: 109,5∙0,2 = 21,9 г.
Количество вещества соляной кислоты в растворе: 21,9/36,5 = 0,6 моль.
Так как молярные массы карбоната магния и гидрокарбоната натрия одинаковы (84 г/моль), то равным массам солей соответствуют равные количества вещества. Обозначим количество вещества каждой из солей через а. На основе приведенных уравнений реакций (1 и 2) получаем уравнение:
а + 2а = 0,6
Откуда а = 0,2. Количество вещества углекислого газа равно количеству вещества солей, т.е. равно 0,4 моль. Отсюда объем выделившегося газа: 0,4∙22,4 = 8,96 л.
При добавлении избытка раствора нитрата серебра протекают реакции:
NaCl + AgNO3 = AgCl + NaNO3 (3)
MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2 (4)
Из уравнений реакций 3 и 4 видно, что из хлорида натрия образуется 0,2 моль осадка, а из хлорида магния – 0,4 моль осадка (количество вещества хлорида серебра равно количеству вещества соляной кислоты). Суммарное количество вещества хлорида серебра: 0,2 + 0,4 = 0,6 моль. Таким образом, масса осадка равна: 143,5∙0,6 = 86,1 г.
Рекомендации к оцениванию:
1) Уравнения реакций по 0,5 балла 0,5∙4 = 2 балла
2) Объем газа 2 балла
3) Масса осадка 1 балл
ИТОГО 5 баллов
№ 3
Возможный вариант решения:
А) 2CuSO4 = 2CuO + 2SO2↑ + O2↑ (прокаливание)
CuO + 2HNO3 = Cu(NO3)2 + H2O
Б) CuSO4 + Na2S = CuS↓ + Na2SO4
3CuS + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 3S↓ + 4H2O
В) CuSO4 + Zn = ZnSO4 + Cu
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Рекомендации к оцениванию:
1) За вариант А 1,5 балла
2) За вариант Б 1,5 балла
3) За вариант В 2 балла
ИТОГО 5 баллов
№ 4
Уравнение реакции диссоциации: HNO2 = H+ + NO2–
В 200 мл исходного раствора содержится 0,004 моль HNO2.
Количество вещества азотистой кислоты, распавшейся на ионы:
0,004∙0,10 = 0,0004 моль.
Количество вещества Н+ равно: 0,0004 моль или 4,0∙10-4 моль.
Число ионов Н+ равно: 4,0∙10-4∙6,02∙1023 = 2,408∙1020.
Рекомендации к оцениванию:
1) Уравнение реакции диссоциации 1 балл
2) Количество вещества 2 балла
3) Число ионов 2 балла
Замечание: если уравнение реакции не приведено, но все дальнейшие вычисления выполнены и получено правильное значение числа ионов, то за задачу ставится полный балл.
ИТОГО 5 баллов
№ 5
Уравнение реакции нейтрализации в общем виде:
H2An + 2КOH = К2An + 2H2O
Количество вещества КOH в растворе: 0,5/1000∙120 = 0,06 моль.
Масса кислоты в растворе: 30∙0,129 = 3,87 г.
По уравнению реакции количество вещества кислоты в два раза меньше количества вещества гидроксида калия, т.е. равно 0,06/2 = 0,03 моль.
Тогда молярная масса кислоты: 3,87/0,03 = 129 г/моль.
Молярная масса кислотного остатка (Аn): 129 – 2 = 127 г/моль.
Рассмотрим варианты строения кислотного остатка:
Аn = Э, Аr(Э) = 127. Элемента с такой атомной массой в VI группе нет.
Аn = ЭО3, Аr(Э) = 127 – 48 = 79. Это атомная масса селена.
Аn = ЭО4, Аr(Э) = 127 – 64 = 63. Элемента с такой атомной массой в VI группе нет.
Формула кислоты: H2SeO3 (селенистая кислота).
Рекомендации к оцениванию:
1) Молярная масса кислотного остатка с обоснованием 3 балла
2) Формула кислоты с анализом 2 балла
Замечание: формула кислоты без анализа или проверки 1 балл.
ИТОГО 5 баллов
Класс
I вариант
№ 1
1) Погружение железной пластинки в раствор хлорида олова (II) ведет к типичной реакции замещения – железо способно вытеснить олово (см. ряд активности металлов):
Fe + SnCl2 = FeCl2 + Sn
2) Медь не может вытеснять железо из растворов его солей (см. ряд активности металлов), но ион железа в данном случае имеет заряд +3, что позволяет ему выступать в роли окислителя меди:
Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4
3) Взаимодействие растворов нитрата ртути (II) и гидроксида калия, очевидно, процесс не окислительно-восстановительный. Судя по таблице растворимости, гидроксид ртути (II) не существует. Единственное соединение с той же степенью окисления ртути, которое может образоваться, – оксид:
Hg(NO3)2 + 2KOH = 2KNO3 + HgO + H2O
4) Взаимодействие хлорида меди (II) с иодидом калия – окислительно-восстановительный процесс: Cu2+ – окислитель, I– – восстановитель (поэтому соединение CuI2 не существует):
2CuCl2 + 4KI = 2CuI↓ + 4KCl + I2↓
5) Добавление по каплям раствора нитрата цинка к раствору гидроксида натрия указывает на избыток щелочи. Соединения цинка являются амфотерными, следовательно, в растворе будет образовываться комплексное соединение:
Zn(NO3)2 + 4NaOH = 2NaNO3 + Na2[Zn(OH)4]
Рекомендации к оцениванию:
1) За каждое уравнение реакции по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
№ 2
Уравнение реакции:
M + nX2 = MX2n
Уравнение реакции электролиза:
MX2n = M + nX2
Количество вещества галогена, полученного при электролизе (оно же – количество вещества галогена, вступившего в реакцию с металлом) составляет:
n = 9830/96500∙2 = 0,0507 моль
(z в данном случае равно 2, так как одна молекула галогена образуется из двух галогенид-ионов).
Молярная масса X2: M = 8,14/0,0509 = 159,1 г/моль, т.е. неизвестный галоген – бром.
Аналогичным образом ведем расчет молярной массы металла. Количество вещества металла, полученное при электролизе (оно же – количество вещества металла, вступившего в реакцию с галогеном) составляет n = 9830/96500z моль, а его молярная масса М = 3,0∙96500z/9830 = 29,45z, где z – валентность металла в галогениде.
| z | M, г/моль | металл |
| 1 | 29,45 | – |
| 2 | 58,9 | Co |
| 3 | 88,35 | – |
| 4 | 117,8 | – |
| 5 | 147,25 | – |
| 6 | 176,7 | – |
| 7 | 206,15 | – |
| 8 | 235,6 | – |
Неизвестный металл – кобальт.
Уравнение реакции электролиза расплава: CoBr2 = Co + Br2.
Рекомендации к оцениванию:
1) Определение галогена 2 балла
2) Определение металла 2 балла
3) Уравнение реакции электролиза 1 балл
ИТОГО 5 баллов
№ 3
Глинозем – Al2O3; каустическая сода – NaOH; нашатырь – NH4Cl; купоросное масло – H2SO4.
Уравнения реакций:
1) Al2O3 + 2NaOH = 2NaAlO2 + H2O (сплавление)
2) NaAlO2 + NH4Cl + Н2О = Al(OH)3 + NH3 + NaCl
(или 2NaAlO2 + 2NH4Cl + (n – 1)Н2О = Al2O3∙nH2O + 2NH3 + 2NaCl)
3) NH3 + H2SO4 = NH4HSO4
4) NH4HSO4 = NH3 + SO3 + H2О (прокаливание)
(или NH4HSO4 = NH3 + H2SO4)
Рекомендации к оцениванию:
1) Формулы соединений по 0,75 балла 0,75∙4 = 3 балла
2) Уравнения реакции по 0,5 балла 0,5∙4 = 2 балла
ИТОГО 5 баллов
№ 4
А) NH3 и PH3
Б) Не одинаковы. Скорость реакции зависит от концентрации, выраженной количеством вещества в единице объема (чаще всего моль/л). Количество вещества образующегося аммиака (20/17 = 1,18 моль) в два раза больше, чем фосфина (20/34 = 0,59 моль), поэтому скорость реакции образования аммиака в два раза выше.
В) Моль/(л∙с) (другие варианты размерности, в которых моль делится на единицу измерения объёма (м3, дм3 и пр.) и на единицу измерения времени (мин, час и пр.) также являются верными).
Г) Согласно правилу Вант-Гоффа, при повышении температуры на 10 градусов Цельсия скорость реакции возрастает в 2–4 раза, что математически выражается формулой:
VT2/VT1 = (γ)(T2-T1)/10
где Т2 и Т1 – температуры, при которых измеряется скорость реакции, VT2 и VT1 – скорости реакций при соответствующих температурах, γ – температурный коэффициент скорости, (T2–T1)/10 – показатель степени, в которую возводится γ, т.е. для условия задачи VT2/VT1 = (2)4. Скорость реакции увеличится в 16 раз.
Рекомендации к оцениванию:
1) Формулы веществ по 0,5 балла 0,5∙2 = 1 балл
2) Правильный ответ на вопрос Б 1 балл
3) Объяснение при ответе на вопрос Б 1 балл
4) Размерность скорости 0,5 балла
5) Влияние температуры, качественный ответ 0,5 балла
6) Количественное увеличение скорости 1 балл
ИТОГО 5 баллов
№ 5
1) Общая формула предельного углеводорода – CnH2n+2. Тогда формулы моно- и дибромпроизводных: CnH2n+1Br и CnH2nBr2 соответственно. Массовые доли галогена в них:
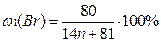
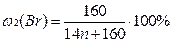
По условию в дибромпроизводном массовая доля брома в 1,218 раза больше, следовательно, можно составить уравнение:
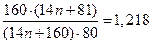
решая которое, получим, что n = 3, т.е. неизвестный углеводород – пропан C3H8.
2) У пропана 2 моно- и 4 дибромпроизводных (основной продукт монобромирования – 2-бромпропан):
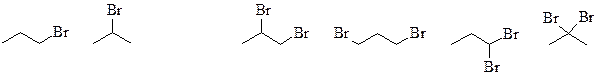
3) В пропане два типа неэквивалентных атомов водорода: 6 из них принадлежат двум первичным атомам углерода, а 2 других – вторичному. В условиях повышения температуры и активности галогена селективность снижается, и будет действовать статистический фактор. При повышенной температуре радикальное хлорирование пропана приведет к образованию преимущественно 1-хлорпропана.
Рекомендации к оцениванию:
1) Молекулярная формула углеводорода 1,5 балла
2) Число моно- и дибромпроизводных по 1 баллу 1∙2 = 2 балла
3) Основной продукт монобромирования 0,5 балла
4) Основной продукт монохлорирования (только с обоснованием) 1 балл
ИТОГО 5 баллов
№ 6
Запишем уравнение сгорание неизвестного углеводорода в общем виде:
СxHy + (x + 0,25y)O2 = xCO2 + 0,5yH2O
Учитывая, что количество вещества кислорода в 4,5 раза больше количества вещества углеводорода (900/200), получаем уравнение с двумя неизвестными:
n(O2)/n(СxHy) = (x + 0,25y)/1 = 4,5
Откуда y = (4,5 – x)∙4
Далее перебирая целочисленные значения x (число атом углерода в молекуле), найдём соответствующие значения y (число атом водорода в молекуле):
| x = 1 | y = 14 | CH14 (не имеет химического смысла) |
| x = 2 | y = 10 | C2H10 (не имеет химического смысла) |
| x = 3 | y = 6 | C3H6 |
| x = 4 | y = 2 | C4H2 |
Таким образом, неизвестный углеводород может иметь брутто-формулу C3H6 или C4H2. Составу C3H6 отвечает общая формула СnH2n, т.е. углеводород может иметь либо 1 двойную связь, либо это циклоалкан. Составу C4H2 отвечает общая формула СnH2n-8. В этом случае, несмотря на кажущееся многообразие возможных структур, единственным разумным вариантом с химической точки зрения является наличие в углеводороде 2 тройных связей. Тогда три возможные структурные формулы неизвестного углеводорода (пропен, циклопропан, бутадиин):
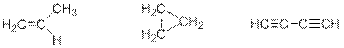
Рекомендации к оцениванию:
1) За выход на брутто-формулы C3H6 и C4H2, в том числе подбором по 1 баллу 1∙2 = 2 балла
2) Структурные формулы по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
II вариант
№ 1
1) Погружение цинковой пластинки в раствор хлорида никеля (II) ведет к типичной реакции замещения – цинк способен вытеснить никель (см. ряд активности металлов):
Zn + NiCl2 = ZnCl2 + Ni
2) Медь не может вытеснять железо из растворов его солей (см. ряд активности металлов), но ион железа в данном случае имеет заряд +3, что позволяет ему выступать в роли окислителя меди:
Cu + 2FeCl3 = CuCl2 + 2FeCl2
3) Взаимодействие растворов нитрата серебра и гидроксида натрия, очевидно, процесс не окислительно-восстановительный. Судя по таблице растворимости, гидроксид серебра не существует. Единственное соединение с той же степенью окисления серебра, которое может образоваться – оксид:
2AgNO3 + 2NaOH = 2NaNO3 + Ag2O + H2O
4) Взаимодействие хлорида меди (II) с иодидом калия – окислительно-восстановительный процесс: Cu2+ – окислитель, I– – восстановитель (поэтому соединение CuI2 не существует):
2CuCl2 + 4KI = 2CuI↓ + 4KCl + I2↓
5) Добавление по каплям раствора хлорида алюминия к раствору гидроксида калия указывает на избыток щелочи. Соединения алюминия являются амфотерными, следовательно, в растворе будет образовываться комплексное соединение:
AlCl3 + 4KOH = 3KCl + K[Al(OH)4] или
AlCl3 + 6KOH = 3KCl + K3[Al(OH)6]
Рекомендации к оцениванию:
1) За каждое уравнение реакции по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
№ 2
Уравнение реакции:
M + nX2 = MX2n
Уравнение реакции электролиза:
MX2n= M + nX2
Количество вещества галогена, полученного при электролизе (оно же – количество вещества галогена, вступившего в реакцию с металлом) составляет:
n = 3726/96500∙2 = 0,0193 моль
(z в данном случае равно 2, так как одна молекула галогена образуется из двух галогенид-ионов).
Молярная масса галогена X2: M = 4,9/0,0193 = 253,9 г/моль, т.е. неизвестный галоген – иод.
Аналогичным образом ведем расчет молярной массы металла. Количество вещества металла, полученное при электролизе (оно же – количество вещества металла, вступившего в реакцию с галогеном) составляет n = 9800/96500z (моль), а его молярная масса М = 4,0∙96500z/3726 = 103,6z, где z – валентность металла в галогениде.
При z = 2, М = 103,6∙2 = 207,2 г/моль, т.е. неизвестный металл – свинец.
Уравнение реакции электролиза расплава: PbI2 = Pb + I2
Рекомендации к оцениванию:
1) Определение галогена 2 балла
2) Определение металла 2 балла
3) Уравнение реакции электролиза 1 балл
ИТОГО 5 баллов
№ 3
Метеоритный металл – Fe; жёлто-зелёный газ – Cl2; каустическая сода – NaOH; гематит – Fe2O3.
Уравнения реакций:
1) 2Fe + 3Cl2 = 2FeCl3
2) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
(или 2FeCl3 + 6NaOH + (n – 3)Н2О = Fe2O3∙nH2O + 6NaCl)
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Рекомендации к оцениванию:
1) Формулы соединений по 0,75 балла 0,75∙4 = 3 балла
2) Уравнения реакции по 0,5 балла 0,5∙4 = 2 балла
ИТОГО 5 баллов
№ 4
А) NH3 и H2S
Б) Скорость реакции зависит от концентрации, выраженной количеством вещества в единице объема (чаще всего моль/л). Количество вещества образующегося аммиака (6,8/17 = 0,4 моль) в два раза больше, чем сероводорода (6,8/34 = 0,2 моль), поэтому скорость реакции образования аммиака в два раза выше.
В) Моль/(л∙с) (другие варианты размерности, в которых моль делится на единицу измерения объёма (м3, дм3 и пр.) и на единицу измерения времени (мин, час и пр.) также являются верными).
Г) Согласно правилу Вант-Гоффа, при повышении температуры на 10 градусов Цельсия скорость реакции возрастает в 2–4 раза, что математически выражается формулой:
VT2/VT1 = (γ)(T2-T1)/10
где Т2 и Т1 – температуры, при которых измеряется скорость реакции, VT2 и VT1 – скорости реакций при соответствующих температурах, γ – температурный коэффициент скорости, (T2–T1)/10 – показатель степени, в которую возводится γ, т.е. для условия задачи VT2/VT1 = (2)3. Скорость реакции увеличится в 8 раз.
Рекомендации к оцениванию:
1) Формулы веществ по 0,5 балла 0,5∙2 = 1 балл
2) Правильный ответ на вопрос Б 1 балл
3) Объяснение при ответе на вопрос Б 1 балл
4) Размерность скорости 0,5 балла
5) Влияние температуры, качественный ответ 0,5 балла
6) Количественное увеличение скорости 1 балл
ИТОГО 5 баллов
№ 5
1) Общая формула предельного углеводорода – CnH2n+2. Тогда формулы моно- и дибромпроизводных: CnH2n+1Br и CnH2nBr2 соответственно. Массовые доли галогена в них:
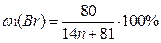
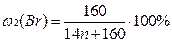
По условию в дибромпроизводном массовая доля брома в 1,269 раза больше, следовательно, можно составить уравнение:
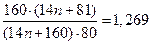
решая которое, получим, что n = 4, т.е. неизвестный углеводород – н-бутан C4H10.
2) У бутана 2 моно- и 6 дибромпроизводных (основной продукт монобромирования – 2-бромбутан):

3) В бутане два типа неэквивалентных атомов водорода: 6 из них принадлежат двум первичным атомам углерода, а 4 других – вторичным. В условиях повышения температуры и активности галогена селективность снижается, и будет действовать статистический фактор. При повышенной температуре радикальное хлорирование бутана приведет к образованию преимущественно 1-хлорбутана.
Рекомендации к оцениванию:
1) Молекулярная формула углеводорода 1,5 балла
2) Число моно- и дибромпроизводных по 1 баллу 1∙2 = 2 балла
3) Основной продукт монобромирования 0,5 балла
4) Основной продукт монохлорирования (только с обоснованием) 1 балл
ИТОГО 5 баллов
№ 6
Запишем уравнение сгорание неизвестного углеводорода в общем виде:
СxHy + (x + 0,25y)O2 = xCO2 + 0,5yH2O
Учитывая, что количество вещества кислорода в 4 раза больше количества вещества углеводорода (600/150), получаем уравнение с двумя неизвестными:
n(O2)/n(СxHy) = (x + 0,25y)/1 = 4
Откуда y = (4 – x)∙4
Далее перебирая целочисленные значения x (число атом углерода в молекуле), найдём соответствующие значения y (число атом водорода в молекуле):
| x = 1 | y = 12 | CH12 (не имеет химического смысла) |
| x = 2 | y = 8 | C2H8 (не имеет химического смысла) |
| x = 3 | y = 4 | C3H4 |
| x = 4 | y = 0 | – |
Таким образом, неизвестный углеводород имеет брутто-формулу C3H4. Такому составу отвечает общая формула СnH2n-2, т.е. углеводород может иметь либо 1 тройную связь, либо 2 двойных связи, либо 1 двойную связь и цикл.
Тогда три возможные структурные формулы неизвестного углеводорода (пропин, аллен, циклопропен):
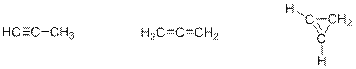
Рекомендации к оцениванию:
1) За выход на брутто-формулу C3H4, в том числе подбором 2 балла
2) Структурные формулы по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
Класс
I вариант
№ 1
Y – CuO, X – CuF2, или CuCl2, или CuBr2 (возможный вариант).
Уравнения химических процессов, отраженных на смехе:
1) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O или
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
2) 2Cu(NO3)2 = 2CuO + 4NO2 + O2 (реакция протекает при нагревании)
3) CuO + H2SO4 = CuSO4 + H2O
4) CuSO4 + Zn = Cu + ZnSO4 (реакция идет с металлом более активным, чем медь, кроме щелочных и щелочноземельных, а также образующийся сульфат должен быть растворим) или 2CuSO4 + 2H2O = 2Cu+ 2H2SO4 + O2 (электролиз водного раствора)
5) Cu + Cl2 = CuCl2
6) CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
7) 2Cu(OH)2 + CH3CHO = CH3COOH + Cu2O + 2H2O (возможно использование других альдегидов или гидразина)
8) Cu2O + H2 = 2Cu + H2O
Рекомендации к оцениванию:
1) Формулы веществ X, Y по 0,5 балла 0,5∙2 = 1 балл
2) Уравнения реакций по 0,5 балла 0,5∙8 = 4 балла
ИТОГО 5 баллов
№ 2
Для определения металла воспользуемся законом эквивалентов:
40,1/Mэкв(О) = 59,9/Mэкв(металла)
Так как Mэкв(О) = 8 г/моль, получаем:
Mэкв(металла) = 59,9*8/40,1 = 11,95 (г/моль).
Молярная масса металла равна M = z∙Mэкв, где z – валентность металла в оксиде.
Составим таблицу:
| z | M, г/моль | металл |
| 1 | 11,95 | – |
| 2 | 23,9 | – |
| 3 | 35,85 | – |
| 4 | 47,8 | Ti |
| 5 | 59,75 | – |
| 6 | 71,7 | – |
| 7 | 83,65 | – |
| 8 | 95,6 | – |
Таким образом, металл – титан.
Уравнения реакций:
TiO2 + 2C + 2Cl2 = TiCl4 + 2CO
TiCl4 + 2Mg = Ti + 2MgCl2
Для ответа на последний вопрос не обязательно знать, о каком металле идёт речь. Пусть в реакцию вступило 100 г оксида металла. Тогда масса содержащегося в нем кислорода составляет 40,1 г, а количество вещества атомов кислорода 40,1/16 = 2,51 моль. Соответственно, для образования монооксида углерода в реакцию должно вступить 2,51 моль углерода (30,1 г).
Массовая доля угля составляет 30,1/(100 + 30,1) = 0,231 (23,1%).
Рекомендации к оцениванию:
1) Нахождение металла 2 балла
2) 2 уравнения реакций по 0,5 балла 0,5∙2 = 1 балл
3) Расчет массовой доли угля 2 балла
ИТОГО 5 баллов
№ 3
Пусть тепловые эффекты реакций гидрирования цис-бут-2-ена и транс-бут-2-ена равны ΔrQ1 и ΔrQ2 соответственно:
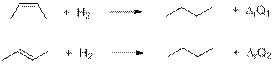
Тогда по следствию из закона Гесса:
ΔrQ1 = ΔfQ°(C4H10) – ΔfQ°(цис-бут-2-ен) – ΔfQ°(H2) = 124,7 – 5,7 – 0 = 119 кДж/моль.
ΔrQ2 = ΔfQ°(C4H10) – ΔfQ°(транс-бут-2-ен) – ΔfQ°(H2) = 124,7 – 10,1 – 0 = 114,6 кДж/моль.
 Пусть объемы и количества исходных изомеров V1, V2 и ν1, ν2 соответственно. Тогда:
Пусть объемы и количества исходных изомеров V1, V2 и ν1, ν2 соответственно. Тогда:
V1 + V2 = Vобщ., где Vобщ. – объем исходной смеси;
ν1∙Q1 + ν2∙Q2 = Qобщ., где Qобщ. – тепловой эффект гидрирования смеси.
Т.е.:
 V1 + V2 = 4
V1 + V2 = 4
119∙V1/22,4 + 114,6∙V2/22,4 = 20,7.
Решая систему уравнений, получим V1 = 1,2 л, V2 = 2,8 л. Таким образом, объемное соотношение компонентов в исходной смеси: φцис = 100∙1,2/4 = 30%, φтранс = 100∙2,8/4 = 70%.
Транс-бут-2-ен термодинамически более стабилен, так как ΔrQ2 < ΔrQ1. В случае каталитического гидрирования цис- и транс-изомеров алкенов образуется один и тот же алкан (в данном случае н-бутан). Поэтому величина ΔrQ реакции непосредственно отражает относительную стабильность двух изомеров.
Аналогичный вывод можно сделать при сравнении теплот образования алкенов (ΔfQ°(цис-бут-2-ен) < ΔfQ°(транс-бут-2-ен)).
Рекомендации к оцениванию:
1) Уравнения реакций гидрирования по 0,5 балла 0,5∙2 = 1 балл
2) Расчет тепловых эффектов реакций по 0,5 балла 0,5∙2 = 1 балл
3) Объемные доли компонентов смеси по 1 баллу 1∙2 = 2 балла
4) Вывод об относительной стабильности изомеров 1 балл
ИТОГО 5 баллов
№ 4
1) Процессы ферментации и брожения можно записать в следующем виде, принимая, что крахмал гидролизуется полностью до глюкозы:
(С6Н10О5)n + nH2O = nС6Н12О6
С6Н12О6 = 2C2H5OH + 2CO2
Стехиометрическая схема образования этанола из крахмала выглядит следующим образом:
(С6Н10О5)n → 2nC2H5OH
Учитывая содержание крахмала в злаках, его масса составляет:
m(крахмала) = 675∙0,6 = 405 кг.
Количества вещества крахмала и образующегося этанола (теоретический выход):
ν(крахмала) = 405/162n = 2,5/n кмоль.
ν(C2H5OH) = 2n∙(2,5/n) = 5 кмоль.
Количество вещества этанола (практический выход), его масса и объем:
ν(C2H5OH) = 5∙0,75 = 3,75 кмоль;
m(C2H5OH) = 3,75∙46 = 172,5 кг;
V(C2H5OH) = 172,5/0,8 = 215,6 л
2) Очистку и концентрирование обычно проводят путем дистилляции (перегонки), таким образом можно получить 96%-ный этанол. Для получения «абсолютного этанола» (99,5%-ного) из 96%-ного можно использовать такие водоотнимающие средства как оксид кальция CaO или безводный сульфат меди (II) CuSO4:
CaO + H2O = Ca(OH)2
CuSO4 + 5H2O = CuSO4∙5H2O
Этанол с содержанием воды менее 0,05% можно получить с помощью осушки 99,5%-ного этанола более сильными осушителями (натрием, магнием или гидридом кальция).
Рекомендации к оцениванию:
1) Уравнения реакций ферментации и брожения или стехиометрическая схема 1,5 балла
2) Объем спирта (практический выход) 2,5 балла
3) Метод дистилляции 0,5 балла
4) Указание на способ получения абсолютного этанола 0,5 балла
ИТОГО 5 баллов
№ 5
Оксидом меди (II) первичные и вторичные спирты окисляются до карбонильных соединений (альдегидов и кетонов соответственно). Третичные спирты при этом не окисляются. Аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот, при этом серебро выпадает в осадок (или образует «зеркало»). Уравнения протекающих реакций:
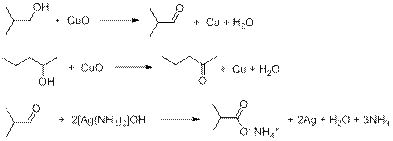
n(Ag) = 10,8/108 = 0,1 моль
По уравнению реакции: n(2-метилпропан-1-ола) = n(2-метилпропаналя) = 1/2n(Ag) = 0,05 моль.
Масса 2-метилпропан-1-ола равняется 0,05∙74 = 3,7 г
n(Cu) = 4,0/63,5 = 0,063 моль
По уравнению реакции: n(2-метилпропан-1-ола) + n(пентан-2-ола) = n(Cu) = 0,063 моль.
n(пентан-2-ола) = 0,063 – n(2-метилпропан-1-ола) = 0,063 – 0,05 = 0,013 моль.
Масса пентан-2-ола равняется 0,013∙88 = 1,14 г
Массовая доля 2-метилпропан-1-ола в смеси ω(%) = 100∙3,7/6,0 = 61,7%
Массовая доля пентан-2-ола в смеси ω(%) = 100∙1,14/6,0 = 19,0%
Массовая доля 2-метилпропан-2-ола в смеси ω(%) = 100 – 61,7 – 19 = 19,3%
Рекомендации к оцениванию:
1) Уравнение реакции окисления первичного спирта до альдегида 0,5 балла
2) Уравнение реакции окисления вторичного спирта до кетона 0,5 балла
3) Уравнение реакции окисления альдегида до кислоты (или аммонийной соли) 1 балл
4) Массовые доли трёх спиртов по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
№ 6
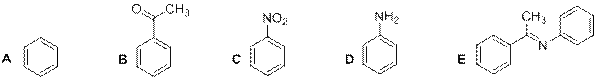
любой изомер по C=N связи
Рекомендации к оцениванию:
1) За каждое правильно указанное вещество по 1 баллу 1∙5 = 5 баллов
Замечание: если в качестве Е предложена структура енамина 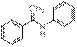 , то также ставится полный балл.
, то также ставится полный балл.
ИТОГО 5 баллов
II вариант
№ 1
X – CuF2, или CuCl2, или CuBr2 (возможный вариант), Y – CuO.
Уравнения химических процессов, отраженных на смехе:
1) Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
2) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
3) 2Cu(OH)2 + CH3CHO = CH3COOH + Cu2O + 2H2O (возможно использование других альдегидов или гидразина)
4) Cu2O + H2 = 2Cu + H2O
5) Cu + Cl2 = CuCl2
6) CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl (также для бромида) или
CuF2 + Ca(NO3)2 = Cu(NO3)2 + CaF2
7)2Cu(NO3)2 = 2CuO + 4NO2 + O2 (реакция протекает при нагревании)
8) CuO + H2 = Cu + H2O
Рекомендации к оцениванию:
1) Формулы веществ X, Y по 0,5 балла 0,5∙2 = 1 балл
2) Уравнения реакций по 0,5 балла 0,5∙8 = 4 балла
ИТОГО 5 баллов
№ 2
Для определения металла воспользуемся законом эквивалентов:
26,0/Mэкв(О) = 74,0/Mэкв(металла)
Так как Mэкв(О) = 8 г/моль, получаем:
Mэкв(металла) = 74,0*8/26,0 = 22,77 г/моль.
Молярная масса металла равна M = z∙Mэкв, где z – валентность металла в оксиде.
Составим таблицу:
| z | M, г/моль | металл |
| 1 | 22,77 | – |
| 2 | 45,5 | – |
| 3 | 68,3 | – |
| 4 | 91,1 | Zr |
| 5 | 113,85 | – |
| 6 | 136,6 | – |
| 7 | 159,4 | – |
| 8 | 182,2 | – |
Таким образом, металл – цирконий.
Уравнения реакций:
ZrO2 + 2C + 2Cl2 = ZrCl4+ 2CO
ZrCl4 + 2Mg = Zr + 2MgCl2
Для ответа на последний вопрос не обязательно знать, о каком металле идёт речь. Пусть в реакцию вступило 100 г оксида металла. Тогда масса содержащегося в нем кислорода составляет 26,0 г, а количество вещества атомов кислорода 26,0/16 = 1,625 моль. Соответственно, для образования монооксида углерода в реакцию должно вступить 1,625 моль углерода 19,5 г.
Массовая доля угля составляет 19,5/(100 + 19,5) = 0,163 (16,3%)
Рекомендации к оцениванию:
1) Нахождение металла 2 балла
2) 2 уравнения реакций по 0,5 балла 0,5∙2 = 1 балл
3) Расчет массовой доли угля 2 балла
ИТОГО 5 баллов
№ 3
Пусть тепловые эффекты реакций гидрирования цис-бут-2-ена и транс-бут-2-ена равны ΔrQ1 и ΔrQ2 соответственно:
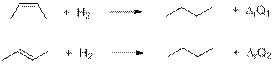
Тогда следствию из закона Гесса:
ΔrQ1 = ΔfQ°(C4H10) – ΔfQ°(цис-бут-2-ен) – ΔfQ°(H2) = 124,7 – 5,7 – 0 = 119 кДж/моль.
ΔrQ2 = ΔfQ°(C4H10) – ΔfQ°(транс-бут-2-ен) – ΔfQ°(H2) = 124,7 – 10,1 – 0 = 114,6 кДж/моль.
 Пусть объемы и количества исходных изомеров V1, V2 и ν1, ν2 соответственно. Тогда:
Пусть объемы и количества исходных изомеров V1, V2 и ν1, ν2 соответственно. Тогда:
V1 + V2 = Vобщ., где Vобщ. – объем исходной смеси;
ν1∙Q1 + ν2∙Q2 = Qобщ., где Qобщ. – тепловой эффект гидрирования смеси.
Т.е.:
 V1 + V2 = 6
V1 + V2 = 6
119∙V1/22,4 + 114,6∙V2/22,4 = 31,4.
Решая систему уравнений, получим V1 = 3,6 л, V2 = 2,4 л. Таким образом, объемное соотношение компонентов в исходной смеси: φцис = 100∙3,6/6 = 60%, φтранс = 100∙2,4/6 = 40%.
Цис-бут-2-ен термодинамически менее стабилен, так как ΔrQ1 > ΔrQ2. В случае каталитического гидрирования цис- и транс-изомеров алкенов образуется один и тот же алкан (в данном случае н-бутан). Поэтому величина ΔrQ реакции непосредственно отражает относительную стабильность двух изомеров. Аналогичный вывод можно сделать при сравнении теплот образования алкенов (ΔfQ°(транс-бут-2-ен) > ΔfQ°(цис-бут-2-ен)).
Рекомендации к оцениванию:
1) Уравнения реакций гидрирования по 0,5 балла 0,5∙2 = 1 балл
2) Расчет тепловых эффектов реакций по 0,5 балла 0,5∙2 = 1 балл
3) Объемные доли компонентов смеси по 1 баллу 1∙2 = 2 балла
4) Вывод об относительной стабильности изомеров 1 балл
ИТОГО 5 баллов
№ 4
1) Процессы ферментации и брожения можно записать в следующем виде, принимая, что крахмал гидролизуется полностью до глюкозы:
(С6Н10О5)n + nH2O = nС6Н12О6
С6Н12О6 = 2C2H5OH + 2CO2
Стехиометрическая схема образования этанола из крахмала выглядит следующим образом:
(С6Н10О5)n → 2nC2H5OH
Учитывая содержание крахмала в клубнях картофеля, его масса составляет:
m(крахмала) = 729∙0,2 = 145,8 кг
Количества вещества крахмала и образующегося этанола (теоретический выход):
n(крахмала) = 145,8/162n = 0,9/n кмоль; n(этанола) = 2n∙(0,9/n) = 1,8 кмоль
Количество вещества этанола (практический выход), его масса и объем:
n(C2H5OH) = 1,8∙0,8 = 1,44 кмоль; m(C2H5OH) = 1,44∙46 = 66,24 кг;
V(C2H5OH) = 66,24/0,8 = 82,8 л.
2) Очистку и концентрирование обычно проводят путем дистилляции (перегонки), таким образом можно получить 96%-ный этанол. Для получения «абсолютного этанола» (99,5%-ного) можно использовать такие водоотнимающие средства как оксид кальция CaO или безводный сульфат меди (II) CuSO4:
CaO + H2O = Ca(OH)2
CuSO4 + 5H2O = CuSO4∙5H2O
Этанол с содержанием воды менее 0,05% можно получить с помощью осушки 99,5%-ного этанола более сильными осушителями (натрием, магнием или гидридом кальция).
Рекомендации к оцениванию:
1) Уравнения реакций ферментации и брожения или стехиометрическая схема 1,5 балла
2) Объем спирта (практический выход) 2,5 балла
3) Метод дистилляции 0,5 балла
4) Указание на способ получения абсолютного этанола 0,5 балла
ИТОГО 5 баллов
№ 5
Оксидом меди (II) первичные и вторичные спирты окисляются до карбонильных соединений (альдегидов и кетонов соответственно). Третичные спирты при этом не окисляются. Аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот, при этом серебро выпадает в осадок (или образует «зеркало»). Уравнения протекающих реакций:
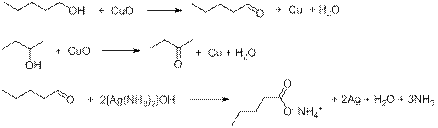
n(Ag) = 5,4/108 = 0,05 моль
По уравнению реакции: n(пентан-1-ола) = n(пентаналя) = 1/2 n(Ag) = 0,025 моль.
Масса пентан-1-ола равняется 0,025∙88 = 2,2 г
n(Cu) = 3,0/63,5 = 0,047 моль
По уравнению реакции: n(пентан-1-ола) + n(бутан-2-ола) = n(Cu) = 0,047 моль.
n(бутан-2-ола) = 0,047 – n(пентан-1-ола) = 0,047 – 0,025 = 0,022 моль.
Масса бутан-2-ола равняется 0,022*74 = 1,63 г
Массовая доля пентан-1-ола в смеси ω(%) = 100∙2,2/5,0 = 44,0%
Массовая доля бутан-2-ола в смеси ω(%) = 100∙1,63/5,0 = 32,6%
Массовая доля 1,1-диметилпропан-1-ола в смеси ω(%) = 100 – 44,0 – 32,6 = 23,4%
Рекомендации к оцениванию:
1) Уравнение реакции окисления первичного спирта до альдегида 0,5 балла
2) Уравнение реакции окисления вторичного спирта до кетона 0,5 балла
3) Уравнение реакции окисления альдегида до кислоты (или аммонийной соли) 1 балл
4) Массовые доли трёх спиртов по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
№ 6
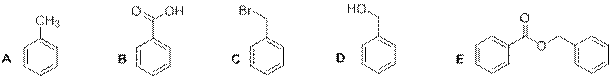
Рекомендации к оцениванию:
1) За каждое правильно указанное вещество по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
Дата добавления: 2019-01-14; просмотров: 221; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
