Отборочный (районный) этап. Практический тур
Класс
I вариант
A – магний, В – алюминий, С – серебро.
| Пункт | Уравнения реакций: |
| 1 | 1) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 |
| 2 | 2) Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O 3) Al(OH)3 + 3HCl = AlCl3 + 3H2O |
| 3 | 4) Mg + 2HCl = MgCl2 + H2 5) 2Al + 6HCl = 2AlCl3 + 3H2 |
| 4 | 6) MgCl2 + 2NH3 + 2H2O = Mg(OH)2 + 2NH4Cl 7) AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl |
| 5 | 8) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O или 4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O или 5Mg + 12HNO3 = 5Mg(NO3)2 + N2 + 6H2O 9) 8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O или 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O или 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O 10) 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O |
| 6 | 11) AgNO3 + HCl = AgCl + HNO3 12) AgCl + 2NH3 = [Ag(NH3)2]Cl |
II вариант
A – железо, В – свинец, С – цинк.
| Пункт | Уравнения реакций: |
| 1 | 1) Fe + 2HCl = FeCl2 + H2 2) Zn + 2HCl = ZnCl2 + H2 |
| 2 | 3) FeCl2 + 2NH3 + 2H2O = Fe(OH)2 + 2NH4Cl 4) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 5) ZnCl2 + 2NH3 + 2H2O = Zn(OH)2 + 2NH4Cl 6) Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 |
| 3 | 7) Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O 8) 3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O 9) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O или 4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O или 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O |
| 4 | 10) Pb(NO3)2 + 2KI = PbI2 + 2KNO3 11) PbI2 + 2KI = K2[PbI4] |
| 5 | 12) Fe(NO3)3 + 6KSCN = 3K3[Fe(SCN)6] + 3KNO3 или Fe(NO3)3 + 3KSCN = Fe(SCN)3 + 3KNO3 |
Рекомендации к оцениванию:
1) Правильное соотнесение всех трёх металлов 2 балла, одного металла – 1 балл = 2 балла
2) 12 уравнений реакций по 0,5 баллов 0,5∙12 = 6 баллов
Примечание: если в реакции правильные исходные вещества и продукты, но не расставлены коэффициенты, то за реакцию ставится 0,25 балла.
ИТОГО 8 баллов
|
|
|
Класс
I вариант
А – (NH4)2SO4, В – Na2SO4, С – KBr.
| Пункт | Уравнения реакций: |
| 1 | (NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl Na2SO4 + BaCl2 = BaSO4 + 2NaCl Кислота при осаждении нужна для предотвращения осаждения бариевых солей других анионов. |
| 2 | (NH4)2SO4 + 2KOH = 2NH3 + 2H2O + K2SO4 |
| 4 | KBr + AgNO3 = AgBr + KNO3 AgBr + 2NH3 = [Ag(NH3)2]Br |
| 5 | 10KBr + 2KBrO3 + 12HCl = 6Br2 + 6H2O + 12KCl |
Рекомендации к оцениванию:
1) Правильно определенное вещество A, B, C по 1 баллу 1∙3 = 3 балла
2) Уравнения реакций в п.1 – 4 по 0,5 балла 0,5∙5 = 2,5 балла
3) Уравнение реакции п.5 1 балл = 1 балл
4) Обоснование использования кислоты,
цвета эмиссионных линий натрия и калия по 0,5 балла 0,5∙3 = 1,5 балла
Примечание: если в реакции правильные исходные вещества и продукты, но не расставлены коэффициенты, то баллы за соответствующую реакцию делятся пополам;
ИТОГО 8 баллов
|
|
|
II вариант
А – KNO3, В – NaNO2, С – KI.
| Пункт | Уравнения реакций: |
| 1 | 2NaNO2 + H2SO4 = NO + NO2 + H2O + Na2SO4 |
| 3 | 3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4] NaNO2 + 2Al + 2KOH + 5H2O = NH3 + 2K[Al(OH)4] + NaOH или NaNO2 + 2Al + KOH + 5H2O = NH3 + K[Al(OH)4] + Na[Al(OH)4] |
| 4 | 2KI + 2FeCl3 = I2 + 2FeCl2 + 2KCl или 6KI + 2FeCl3 = I2 + 2FeI2 + 6KCl |
| 5 | 2NaNO2 + 2KI + 4HCl = I2 + 2NO + 2H2O + 2KCl + 2NaCl |
Рекомендации к оцениванию:
1) Правильно определенное вещество A, B, C по 1 баллу 1∙3 = 3 балла
2) Уравнения реакций в п.3, 4 по 0,5 балла 0,5∙3 = 1,5 балла
3) Уравнение реакции п.1, 5 по 1 баллу 1∙2 = 2 балла
4) Обоснование подкисления,
цвета эмиссионных линий натрия и калия по 0,5 балла 0,5∙3 = 1,5 балла
Примечание: если в реакции правильные исходные вещества и продукты, но не расставлены коэффициенты, то баллы за соответствующую реакцию делятся пополам;
ИТОГО 8 баллов
Класс
|
|
|
I вариант
Пробирка 1 – ацетальдегид (легко окисляется перманганатом калия; даёт положительную иодоформную пробу)
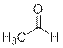
Пробирка 2 – пропан-2-ол (окисляется перманганатом калия; реагирует с хлорангидридом с образованием сложного эфира, который легче воды; даёт положительную иодоформную пробу)
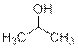
Пробирка 3 – ацетон (даёт положительную иодоформную пробу)

Пробирка 4 – пропионовая кислота (не реагирует ни с одним из реагентов; смешивается с водой)
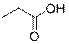
Пробирка 5 – диэтиловый эфир (не реагирует ни с одним из реагентов; легче воды)
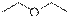
Уравнения реакций:
Альдегиды легко окисляются перманганатом калия, спирты в более жёстких условиях:
1) 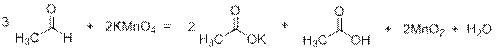
2) 
Спирты реагируют с хлорангидридами кислот с образованием сложных эфиров:
3) 
В остальных пробирках, кроме 3, при добавлении воды происходит гидролиз хлорангидрида:
4) 
Иодоформная реакция (образование светло-жёлтого осадка иодоформа CHI3) является качественной реакцией для соединений, в которых метильная группа связана с карбонильной группой, а также спиртов, которые при окислении дают вышеуказанные карбонильные соединения:
5) 
6) 
или постадийно
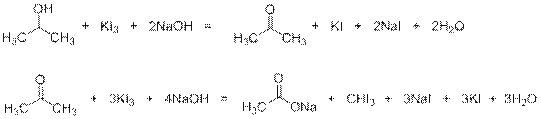
7) 
Избыток иода реагирует с гидроксидом натрия и обесцвечивается:
|
|
|
8) 3KI3 + 6NaOH = 3KI + 6NaI + 6NaIO3 + 3H2O
II вариант
Пробирка 1 – этиловый спирт (окисляется перманганатом калия; реагирует с хлорангидридом с образованием сложного эфира, который легче воды; даёт положительную иодоформную пробу)
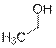
Пробирка 2 – пропан-2-он (даёт положительную иодоформную пробу)
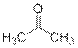
Пробирка 3 – этаналь (легко окисляется перманганатом калия; даёт положительную иодоформную пробу)
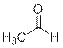
Пробирка 4 – дипропиловый эфир (не реагирует ни с одним из реагентов; легче воды)
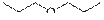
Пробирка 5 – бутановая кислота (не реагирует ни с одним из реагентов; смешивается с водой)
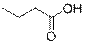
Уравнения реакций:
Альдегиды легко окисляются перманганатом калия, спирты в более жёстких условиях:
1) 
2) 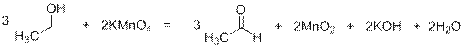
или
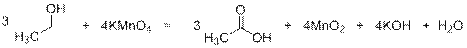
Спирты реагируют с хлорангидридами кислот с образованием сложных эфиров:
3) 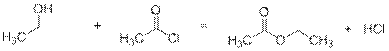
В остальных пробирках, кроме 1, при добавлении воды происходит гидролиз хлорангидрида:
4) 
Иодоформная реакция (образование светло-жёлтого осадка иодоформа CHI3) является качественной реакцией для соединений, в которых метильная группа связана с карбонильной группой, а также спиртов, которые при окислении дают вышеуказанные карбонильные соединения:
5) 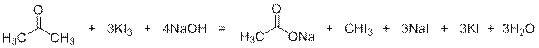
6) 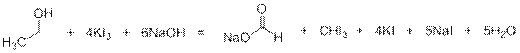
или постадийно
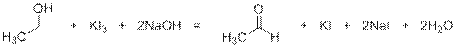

7) 
Избыток иода реагирует с гидроксидом натрия и обесцвечивается:
8) 3KI3 + 6NaOH = 3KI + 6NaI + 6NaIO3 + 3H2O
Рекомендации к оцениванию:
1) Корректное сопоставление каждого вещества
с номером пробирки по 0,5 баллов 0,5∙5 = 2,5 балла
2) Уравнения реакций 1 – 4, 8 по 0,5 баллов 0,5∙5 = 2,5 балла
3) Уравнения реакций 5 – 7 по 1 баллу 1∙3 = 3 балла
Примечание:
1) если в реакции правильные исходные вещества и продукты, но не расставлены коэффициенты, то баллы за соответствующую реакцию делятся пополам;
2) вместо KI3 в уравнениях реакции может быть использован I2
ИТОГО 8 баллов
Дата добавления: 2019-01-14; просмотров: 196; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
