Заключительный (городской) этап. Теоретический тур
Класс
№ 1
| в | г | ||||||||
| о | а | с | с | е | |||||
| д | р | з | е | в | л | ||||
| о | т | о | л | и | л | и | |||
| р | у | т | е | н | и | й | |||
| о | т | н | е | т | |||||
| м | е | д | ь | ц | и | н | к | ||
| й |
Рекомендации к оцениванию:
| 1. | Каждое верное слово: по 1 баллу | 10 баллов |
| ИТОГО: | 10 баллов | |
№ 2
Данному оксиду соответствует такой гидроксид (кислота или основание), в котором степень окисления центрального атома такая же, как в оксиде.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Б | В | Д | З | А | Г | З | Б | Ж | Е |
Уравнения реакций (возможный вариант):
а) 2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
б) Fe2O3 + 3SO3 = Fe2(SO4)3
в) 3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
Рекомендации к оцениванию:
| 1. | Каждое верное соответствие: по 0,7 балла | 7 баллов |
| 2. | Уравнения реакций: по 1 баллу | 3 балла |
| ИТОГО: | 10 баллов | |
№ 3
Взаимодействие растворов соли и щелочи приводит к обменной реакции. Т.к. нитраты металлов хорошо растворимые в воде вещества, логично предположить, что выпавший осадок – гидроксид неизвестного металла. Однако черная окраска осадка противоречит этому предположению. Значит, выпавший осадок – оксид. Он может образовываться только в случае неустойчивости соответствующего гидроксида в воде. Таких оксидов черного цвета два: Ag2O и Hg2O. Но при взаимодействии растворов нитратов этих металлов со щелочью обменный процесс будет только в случае с серебром, т.к. одновалентная ртуть склонна к диспропорционированию в растворе:
|
|
|
2AgNO3 + 2NaOH = 2NaNO3 + H2O + Ag2O↓
Hg2(NO3)2 + 2NaOH = 2NaNO3 + H2O + HgO↓ + Hg↓
Таким образом, исходный раствор – раствор нитрата серебра AgNO 3. Рассчитаем его массовую долю:
ν(Ag2O) = 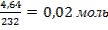
ν(AgNO3) = 0,04 моль
m(AgNO3) = 0,04∙170 = 6,8 г
ω(AgNO3) =  3,78%
3,78%
Рекомендации к оцениванию:
| 1. | Обоснованное определение AgNO3 | 3 балла |
| 2. | Уравнение реакции AgNO3 с NaOH | 2 балла |
| 3. | Расчет массовой доли | 5 баллов |
| ИТОГО: | 10 баллов | |
№ 4
Скорее всего, исходные вещества A и B – металл и неметалл (об этом говорят и цвета этих простых веществ), которые при нагревании образуют бинарное соединение C, вступающее в реакцию обмена с соляной кислотой. При этом образуется летучее водородное соединение D и хлорид исходного металла – E.
Пусть формула E – АCln, тогда массовая доля хлора в нем:

Откуда молярная масса металла:
M(А) = 9n, где n – валентность металла
| n | 1 | 2 | 3 |
| M(А), г/моль | 9 | 18 | 27 |
Единственный возможный вариант для вещества А – это алюминий (Al), валентность 3 и молярная масса 27 г/моль. Значит, речь идет о третьем периоде. Такую же валентность (III) как и алюминий в этом периоде могут проявлять фосфор и хлор, но простое вещество хлор – жёлто-зелёный газ. Тогда легковоспламеняющийся газ – фосфин PH3, его плотность ρ =  = 1,518 г/л (соответствует приведенному в условии значению).
= 1,518 г/л (соответствует приведенному в условии значению).
|
|
|
| X (элемент) | Y (элемент) | A (простое вещество) | B (простое вещество) | C | D | E |
| Al | P | Al | P | AlP | PH3 | AlCl3 |
Al + P = AlP
AlP + 3HCl = AlCl3 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
Элемент фосфор образует несколько простых веществ (аллотропные модификации): белый, красный, чёрный и металлический фосфор. Белый фосфор состоит из молекул P4 тетраэдрического строения. Остальные аллотропные модификации имеют полимерное строение. В условии задачи зашифрован красный фосфор.
Рекомендации к оцениванию:
| 1. | Вывод формул (расчет) или проверка значений, данных по условию, для соединений AlCl3 и PH3: по 1 баллу | 2 балла |
| 2. | Формулы веществ A и B: по 0,5 балла | 1 балл |
| 3. | Формулы веществ С, D, E: по 1 баллу | 3 балла |
| 4. | Уравнения реакций: по 1 баллу | 3 балла |
| 5. | Аллотропные модификации | 1 балл |
| ИТОГО: | 10 баллов | |
№ 5
1) Полная емкость всего фильтра: 900∙40 = 36000 мг, теоретический ресурс  = 18000 литров воды.
= 18000 литров воды.
|
|
|
2) В воде присутствуют и другие загрязнители, концентрация которых может быть выше, чем хлора. Кроме того, в старом фильтре могут развиваться бактерии.
3) Полная емкость фильтра 20∙50 = 1000 мг. Из каждого литра будет улавливаться 2∙0,6 = 1,2 мг хлора. Тогда ресурс:  = 833,3 литра.
= 833,3 литра.
Такой фильтр нельзя использовать, очистка 60% – слишком мала для фильтра.
Рекомендации к оцениванию:
| 1. | Ресурс фильтра 3 балла | 3 балла |
| 2. | Объяснение занижения ресурса 2 балла | 2 балла |
| 3. | Ресурс поддельного фильтра 4 балла | 4 балла |
| 4. | Вывод о непригодности фильтра 1 балл | 1 балл |
| ИТОГО: | 10 баллов | |
№ 6
1) По графику растворимость кислорода в воде при 20 oC, 760 мм.рт.ст. (1 атм.) составляет 9,0 мг/л. В 0,4 л воды растворится 9,0∙0,4 = 3,6 мг O2. Т.к. при нагревании растворимость кислорода падает, содержание его в воде уменьшится. При нагревании на 10 oC, т.е. при 30 oC в данном объеме останется только 7,5∙0,4 = 3,0 мг O2.
2) Насыщенным называется раствор, в котором содержание растворенного вещества максимально при данных условиях. При нормальных условиях (0 oC, 1 атм.) растворимость кислорода в воде составляет 14,5 мг/л.
В 400 мл воды при н.у. может раствориться не больше 14,5∙0,4 = 5,8 мг O2.
|
|
|
В закрытой колбе оставшийся объем (500 – 400 мл = 0,1 л) занимает воздух. В воздухе 21% кислорода по объему:
V(O2) = 0,21∙0,1 = 0,021 л
ν(O2) =  = 0,0009375 моль
= 0,0009375 моль
m(O2) = 0,0009375∙32 = 0,03 г = 30 мг.
Кислорода в оставшемся объеме воздуха больше, чем может раствориться при данных условиях. Следовательно, получится насыщенный раствор.
3) 1 атм. = 101325 Па;  = 4 атм. При данных условиях (по графику) растворимость кислорода в воде составляет 54 мг/л. В 700 г воды растворится 54∙0,7 = 37,8 мг O2.
= 4 атм. При данных условиях (по графику) растворимость кислорода в воде составляет 54 мг/л. В 700 г воды растворится 54∙0,7 = 37,8 мг O2.
ν(O2) = 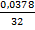 = 0,00118125 моль
= 0,00118125 моль
V(O2) = 0,00118125∙22,4 = 0,02646 л = 26,5 мл
Рекомендации к оцениванию:
| 1. | Массы кислорода в воде до и после нагревания, обоснование изменения массы: по 1 баллу | 3 балла |
| 2. | Обоснованный вывод о насыщенном растворе (с расчетом): пояснение о критерии насыщенности: 1 балл максимальная масса растворенного кислорода: 1 балл масса кислорода в воздухе: 2 балла | 4 балла |
| 3. | Растворимость при данных условиях: 1 балл Значение объема: 2 балла | 3 балла |
| ИТОГО: | 10 баллов | |
№ 7
1) Плотность газообразного вещества пропорциональна его молярной массе:
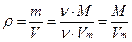
Т.е. молярная масса газа D в 1,6 раза больше молярной массы аргона:
M(B) = M(Ar)∙1,6 = 40∙1,6 = 64 г/моль
Предположим, что D представляет собой оксид:
| Число атомов кислорода в оксиде | 1 | 2 | 3 |
| Молярная масса остатка, г/моль | 48 | 32 | 16 |
При двух атомах кислорода в составе оксиде на остаток приходится 32 г/моль, что соответствует молярной массе серы. Таким образом, D – SO2 оксид серы (IV) или диоксид серы.
Прозрачная жидкость, образовавшаяся при сгорании, скорее всего, вода, Е – H2O.
Тогда вещество A содержит серу и водород (а также только три ковалентных связи):
H–S–S–H
A – H2S2 (дисероводород, дисульфан, персульфан, дисульфид водорода).
Газ, образующийся из дисульфана, содержит две ковалентные связи, единственным разумным вариантом является сероводород, или сульфид водорода: H–S–H, тогда твёрдое вещество – это простое вещество, сера. В – H2S, C – S.
2) Уравнения реакций сгорания персульфана и сероводорода в кислороде:
2H2S2 + 5O2 → 4SO2 + 2H2O
2H2S + 3O2 → 2SO2 + 2H2O
3) Заменяя атомы серы на кислород, получаем соединение Н2О2, пероксид водорода или перекись водорода.
Рекомендации к оцениванию:
| 1. | Расчёт, доказывающий состав D – SO2: 1 балл | 1 балл |
| 2. | Формулы веществ A – E: по 1 баллу | 5 баллов |
| 3. | Уравнения реакций горения: по 1 баллу | 2 балла |
| 4. | Формула пероксида водорода 0,5 балла | 0,5 балла |
| 5. | Названия веществ A – E и Н2О2: по 0,25 балла | 1,5 балла |
| ИТОГО: | 10 баллов | |
Класс
№ 1
1) В открытых сосудах нельзя хранить:
а) летучие вещества (этиловый спирт, диэтиловый эфир, бром, иод);
б) растворы газов и летучих веществ (нашатырный спирт, соляную кислоту, иодную настойку, бромную воду);
в) вещества, реагирующие с газами, входящими в состав воздуха: кислородом, углекислым газом, парами воды (гигроскопичные вещества: P2O5, H2SO4, CaCl2; щелочи и их растворы; растворимые сульфиды и сульфиты).
2) Использование таких реактивов может привести к существенным ошибкам. Например,
а) гидроксид кальция в открытом сосуде быстро переходит в карбонат (за счёт углекислого газа, присутствующего в воздухе). Если из такого реактива приготовить «известковую воду», то никакого помутнения при пропускании углекислого газа не произойдет и будет сделан неправильный вывод об отсутствии СО2 в пропускаемом газе;
б) гидроксид натрия при стоянии на открытом сосуде может поглощать из него углекислый газ с образованием соды. Если таким раствором осаждать гидроксид меди из его сульфата, то будет выпадать основная соль – карбонат гидроксомеди.
3) Многие вещества разлагаются под действием света, и их хранят в специальных сосудах из темного стекла (галогениды серебра, пероксид водорода, иодоводородная кислота, хлорная вода, азотная кислота, хлороформ).
Рекомендации к оцениванию:
| 1. | Ответ на вопрос 1 с мотивировкой | 4 балла |
| 2. | Ответ на вопрос 2 | 3 балла |
| 3. | Ответ на вопрос 3 с мотивировкой | 3 балла |
| ИТОГО: | 10 баллов | |
№ 2
1) Уравнение реакции (1): 2NaI + Br2 = 2NaBr + I2
Молярные массы: M(NaBr) = 103 г/моль, M(NaI) = 150 г/моль;
Количество вещества прореагировавшего иодида натрия равно количеству вещества полученного бромида натрия. При этом молекулярная масса изменяется на 150 – 103 = 47 (г/моль). Следовательно, масса бромида натрия, получившегося из иодида натрия, m1(NaBr) = 103m/47 = 2,19m (г), где m – потеря по массе смеси в результате 1 реакции (см. условие). А масса иодида натрия в исходной смеси: mисх(NaI) = 150m/47 = 3,19m (г).
Уравнение реакции (2): 2NaBr + Cl2 = 2NaCl + Br2
М(NaCl) = 58,5 г/моль.
Аналогично с первым уравнением количества вещества реагирующего бромида и полученного хлорида натрия равны. Молярная масса изменяется на 103 – 58,5 = 44,5 (г/моль).
Следовательно, суммарная масса бромида натрия, прореагировавшего с хлором, m2(NaBr) = 103m/44,5 = 2,31m (г).
Масса бромида натрия в исходной смеси равна массе бромида натрия, прореагировавшего с хлором (m2), за вычетом массы бромида натрия, полученного из иодида натрия при реакции с бромом (m1), а именно:
mисх(NaBr) = m2 –m1 = 2,31m – 2,19m = 0,12 m (г).
Или процентное содержание бромида натрия в исходной смеси:
ωисх(NaBr) = 100*0,12m/(0,12m + 3,19m) = 3,6%.
2) В химической лаборатории выпаривание указанных в задаче растворов следует проводить только в вытяжном шкафу.
3) Если на раствор исходной смеси подействовать избытком хлора, то могут протекать следующие процессы:
2NaI + Cl2 = 2NaCl + I2;
а далее I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
Рекомендации к оцениванию:
| 1. | Уравнения реакций (1) и (2): по 1 баллу | 2 балла |
| 2. | Расчет содержания бромида натрия | 4 балла |
| 3. | Условия выпаривания | 1 балл |
| 4. | Действие избытка хлора (1 балл за первое уравнение и 2 балла за второе) | 3 балла |
| ИТОГО: | 10 баллов | |
№ 3
1) Натрий взаимодействует с водой по уравнению:
2Na + 2H2O → 2NaOH + H2↑
Количества исходных веществ:
ν(Na) = 1,15/23 = 0,05 моль
ν(H2O) = 50/18 = 2,78 моль
Очевидно, что вода взята в большом избытке, расчет ведем по натрию:
ν(NaOH) = 0,05 моль ν(H2) = 0,025 моль
m(NaOH) = 0,05∙40 = 2 г m(H2) = 0,025∙2 = 0.05 г
Масса образовавшегося раствора:
mр-р = 1,15 + 50 – 0,05 = 51,1 г
Массовая доля электролита (гидроксида натрия) в растворе:
ω(NaOH) = 2/51,1 = 0,0392 или 3,92%.
2) Тепловой эффект реакции можно вычислить по следствию из закона Гесса:
Q = 2Qf°(NaOH)р-р. – 2Qf°(H2O)ж. = 2∙468,3 – 2∙285,8 = 365 кДж
Термохимическое уравнение: 2Na + 2H2O → 2NaOH + H2 + 365 кДж
3) Т.к. реакция сильно экзотермична, раствор будет нагреваться вследствие выделения тепла. Количество выделившейся теплоты можно вычислить по термохимическому уравнению и количеству прореагировавшего натрия:
Q =  ·365 = 9,125 кДж = 9125 Дж
·365 = 9,125 кДж = 9125 Дж
Пренебрегая теплообменом с окружающей средой, можно считать, что вся выделившаяся энергия пошла на нагревание раствора:
Q = cmΔt
Раствор нагреется на Δt =  =
=  = 43 °С, т.е. температура образовавшегося раствора составит t = 25 + 43 = 68 °С.
= 43 °С, т.е. температура образовавшегося раствора составит t = 25 + 43 = 68 °С.
4) Взаимодействие натрия с водой – процесс сильно экзотермический. В результате реакции выделяется легковоспламеняющийся газ – водород. Впоследствии может загореться и сам натрий, что при больших количествах щелочного металла неизбежно приводит к взрыву. Поэтому натрий предварительно измельчают и добавляют в воду небольшими порциями.
Рекомендации к оцениванию:
| 1. | Уравнение реакции натрия с водой | 1 балл |
| 2. | Расчет количеств исходных веществ и массы натрия | 1,5 балла |
| 3. | Расчет массовой доли электролита (без учета массы водорода или при наличии арифметической ошибки: 0,5 балла) | 1 балл |
| 4. | Термохимическое уравнение | 1,5 балла |
| 5. | Расчет выделившейся теплоты | 1,5 балла |
| 6. | Расчет Δt | 1,5 балла |
| 7. | Расчет конечной температуры раствора | 1 балл |
| 8. | Указание на возможность воспламенения и взрыва при использовании больших количеств натрия | 1 балл |
| ИТОГО: | 10 баллов | |
№ 4
1) Находим молярную массу газа Д: M(Д) = V*ρ = 22,4*1,43 = 32 г/моль.
Самовоспламеняющийся на воздухе газ с такой молекулярной массой – силан (SiH4). Значит, с некоторым металлом прокалили оксид кремния (А).
2) При прокаливании оксида кремния (А) с металлом образовался силицид этого металла и его оксид (вещества Б и В). Растворение этой смеси в избытке кислоты привело к выделению силана (газ Д), а также к образованию соли исходного металла МCln (вещество Г). Таким образом осадок Е – гидроксид металла М(OH)n, а В – его оксид МОn/2.
3) Обозначим относительную атомную массу металла за Х. Так как количество вещества хлорида металла равно эквивалентному количеству вещества его оксида, можно составить алгебраическое уравнение (n – валентность металла):
9,45/(Х + 35,45n) = 4,00/(Х + 8n).
Из этого уравнения находим Х = 12,15n. При n = 2 Х = 24,3 г/моль, это магний.
4) Вещества, зашифрованные буквами:
А – SiO2; М – Mg; Б – Mg2Si; В – MgO; Г – MgCl2; Д – SiH4; Е – Mg(OH)2.
5) Уравнения реакций:
4Mg + SiO2 = 2MgO + Mg2Si
MgO + 2HCl = MgCl2 + H2O
Mg2Si + 4HCl = 2MgCl2 + SiH4
SiH4 + 2O2 = SiO2 + 2H2O
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2 = MgO + H2O
Рекомендации к оцениванию:
| 1. | Определение веществ А – Е: по 1 баллу | 6 баллов |
| 2. | Нахождение атомной массы металла | 1 балл |
| 3. | Уравнения реакций: по 0,5 балла | 3 балла |
| ИТОГО: | 10 баллов | |
№ 5
1) В щелочи может раствориться кислотный или амфотерный оксид. При добавлении сульфида натрия возможна обменная реакция с образованием осадка сульфида, либо окислительно-восстановительная реакция с образованием осадка серы.
Сульфиды элементов, образующих кислотные (амфотерные) оксиды, как правило, легко растворяются в разбавленных кислотах. Из этого можно сделать вывод, что выпал осадок только серы.
Количество вещества серы равно: 0,96/32 = 0,03 (моль).
Окислительно-восстановительный переход, происходящий в реакции, можно записать так:
+(а – b)е
Э+а -----------------à Э+b
-2е
S-2 ------------------àS0
Для образования 0,03 моль серы в реакцию должно вступить [2/(a – b)]*0,03 = 0,06/(a – b) (моль) исходного оксида.
Тогда молярная масса оксида:
М(ЭОу) = m/ν = 2*(a – b)/0,06 = (a – b)/0,03
Рассматривая случаи (a – b) = 1, 2, 3, 4, получаем, что М(ЭОу) = 33,3, 66,6, 100, 133,3.
В зависимости от исходной степени окисления элемента Э масса кислорода в одном моле оксида (mо) меняется от 24 (а = 3) до 56 (а = 7). Анализируя разности М(ЭОу) – mо = А(Э), приходим к выводу, что условию задачи может удовлетворять единственный вариант М(ЭОу) = 100, а = 6. А(Э) = 52.
Это оксид хрома (VI) – CrO3.
2) Уравнения реакций:
CrO3 + 2NaOH = Na2CrO4 + H2O
2Na2CrO4 + 3Na2S + 8H2O = 3S + 2Na[Cr(OH)4] + 8NaOH
либо 2Na2CrO4 + 3Na2S + 8H2O = 3S + 2Na3[Cr(OH)6] + 4NaOH
Рекомендации к оцениванию:
| 1. | Определение оксида с обоснованием и расчетами | 6 баллов |
| 2. | Уравнения реакций: по 2 балла | 4 балла |
| ИТОГО: | 10 баллов | |
№ 6
1) Суммарное молекулярное уравнение растворения золота в «царской водке»:
2Au + 3HNO3 + 11HCl = 2HAuCl4 + 3NOCl + 6H2O
(окислительный потенциал образования однозарядного комплексного аниона AuCl4- ниже потенциала образования трехзарядного иона Au3+).
2) Метод древних индейцев основан на свойстве золота растворяться в «царской водке». Уравнение реакции в сокращенной ионной форме:
2Au + 3NO3- + 11Cl- + 12Н+ = 2AuCl4- + 3NOCl + 6H2O
Для растворения золота необходимо одновременное присутствие нитрат-ионов (окислителя), хлорид ионов (комлексообразователя) и ионов водорода.
По рецепту индейцев нагревание смеси приводило к разложению квасцов:
KAl(SO4)2*12H2O = KAl(SO4)2 + 12H2O.
В образовавшейся воде растворялись не только квасцы, но и добавленные нитрат натрия (чилийская селитра) и хлорид натрия (поваренная соль).
Соль алюминия частично гидролизована в растворе:
Al3+ + H2O = (AlOH)2+ + Н+ .
Повышение температуры увеличивает степень гидролиза, а также окислительный потенциал системы. В результате этого оказывается возможным окисление золота с образованием растворимых в воде комплексов.
3) Современный способ извлечение золота основан на реакции комплексообразования и последующем вытеснении золота цинком:
4Au + 8NaCN + O2 + 2H2O = 4Na[Au(CN)2] + 4NaOH
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Рекомендации к оцениванию:
| 1. | Уравнение реакции растворения в царской водке (при написании хлорида золота – 2 балла) | 3 балла |
| 2. | Объяснение рецепта индейцев: (разложение квасцов: 1 б.; ионные уравнения: 1 б.; частичный гидролиз как обратимый процесс: 1 б.; объяснение роли нагревания в гидролизе и окислении: 1 б.) | 4 балла |
| 3. | Современный способ извлечения золота | 3 балла |
| ИТОГО: | 10 баллов | |
№ 7
а) Вещества, зашифрованные буквами:
А – Na; Б – O2; В – Na2O2; Г – NaOH; Д – Na2O; Е – H2; Ж – NaH; И – NaO2
б) Ключом к решению являются уравнения 10 и 11. При реакции с газом Б образуется вещество, дающее в реакции с водой пероксид водорода. Это наводит на мысль, что газ Б – это кислород. В уравнении 2 при реакции с водой продукта окисления А образуется кислород. Это дает основание предположить, что В – пероксид. Реакция А и продуктов его окисления приводит к образованию вещества Г (уравнения 2, 5, 11). В реакции 5 образуется газ Е, который реагирует с кислородом и А, причем продукт реакции Е с А, вещество Ж, реагирует с водой с образованием Г и снова выделяется Е (уравнение 8). Все эти реакции позволяют предположить, что Е – водород, а А – щелочной металл (см. коэффициенты в уравнениях). Образование пероксида в реакции (1) исключает из ряда литий. Надпероксид же образуется в жестких условиях, значит А – натрий.
в) Названия: «В» – пероксид натрия; «Ж» – гидрид натрия; «И» – надпероксид натрия.
г) В условии задачи зашифрованы уравнения:
1) 2Na+ O2 = Na2O2; 2) 2Na2O2 + 2H2O = 4NaOH + O2;
3) Na2O2 + 2Na = 2Na2O; 4) Na2O + H2O = 2NaOH;
5) 2Na + 2H2O = H2 + 2NaOH; 6) 2H2 + O2 = 2H2O;
7) 2Na + H2 = 2NaH; 8) NaH + H2O = H2 + NaOH;
9) 2NaOH + 2Na = 2Na2O + H2; 10) Na2O2 + O2 = 2NaO2;
11) 2NaO2 + 2H2O = 2NaOH + H2O2 + O2.
Рекомендации к оцениванию:
| 1. | Зашифрованные вещества: по 0,5 балла | 4 балла |
| 2. | Обоснования | 2,5 балла |
| 3. | Названия веществ: по 0,25 балла | 0,75 балла |
| 4. | Уравнения реакций: по 0,25 балла | 2,75 балла |
| ИТОГО: | 10 баллов | |
Класс
№ 1
1) Твердый материал, изоэлектронное углероду бинарное соединение, вероятно, нитрид бора, BN (К). Тогда можно предположить, что в задаче описываются превращения соединений бора. В органическом синтезе в качестве восстановителя, действительно, используется борсодержащее соединение, NaBH4 (D). Кроме того, борсодержащее соединение, имеющееся в домашней аптечке, – борная кислота, Н3ВО3 (F).
Превращения, зашифрованные в левом цикле
При нагревании борная кислота превращается сначала в метаборную кислоту, а затем – в оксид бора:
Н3ВО3 (F) = НВО2 (G) + Н2О (допускаются также (HBO2)n, H2B4O7)
2НВО2 (G) = В2О3 (H) + Н2О
При взаимодействии последнего с фтороводородом получается фторид бора (Х):
В2О3 (H) + 3CaF2 + 3H2SO4 = 2BF3 (Х) + 3CaSO4 + 3H2O
Взаимодействием фторида бора с хлоридом алюминия получают хлорид бора (А):
BF3 (Х) + AlCl3 = BCl3 (А) + AlF3.
Хлорид бора (А) вступает в обменную реакцию с HI, образуя иодид бора BI3 (E), который при действии воды гидролизуется до борной кислоты (F).
Превращения, зашифрованные в правом цикле
Действием электрического разряда на BCl3 получается B2Cl4 (B):
2BCl3 (А) + 2Hg = B2Cl4 (B) + Hg2Cl2,
а при взаимодействии последнего с водородом – диборан (C):
B2Cl4 (B) + 5H2 = B2H6 (C) + 4HCl
Диборан (C) может быть также получен из NaBH4 (D) и фосфорной кислоты:
2NaBH4 (D) + H3PO4 = B2H6 (C) + Na2HPO4 + 2H2
Борогидрид натрия (D) реагирует с иодом:
NaBH4 (D) + 4I2 = BI3 (E) + NaI + 4HI
Превращения в верхней части схемы
BN (К) получают термическим разложением тетрафторбората аммония (J) при высоких температуре и давлении. При более низкой температуре эта соль разлагается на трифторид бора (X) и фторид аммония. Последний при взаимодействии с оксидом бора образует фторид бора:
NH4BF4 (J) = BN (К) + 4HF
NH4BF4 (J) = BF3 (X) + NH4F
BF3 (X) + NaF = NaBF4 (I)
Оставшиеся уравнения реакций:
2BCl3 (А) + Al2(CH3)6 = B2(CH3)6 (?) + Al2Cl6
4BF3 (X) + 3NaBH4 (D) = 2B2H6 (С) + 3NaBF4 (I)
2) BCl3 (А) + 3NH4Cl + 2NaBH4 (D) = B3N3H6 (боразол) + 2NaCl + 4HCl + 5H2
3) H3BO3 + 4KF = KBF4 + 3KOH
| Ответы: X – BF3 A – BCl3 B – B2Cl4 C – B2H6 D – NaBH4 E – BI3 F – H3BO3 G – HBO2, допускаются (HBO2)n, H2B4O7 H – B2O3 I – NaBF4 J – NH4BF4 K – BN | 
|
Рекомендации к оцениванию:
| 1. | Определение искомого элемента | 1 балл |
| 2. | 12 зашифрованных веществ: по 0,25 балла | 3 балла |
| 3. | 14 реакций: по 0,25 балла | 3,5 балла |
| 4. | Реакция хлорида бора с триметилалюминием | 0,5 балла |
| 5. | Образование боразола | 1 балл |
| 6. | Реакция борной кислоты с фторидом калия | 1 балл |
| ИТОГО: | 10 баллов | |
№ 2
1) Соединения могут иметь формулу MXn (X – галоген, n – валентность металла M).
Исходя из массовой доли элемента, можно найти молярную массу металла:
| n | Возможный металл | Молекулярная масса металла | |||
| MFn | MCln | MBrn | MIn | ||
| 1 | натрий | 23,2 | 23,2 | 23,2 | 23,2 |
| 2 | ‒ | 46,4 | 46,4 | 46,4 | 46,4 |
| 3 | галлий | 69,6 | 69,6 | 69,6 | 69,6 |
| 4 | ниобий | 92,8 | 92,8 | 92,8 | 92,8 |
| 5 | ‒ | 116 | 116 | 116 | 116 |
| 6 | ‒ | 139,2 | 139,2 | 139,2 | 139,2 |
Из полученных данных видно, что в соединениях со всеми галогенидами металл имеет одинаковую валентность.
Исходя из максимальных валентностей подходят натрий и галлий.
Однако, известно, что все соединения натрия с галогенами являются ионными, поэтому в ряду NaF ‒ NaCl ‒ NaBr ‒ NaI не должно происходить резкого уменьшения температуры плавления и кипения.
Поэтому, металл – галлий, а его галогениды имеют общую формулу GaX3.
2) Вследствие большой разницы электроотрицательностей галлия и фтора кристаллический фторид галлия имеет ионную кристаллическую решетку. Хлорид, бромид и иодид галлия в кристаллическом состоянии имеют молекулярную структуру. В соединениях с ионной кристаллической решеткой связь между ионами гораздо более прочная, чем связь между молекулами в структурах молекулярного типа. Поэтому вещества с молекулярной кристаллической решеткой имеют более низкие температуры кипения/сублимации, чем вещества с ионной структурой.
3) а) Кристаллический фторид галлия имеет ионную решетку с октаэдрическим окружением галлия (координационное число галлия равно 6 в кристаллической фазе, гибридизация атома галлия sp3d2).

б) Вследствие того, что атомы хлора, брома и иода имеют радиус намного больше, чем атом фтора, то координационное число 6 не может быть реализовано в хлориде, бромиде и иодиде галлия. Поэтому в данных соединениях галлий имеет тетраэдрическое окружение с координационным числом 4 в кристаллической фазе и гибридизацией атома галлия sp3. Кристаллы хлорида, бромида и иодида галлия имеют молекулярную структуру, где димерные молекулы Ga2Cl6, Ga2Br6 и Ga2I6 находятся в узлах кристаллической решетки.
в) Фторид галлия существует в газовой фазе как мономер GaF3. Структура – плоский правильный треугольник, координационное число 3, гибридизация атома галлия sp2.

г) Хлорид, бромид и иодид галлия существуют в газовой фазе в виде димеров Ga2Cl6, Ga2Br6 и Ga2I6, структуры которых приведены на рисунке (тетраэдрическое окружение атома галлия, координационное число 4), гибридизация атома галлия sp3.



4) Галлий также может образовывать моногалогениды: GaF, GaCl, GaBr, GaI.
Рекомендации к оцениванию:
| 1. | Нахождение металлов расчёт подходящих металлов по массовой доле галогенов - 0,5 балла определение общей формулы галогенидов - 0,5 балла объяснение, почему выбран галлий - 1 балл | 2 балла |
| 2. | Объяснение последовательности изменения температур плавления и кипения | 1 балл |
| 3. | Для 4 соединений в кристаллическом состоянии и 4 соединений в газовой фазе (8 случаев) за каждую структуру 8 ∙ 0,25 балла за координационное число в каждом соединении 8 ∙ 0,25 балла за гибридизацию центрального атома 8 ∙ 0,25 балла | 6 баллов |
| 4. | Приведены моногалогениды галлия | 1 балл |
| ИТОГО: | 10 баллов | |
№ 3
1) Найдём удельный объём пор: α = 39,2/49 = 0,8 мл/г. Если 20 г силикагеля содержит 1,4·1020 «идеальных» пор, то 1 г содержит 7·1018 пор, тогда можно найти объём одной поры: V = 0,8/(7·1018) = 1,143·10–19 мл. Откуда по формуле объёма сферы находим радиус «идеальной» поры: 1,143·10–19 = 4/3πr3, r = 3·10-7 см = 30 Å, – значит диаметр поры: d = 60 Å.
2) Пористость материалов также можно определять по изотермам адсорбции. Ещё один метод определения пористости – это изменение уровня жидкости при взаимодействии с пористым материалом.
3) Так как поверхность силикагеля гидрофильная (из-за наличия большого количества полярных групп на поверхности), то при использовании воды большее количество газа, содержащегося в адсорбенте, должно выделиться, тогда как в случае применения неполярного гексана для данных целей за тот же промежуток времени не весь содержащийся газ выйдет из пор материала, что повлечёт за собой большие неточности.
4) Предположим, что мы работаем с 1 г силикагеля, тогда объём аргона, содержащегося в нём: 0,8 ∙ 0,9 = 0,72 мл (так как содержание аргона на 10% меньше максимально возможного). Откуда зная условия, при которых существует система, рассчитаем по уравнению Менделеева–Клапейрона количество вещества аргона в 1 г адсорбента:
300∙103∙0,72∙10-6/(8,31∙283) = 91,8 мкмоль, что соответствует массе 0,00367 г, то есть массовая доля аргона в системе: ω(Ar) = 0,00367∙100%/(1 + 0,00367) = 0,365%.
5) Na2SiO3 + H2SO4 = Na2SO4 + nH2SiO3
H2SiO3 = nH2O·SiO2 + (1 – n)H2O (нагревание, 0 < n < 1)
Рекомендации к оцениванию:
| 1. | Расчёт диаметра поры | 3 балла |
| 2. | Способ определения пористости | 1 балл |
| 3. | Правильная оценка в пользу использования воды | 1 балл |
| 4. | Расчёт ω(Ar) | 3 балл |
| 5. | Уравнения реакций: по 1 баллу | 2 балла |
| ИТОГО: | 10 баллов | |
№ 4
Зашифрованные вещества:
1 – Сu, 2 – Cu(NO3)2, 3 – Cu(OH)2, 4 – CuO, 5 – KCuO2, 6 – CuSO4, 7 – [Cu(NH3)4](OH)2,
8 – CuCl2, 9 – (CuOH)2CO3, 10 – H[CuCl2]
Уравнения реакций:
1) 1→2 3Cu + 8HNO3 разб = 3Cu(NO3)2 + 2NO + 4H2O
или Cu + 4HNO3 конц = Cu(NO3)2 + 2NO2 + 2H2O
2) 2→4 2Cu(NO3)2 = 2CuO + 4NO2 + O2
3) 2→3 Cu(NO3)2 + 2KOH = Cu(OH)2 + 2KNO3
4) 3→4 Cu(OH)2 = CuO + H2O
5) 3→7 Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
6) 4→1 CuO + C2H5OH = Cu + CH3COH + H2O
7) 4→5 2CuO + 2KO2 = 2KCuO2 + O2
8) 5→8 2KCuO2 + 8HClконц = 2CuCl2 + Cl2 + 2KCl + 4H2O
9) 5→6 2KCuO2 + 4H2SO4 разб = 2CuSO4 + 2K2SO4 + 4H2O + O2
10) 6→9 2CuSO4 + 2K2CO3 + H2O = (CuOH)2CO3 + 2K2SO4 + CO2
11) 6→1 CuSO4 + Zn = ZnSO4 + Cu
12) 1→10 6Cu + KClO3 + 12HCl = 6H[CuCl2] + KCl + 3H2O
13) n[Cu(NH3)4](OH)2 + (C6H10O5)n = nСu(C6H10O5)(OH)2 + 4nNH3
Рекомендации к оцениванию:
| 1. | Вещества: по 0,4 балла | 4 балла |
| 2. | Реакции 1)-4), 11): по 0,4 балла | 2 балла |
| 3. | Реакции 5)-10), 12), 13): по 0,5 балла | 4 балла |
| ИТОГО: | 10 баллов | |
№ 5
Галстук – галоген, вулкан – алкан, боль – соль, ароматное – ароматическое.
Так как все три продукта первой реакции являются линейными алканами, то A и B – галогеналканы (CH3(CH2)nHal), а реакция похожа на реакцию Вюрца. Рассчитаем молекулярную массу A исходя из ω(Hal): ω(Hal) = Mr(Hal)/Mr(A); Mr(A) = Mr(Hal)/ω(Hal), – откуда составим таблицу:
| Hal | F | Cl | Br | I |
| Mr | 35,9 | 67 | 151 | 239,7 |
| Формула | - | - | CH3(CH2)4Br | - |
Итак, A – 1-бромпентан, тогда один из продуктов первой реакции – декан. Узнаем молярную массу наиболее летучего продукта CxH2x+2: ω(C) = x∙Mr(C)/Mr(CxH2x+2); Mr(CxH2x+2) = x∙Mr(C)/ω(C); Mr(CxH2x+2) = 14,33∙x, – составим таблицу зависимости Mr(CxH2x+2) от x:
| x | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
| Mr ( CxH 2 x +2 ) | 14,33 | 28,66 | 43 | 57,32 | 71,65 | 86 | 100,31 | 114,64 | 129 | … |
| Формула | - | - | - | - | - | CH3(CH2)4 CH3 | - | - | - | … |
Так как второй продукт – гексан, а одно из исходных веществ – 1-бромпентан, то возможно 2 варианта исходных веществ: бромметан или 1-бромпропан, – но по причине того, что гексан – самый летучий из продуктов, вещество B – 1-бромпропан.
Определим состав соли Y: ω(X) = 22,33%, – откуда: ω(Br) = 77,67%, – находим, что X – это натрий.
Попробуем определить продукт реакции A с C. ω(C) = 100 – ω(H); ω(C) = 89,19%; n(C)/n(H) = (89,19%:12)/(10,81%:1) = 1/1,454 = 11/16, – и простейшая формула C – C11H16. В условиях данной реакции основным продуктом должно являться производное бензола с алкильным заместителем и, соответственно, удовлетворять формуле CyH2y-6, то есть брутто-формула C – C11H16 (н-пентилбензол). Отсюда понятно, что C – это бромбензол, так как ещё одним продуктом реакции является бромид натрия.

Способ получения бромбензола из неорганических веществ:

Рекомендации к оцениванию:
| 1. | Правильно определены и названы вещества (А, В, С, гексан, октан, декан, пентилбензол, NaBr): по 0,75 балла (без названия: 0,5 балла за вещество) | 6 баллов |
| 2. | Приведены верные расчёты: (NaBr, 1-бромпентан и гексан: по 0,5 балла; за пентилбензол: 1 балл) | 2,5 балла |
| 3. | Предложен верный способ получения бромбензола (по 0,5 баллов за стадию; если предложен свой способ, то максимальный балл ставится, если синтез доведен до конца) | 1,5 балла |
| ИТОГО: | 10 баллов | |
№ 6
Найдём формулу углеводорода X: (ω(C)/Mr(C))/(ω(H)/Mr(H)) = 91,3/12 : 8,7 = 7 : 8, – степень непредельности равна 4, что соответствует толуолу, основной источник которого именно нефть. Нитропроизводных толуола четыре:

Но только у пара-нитротолуола имеется три структурно неэквивалентных типа атомов водорода, который поэтому и является исходным соединением.
Итак, необходимо окислить метильную группу при ароматическом кольце до спиртовой, альдегидной и карбоксильной групп. На первой стадии нужно получить хлор-, дихлор- и трихлорпроизводные по метильной группе. Это можно осуществить с помощью хлора, который можно в свою очередь получить электролизом хлорида натрия:
NaOH + HCl = NaCl + H2O;
2NaCl + 2H2O = 2NaOH + H2 + Cl2 (электролиз)
Далее на свету можно прохлорировать пара-нитротолуол. После чего гидролизом полученных галогенпроизводных можно получить требуемые по условию задачи вещества:

Однако гидролиз дихлорпроизводного необходимо проводить с осторожностью во избежание протекания с альдегидом реакции диспропорционирования (реакция Канниццаро).
Рекомендации к оцениванию:
| 1. | Правильно определен толуол и пара-нитротолуол по 1 баллу | 2 балла |
| 2. | Идея об электролизе | 1 балл |
| 3. | Способ получения спирта и альдегида: по 2 балла | 4 балла |
| 4. | Способ получения кислоты | 3 балла |
| ИТОГО: | 10 баллов | |
№ 7
Электролиз водного раствора калиевой соли карбоновой кислоты (реакция Кольбе) может быть описан следующей схемой:

Из данных, имеющихся в условии, можно рассчитать молярную массу радикала R.
Количество вещества соли: n(соли) = 3/(M(R) + 83)
Количество вещества углеводорода: n(R‒R) = 0,298/2M(R)
Учитывая, что по уравнению реакции углеводорода получается в два раза меньше, чем соли, а также то, что препаративный выход углеводорода составил 30%, получаем:
2n(R‒R) = 0,3n(соли), тогда получаем уравнение с одним неизвестным:
2∙0,298/2M(R) = 0,3∙3/(M(R) + 83)
Откуда M(R) = 41 г/моль. Такой массе соответствует брутто-состав С3H5 (состав С2ОН менее вероятный). Возможное строение радикала, углеводорода В и продуктов его озонолиза представлено в таблице:
| R | углеводород B | продукты озонолиза | |
| а | 
| 
| 
|
| б | 
| 
| 
|
| в | 
| 
| 
|
| г | 
| 
|
В задаче использовались восстановительные условиях озонолиза (для разложения озонида использовался сульфит натрия, являющийся восстановителем). В этом случае из гекса-1,5-диена (пункт а) образуется бутандиаль и формальдегид; из гекса-2,4-диена (пункт б) образуется этандиаль и ацетальдегид; из 2,3-диметилбута-1,3-диена (пункт в) образуется бутан-2,3-дион и формальдегид. Вариант г отпадает, так как циклопропаны устойчивы к действию озона. Реактив Толленса – [Ag(NH3)2](OH) – дает реакцию «серебряного зеркала» из предложенных продуктов озонолиза только с альдегидами, поэтому вариант пункта в отпадает.
Чтобы сделать выбор между гекса-1,5-диеном и гекса-2,4-диеном, воспользуемся тем, что из 0,298 г углеводорода В образовалось 0,312 г вещества D.
Масса ацетальдегида, который мог быть получен из 0,298 г В (гекса-2,4-диен) равна: 2∙44∙0,298/82 = 0,320 (г)
Масса бутандиаля, который мог быть получен из 0,298 г В (гекса-1,5-диен) равна: 86∙0,298/82 = 0,312 (г), что совпадает с условием задачи.
Таким образом, соединение В – гекса-1,5-диен.

| 
| 
| 
|
| А | В | C | D |
| бут-3-еновая кислота | гекса-1,5-диен | метаналь | бутандиаль |
Уравнение реакции электролиза:

Уравнение реакции озонолиза:

Взаимодействие альдегидов С и D с реактивом Толленса:

или 

или 
Рекомендации к оцениванию:
| 1. | Выход на брутто-формулу радикала С3H5 (с расчётом) | 1,5 балла |
| 2. | Выход на структурную формулу радикала (с расчётом и анализом) | 1,5 балла |
| 3. | Структурные формулы A – D: по 0,75 балла | 3 балла |
| 4. | Названия соединений A – D: по 0,25 балла | 1 балл |
| 5. | Уравнения электролиза и озонолиза: по 1 баллу | 2 балл |
| 6. | Уравнения реакций с реактивом Толленса: по 0,5 балла | 1 балл |
| ИТОГО: | 10 баллов | |
Класс
№ 1
Определим состав вещества F. Его молярная масса может быть рассчитана из следующего соотношения:
M(F) = 79,904∙n/0,8888, где n – количество атомов брома в молекуле.
При n = 1: M = 89,90 г/моль, т.е., на кислород, элемент Х и, возможно, еще какой-то элемент приходится 10 г/моль – разумного решения нет.
При n = 2: M = 177,8 г/моль – разумного решения нет.
При n = 3: M = 269,7 г/моль – на остальные элементы приходится 30 г/моль, что соответствует фрагменту NO. Тогда вещество F – NOBr3. Элемент Х – азот.
Вещество С, которое получается при взаимодействии оксида азота с простым веществом, – NOBr. Вещества А и В – NOF и NOCl, соответственно.
Соединения D и Е, получаемые взаимодействием соответствующих нитрозилгалогенидов с озоном, являются нитрилгалогенидами NO2F и NO2Cl, соответственно.
Поскольку нитрозилфторид бесцветен, логично предположить, что и нитрилфторид не будет иметь окраски.
Близость температур плавления нитрозилхлорида и нитрозилбромида, а также аналогичная природа связей в молекулах этих соединений позволяют предположить, что разница в температурах кипения будет примерно такой же, что и для температур плавления, т.е., температура кипения нитрозилбромида составит около 0 °С.
Строение молекулы нитрозилфторида, очевидно, нелинейное (есть неподеленная электронная пара на атоме азота).
Длина связи N – O в молекуле нитрозилхлорида должна, вероятно, составлять 1,14 Å.
Массовая доля азота в этом веществе составляет 21,39%.
Тогда заполненная таблица будет иметь вид:
| Соединение | A | B | C | D | E |
| Цвет газа (ст.у.) | Бесцветный | Оранжево-жёлтый | Красный | бесцветный | Бесцветный |
| Т. пл., °C | -133 | -62 | -56 | -166 | -145 |
| Т. кип., °C | -60 | -6 | 0 | -72 | -15 |
| Строение | нелинейное | Нелинейное | Нелинейное | Плоское | Плоское |
| Длина связи X-O, Å | 1,13 | 1,14 | 1,15 | 1,23 | 1,25 |
| Дипольный момент | 1,81 | 1,83 | 1,80 | 0,47 | 0,42 |
| Угол O-X-O,град | - | - | - | 125 | 130 |
| Содержание X,% | 28,57 | 21,39 | 12,74 | 21,54 | 17,18 |
Реакции:
1) 2NO + Х2 = 2NOХ (Х = F, Cl, Br)
2) NOBr + Br2 = NOBr3
3) NOХ + O3 = NO2Х + O2 (Х = F, Cl)
Реакции с водой:
4) 3NOX + 2H2O = HNO3 + 2NO + 3HX
5) NO2X + H2O = HNO3 + HX
Реакции со щелочами:
6) NOX + 2NaOH = NaNO2 + NaX + H2O
(возможен вариант, производный от реакции с водой)
7) NO2X + 2NaOH = NaNO3 + NaX + H2O
Альтернативные способы получения нитрилгалогенидов:
8) 2NO2 + F2 = 2NO2F или NO2 + CoF3 = NO2F + CoF2
9) HNO3 + HSO3Cl = NO2Cl + H2SO4
Рекомендации к оцениванию:
| 1. | Определение элемента Х: 1 балл | 1 балл |
| 2. | Определение веществ: по 0,5 балла | 3 балла |
| 3. | Заполнение пропусков в таблице: по 0,25 балла | 1,25 балла |
| 4. | Реакции 1-3, 5-9: по 0,5 балла Реакция 4 (нитрозилгалогенида с водой): 0,75 балла | 4,75 балла |
| ИТОГО: | 10 баллов | |
№ 2
1. Кальцинированная сода – безводный Na2CO3, глауберова соль – Na2SO4∙10H2O.
2. При растворении смеси в воде будут присутствовать ионы Na+, Al3+, SO42–, Cl–, CO32–. Одновременное присутствие в растворе катиона слабого нерастворимого основания и аниона слабой летучей кислоты приводит к их совместному гидролизу:
2Al3+ + 3CO32– + 6H2O = 2Al(OH)3↓ + 3CO2↑ + 3H2O (в кратком ионном виде);
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl (в молекулярном виде)
Отсутствие реакции фильтрата с HCl и NaOH говорит о том, что ионы CO32– и Al3+ в растворе отсутствуют. Таким образом, фильтрат содержит только NaCl и Na2SO4. Последний образует осадок при добавлении BaCl2:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
3. Расчёты
1) Рассчитаем количество вступившего в реакцию безводного сульфата натрия:
mв-ва (BaCl2) = Vр-ра∙ ρ ∙ ω = 62,4 г; n(BaCl2) = 0,3 моль; n(Na2SO4) = 0,3 моль.
2) Вычислим массу глауберовой соли до растворения в воде:
n(Na2SO4∙10H2O) = n(Na2SO4) = 0,3 моль; m(Na2SO4∙10H2O) = 96,6 г.
3) На две другие соли приходится масса 117 г. Их количества связаны стехиометрическим уравнением. Обозначив их через переменную: n(AlCl3) = x моль, n(Na2CO3) = 1,5x моль, можем получить уравнение связи: 133,5x + 106 ∙ 1,5x = 117 г. Решая его, получаем количества и массы солей, после чего рассчитываем их массовые доли.
| Na2SO4∙10H2O | 0,3 моль | 96,6 г | 45 ,22% |
| AlCl3 | 0,4 моль | 53,4 г | 25,00% |
| Na2CO3 | 0,6 моль | 63,6 г | 29,78% |
Рекомендации к оцениванию:
| 1. | Формулы кальцинированной соды и глауберовой соли: по 1 баллу | 2 балла |
| 2. | Уравнения: совм. гидролиза солей: 2 балла, фильтрата с BaCl2: 0,5 балла | 2,5 балла |
| 3. | Расчёт количества сульфата натрия: 0,5 балла | 0,5 балла |
| 4. | Расчет массы глауберовой соли и остатка: 1 балл | 1 балл |
| 5. | Составление уравнения по остатку: 2 балла, его верное решение: 1 балл | 3 балла |
| 6. | Массовые доли всех солей: 1 балл | 1 балл |
| ИТОГО: | 10 баллов | |
№ 3
1) Определим брутто-формулу соединения X:
 .
.
Тогда запишем X как СnHnY и MY/(13n + MY) = 0.3002, откуда MY = 5.58n
Наиболее вероятно, что пятизвенный цикл циклопентадиена сохранился и в Х. Тогда при n = 5 MY = 27.9, при n = 10 MY = 55.8, откуда следует, что Y – Fe, X – C10H10Fe; тогда, формально, заряд ароматической системы будет равен -2, а атома железа +2. Таким образом, можно записать формулу X как Fe ( η 5 - C 5 H 5 )2, соединение X носит название ферроцен.
Из названия класса соединений («сэндвичевые») можно прийти к выводу, что в ферроцене ион железа находится между двумя циклопентадиенил-анионами. В циклопентадиенильном анионе отрицательный заряд не локализован на одном атоме углерода, а равномерно распределена по всем пяти атомам, длины всех связей углерод-углерод являются одинаковыми, что является причиной эквивалентности всех атомов водорода как в анионе, так и в молекуле ферроцена. Именно поэтому в спектре ЯМР 1Н присутствует лишь один сигнал в ароматической области.
2) Существуют несколько методов синтеза ферроцена, например:

3) На первой стадии схемы превращений происходит бромирование ферроцена по механизму электрофильного ароматического замещения с образованием бромферроцена (A). Далее нуклеофильное ароматическое замещение брома на азидо-группу приводит к азидоферроцену (B). При обработке азидоферроцена реактивом Гриньяра образуется фенилферроценилтриазен (C), обработка которого иодоводородной кислотой приводит к неустойчивой соли ферроценилдиазония (D), легко разлагающейся на иодферроцен (E) с выделением азота. Наконец, нагревание иодферроцена в присутствии металлической меди приводит к соединению двух фрагментов ферроцена с образованием диферроценила (F):

Рекомендации к оцениванию:
| 1. | Вывод брутто-формулы X (с анализом) | 0,5 балла |
| 2. | Количество сигналов в спектре ЯМР 1Н ферроцена | 0,5 балла |
| 3. | Структуры соединений X, А – F: по 1 баллу (для C – любая таутомерная форма) | 7 баллов |
| 4. | Уравнение реакции синтеза ферроцена из в условия задачи | 1 балл |
| 5. | Дополнительный метод синтеза ферроцена | 1 балл |
| ИТОГО: | 10 баллов | |
№ 4
Массовая доля неизвестного металла в соединении Х составляет 61,34%. Молярная масса металла может быть вычислена по соотношению:
M = 12n∙61,34/12,37, где n – число атомов углерода, приходящихся на 1 атом металла.
Получаем
n = 1, М = 59,5 г/моль – такого металла нет.
n = 2, М = 119 г/моль – молярная масса близка молярной массе олова (118,7 г/моль).
n = 3, М = 178,5 г/моль – гафний (он очень редок, а соединения трехвалентного гафния малоустойчивы).
n = 4, М = 238 г/моль – уран.
В аналитической практике используются именно соединения урана.
Для урана известны 4 изотопа: U-238, U-235, U-234, U-239. Самый распространённый в природе U-238, полезный для практического применения U-235.
Для разделения изотопов используется гексафторид урана UF6. Это единственное стабильное и легколетучее соединение урана, использующееся при разделении его изотопов (газовой диффузии и центрифугировании). Его применение обусловлено тем, что фтор имеет всего один изотоп (это не вносит дополнительной усложняющей разницы в массах) и то, что UF6 – стехиометрическое соединение.
Получение гексафторида урана:
1) 3U3O8 + 20HNO3 = 9UO2(NO3)2 + 2NO + 10H2O
2) 6UO2(NO3)2 + 26NH3 = 3(NH4)2U2O7 + 27H2O + 16N2
3) (NH4)2U2O7 + 2H2 = 2UO2 + 2NH3 + 3H2O
4) UO2 + 4HF = UF4 + 2H2O
5) UF4 + F2 = UF6
Найдём молярную массу соединения Х. M(X) = 238/0,6134 = 388 г/моль.
Найдем число атомов кислорода и водорода в Х по формуле n = ω∙M(Х)/A.
n(H) = 6, n(O) = 6, отсюда следует, что брутто-формула соединения X – UC4O6H6.
Так как взаимодействием этого соединения с ионом натрия происходит в уксуснокислой среде, то можно предположить, что и в составе Х есть ацетат-анион. Тогда соединение Х – это ацетат уранила. Его структурная формула:


Na+ + UO2(CH3COO)2 + CH3COO- = Na(UO2)(CH3COO)3 или
NaCl + UO2(CH3COO)2 + CH3COOH = Na(UO2)(CH3COO)3 + HCl
U4+ существует в кислой среде, в среде близкой к нейтральной он гидролизуется до UOH3+. Наиболее устойчивая степень окисления – +6. U+6 существует в виде оксокатиона UO22+ (уранил-катион).
Рекомендации к оцениванию:
| 1. | Определение металла | 1,5 балла |
| 2. | Информация об изотопах | 1 балл |
| 3. | Способ синтеза высшего фторида | 2,5 балла |
| 4. | Структурная формула ацетата уранила (если не изображена координация кислорода карбонильной группы к урану: 1 балл) | 2 балла |
| 5. | Качественная реакция на ион натрия | 1 балл |
| 6. | Формы существования урана в растворе (четырёхвалентного и шестивалентного): по 1 баллу | 2 балла |
| ИТОГО: | 10 баллов | |
№ 5
1) Судя по условию, A – D, F, H – какие–то циклические органические соединения. Определим состав B, исходя из ω(Hal в B).
Так как в реакции радикального галогенирования используются хлор и бром, то:
| Hal | Mr(B) | R-Hal |
| Cl | 78,6 | C3H7Cl |
| Br | 176,9 | C7H13Br |
Степень непредельности в C3H7Cl равна 0, чего не может быть по условию задачи, так как B – циклическое соединение (степень непредельности 1 или больше). Тогда B – это C7H13Br, а A – C7H14. Тогда C и D являются циклоалкенами состава C7H12.
X – простое вещество, которое при пропускании через него электрического тока даёт другое простое вещество Y. Ко всему прочему X – газ, что окончательно даёт понять, что речь идёт о кислороде и, соответственно, об озоне.
При восстановительном озонировании должны образовываться альдегиды и кетоны, тогда можно сделать вывод, что E – G содержат карбонильные группы, и к тому же в C двойная связь находится вне цикла, так как образуется два продукта, а в D – в цикле. Определим, чем является соединение E: ω(O в E) = 36,36%, тогда Mr(E) = 44, откуда имеем состав C2H4O – ацетальдегид (углекислый газ, имеющий ту же молярную массу, не подходит по причине того, что озонолиз восстановительный). Так как при восстановительном озонолизе одним из продуктов является ацетальдегид, то возможные структурные формулы циклоалкена C:

(производные циклопропана не подходят, так как при действии брома циклопропановый цикл раскрывается с образованием дибромпроизводного)
Однако, так как в D двойная связь должна находиться в цикле, а в С вне цикла, и при этом C и D получены из одного и того же вещества B дегидрогалогенированием, ясно, что это может быть осуществлено только в случае, если в В галоген и этильная группа находятся у одного и того же атома углерода, причём входящего в цикл. Поэтому не подходит структура 4.
Если бы соединением С являлись производные циклопропана 2 или 3, то соответствующие им углеводороды А (1-метил-3-этилциклобутан и 1-метил-2-этилциклобутан) при бромировании давали бы не один продукт, как в условии, а смесь продуктов.
Тогда исходным соединением B является соединение 1, 1-бром-1-этилциклопентан. Вся схема превращений выглядит следующим образом:

2) При обработке G этилатом натрия образуется 2-метилциклогекс-2-енон (см. схему выше).
3) Итак, имеется ввиду кислород. Человек, как аэроб, использует кислород для дыхания.
Процесс превращения кислорода в озон, например, используется в озонаторах, которые используются в антисептических и профилактических целях. Иногда озон применяется для очистки и обеззараживания питьевой воды.
Рекомендации к оцениванию:
| 1. | Правильно определены вещества А – Н: по 1 баллу (если вместо этилциклопентана предложен 1-метил-3-этилциклобутан, то за органические соединения: по 0,5 балла) | 8 баллов |
| 2. | Кислород и озон: по 0,5 балла | 1 балл |
| 3. | Приведена роль кислорода в организме | 0,5 балла |
| 4. | Приведено существующее использование процесса | 0,5 балла |
| ИТОГО: | 10 баллов | |
№ 6
1) Установим связь молярной массы с другими параметрами уравнения Вант-Гоффа и подставим все значения в систематических единицах измерения:


2) Подавляющее большинство ароматических соединений практически нерастворимы в воде. Значит, в составе X скорее всего есть –OH (17 г/моль) или –COOH (45 г/моль) группа. Взаимодействие с железом в соляной кислоте указывает на наличие –NO2 (46 г/моль) группы, которая восстанавливается в этих условиях. Молярная масса атомов углерода бензольного кольца 6∙12 = 72 г/моль. В случае наличия карбоксильной группы M(X) > 139 г/моль – не подходит. Остается единственный вариант – замещенный нитрофенол C6H4(OH)NO2, его молярная масса 139 г/моль:


3) В орто-нитрофеноле есть внутримолекулярная водородная связь между водородом OH-группы и кислородом NO2-группы за счет их близкого расположения, что невозможно в случае других изомеров. У них есть межмолекулярные водородные связи, которые способствуют увеличению температуры плавления по сравнению с орто-изомером:
Таким образом, X – орто-нитрофенол.
Рекомендации к оцениванию:
| 1. | Расчет молярной массы | 3 балла |
| 2. | Указание на наличие –OH и –NO2 групп: по 0,75 балла Каждый изомер: по 0,5 балла Уравнение реакции: 2 балла | 5 баллов |
| 3. | Указание на орто-изомер с объяснением | 2 балла |
| ИТОГО: | 10 баллов | |
№ 7
Отправные точки для решения задачи:
а) так как А и Б реагируют с бромом, то в них содержатся кратные связи;
б) так как В и Г не реагируют с бромом в темноте, то это могут быть ароматические углеводороды или алканы (циклоалканы);
в) катализатор платина используется в процессах гидрирования и дегидрирования, то есть, вероятно, одно из веществ подверглось дегидрированию с образованием ароматического соединения, а другое гидрированию с образованием алкана (циклоалкана). При этом в сосуде не образовалось водорода, то есть весь водород, который отщепился от одной молекулы полностью присоединился ко второй. Ароматическое соединение может образоваться при дегидрировании замещённого циклогексена или циклогексадиена.
г) так как А имеет тот же углеродный скелет, что и Б (реакция А с бромом с образованием Д и последующее дегидробромирование Д в Б), то становится понятно, что А и Б как раз и являются циклогексеном или циклогексадиеном с одинаковым углеродным скелетом.
д) так как А в присутствии серной кислоты реагирует с углеводородом В, то, вероятно, В –ароматическое соединение (а не мало реакционноспособный алкан) и происходит его алкилирование алкеном А.
е) продукт реакции А с В окисляется до соединения, содержащего 12 атомов углерода. Образование из И двух соединений, содержащих по 6 атомов углерода, как раз указывает на наличие как в Ж, таки в И двух фрагментов, содержащих по 6 атомов углерода (одно из них бензольное кольцо).
Тогда структуры соединений А – Ж выглядят следующим образом:

Циклогексилбензол Ж можно получить при восстановлении одного бензольного кольца в бифениле З (об оптической активности см. ниже):

Окисление соединения Ж происходит аналогично окислению кумола (через образование пероксида И):

2) Так как при алкилировании продукты реакции являются более активными нуклеофилами, чем исходные ароматические соединения, например бензол, то чтобы увеличить вероятность реакции алкилирующего агента именно с менее активным бензолом, он берётся в большом избытке. Если в избытке взять алкен, то основными продуктами реакции будут продукты ди- и триалкилирования:

3) Производные бифенила могут проявлять оптическую активность, если в орто-положениях в фенильных кольцах находятся объёмные заместители. За счёт того, что вращение относительно связи С-С, соединяющей бензольные кольца, в этом случае затруденено, такие соединения могут существовать в виде пары энантиомеров. Такие энантиомеры называются атропоизомерами:

Рекомендации к оцениванию:
| 1. | Структурные формулы веществ А, Б, В, Г, К, Л: по 0,5 балла | 3 балла | |
| 2. | Структурные формулы веществ Д, Е, Ж, З, И: по 1 баллу | 5 баллов | |
| 3. | Обоснование | 0,5 балла | |
| 4. | Объяснение избытка В, уравнение с избытком А: по 0,5 балла | 1 балл | |
| 5. | Пример атропоизомеров | 0,5 балла | |
| ИТОГО:
 Мы поможем в написании ваших работ! | |||
