Коэффициент полезного действия и холодильный коэффициент
Коэффициент полезного действия механизмов (КПД)
Если круговой процесс на диаграмме P-V протекает по часовой стрелке, то часть тепловой энергии, полученной от нагревателя, превращается в работу. Так работает тепловая машина.
Известно, что вечный двигатель невозможен. Это связано с тем, что для любого механизма справедливо утверждение: совершённая с помощью этого механизма полная работа (в том числе на нагревание механизма и окружающей среды, на преодоление силы трения) всегда больше полезной работы.
Например, больше половины работы двигателя внутреннего сгорания совершается впустую тратится на нагревание составных частей двигателя; некоторое количество теплоты уносят выхлопные газы. Часто необходимо оценивать эффективность механизма, целесообразность его использования. Поэтому, чтобы рассчитывать, какая часть от совершённой работы тратится впустую и какая часть с пользой, вводится специальная физическая величина, которая показывает эффективность механизма. Эта величина называется коэффициентом полезного действия механизма η = (А_полн /А_полезн) * 100 %,
Холодильный коэффициент.
Если круговой процесс на диаграмме P-V протекает против часовой стрелки, то тепловая энергия передается от холодильника (тела с меньшей температурой) к нагревателю (телу с большей температурой) за счет работы внешней силы. Так работает холодильная машина.
Холодильный коэффициент холодильной машины равен отношению тепловой энергии Q, отобранной от холодильника за цикл, к затраченной работе 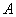 :
:
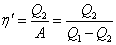
Цикл Карно. Коэффициент полезного действия идеальной тепловой машины. ТЕПЛОПЕРЕДАЧА И ПРЕОБРАЗОВАНИЕ ТЕПЛОТЫ В РАБОТУ. «ОБЕСЦЕНИВАНИЕ ТЕПЛОТЫ НАГРЕВАТЕЛЯ». ИДЕАЛЬНАЯ ТЕПЛОВАЯ МАШИНА И ПРОБЛЕМЫ ЭКОЛОГИИ.
Отсюда коэффициент полезного действия тепловой машины Карно равен
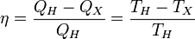
Цикл Карно состоит из четырёх стадий:
· Изотермическое расширение
· Адиабатическое расширение
· Изотермическое сжатие
· Адиабатическое сжатие
Рассмотрим теплообмен 2-х тел - изолированную систему: T1 > T2. Изменение энтропии равно.
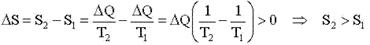
В изолированной системе возможны лишь процессы, ведущие к возрастанию энтропии.
Возрастание энтропии при теплообмене тел приводит к уменьшению доступности тепла для преобразования его в работу, т.е. обесцениванию тепловой энергии.
Из 1-го начала dQ = dU + dA
с учётом dS = dQ ⁄ T получаем dU = TdS – dA
Если вам нужно купить автохолодильник: тут ссылка.
Экологические проблемы использования тепловых машин. Мы живём в XXI веке, который невозможно представить без электростанций и автомобилей. Большая доля электростанций в мире – тепловые, то есть сжигающие топливо (уголь или газ). Автомобили, работающие на электричестве – редкость, все остальные сжигают топливо (бензин). При этом есть два губительных для окружающей среды обстоятельства.
Во-первых, выхлопные газы загрязняют атмосферу, делают её непригодной для нормальной жизнедеятельности человека. Во-вторых, выделяющееся тепло изменяет климат Земли и наносит непоправимый вред природе, животным и человеку. Поэтому задача человечества – переходить на более безопасные для окружающей среды двигатели.
Обратимые и необратимые процессы. Приведенная теплота. Направленность процесса теплопередачи. Приведенная теплота в термодинамических циклах. Неравенство Клаузиуса. Энтропия, как функция состояния. Второе начало термодинамики
Обратимый процесс – если процесс может быть проведен в обратном направлении с теми же промежуточными путями.
Приведенная теплота.
Отношение теплоты Q в изотермическом процессе к температуре, при которой происходила передача теплоты, называется приведенной теплотой.
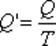
Для подсчета приведенной теплоты в произвольном процессе необходимо разбить этот процесс на бесконечно малые участки, где Т можно считать константой. Приведенная теплота на таком участке будет равна 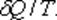 .
.
Направленность процесса
Теплота всегда самопроизвольно переходит только от более нагретых тел к менее нагретым, т. е. самопроизвольный или естественный процесс теплообмена обладает свойством определенной направленности — в сторону тел с более низкой температурой. При этом процесс теплообмена прекратится при достижении равенства температур.
для обратимого цикла Карно
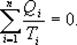
Так как любой замкнутый цикл можно представить как сумму бесконечного числа циклов Карно, то для любого замкнутого обратимого цикла выражение (9.26) будет справедливо и его можно записать в следующем виде
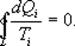
- Равенство Клаузиуса
Необратимый цикл Карно.В этом случае
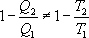
И все равенства превращаются в неравенства
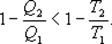 ;
; 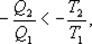 ;
; 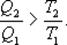 ;
; 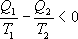 ;
; 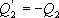 ;
;  ;
; 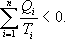 ;
;
Неравенство Клаузиуса 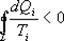
Таким образом, сумма приведенных теплот любого цикла равна нулю (обратимый процесс) или меньше нуля (необратимый процесс).
Энтропия
Функция состояния, полный дифференциал которой равен 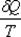 , называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
, называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
Энтропия S – это отношение полученной или отданной теплоты к температуре, при которой происходил этот процесс.
Для обратимых процессов изменение энтропии
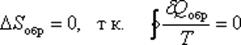
Это выражение называется равенство Клаузиуса.
В любом обратимом процессе изменения энтропии равно 0 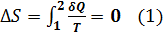 . В термодинамике доказывается, что S системы совершающей необратимой цикл возрастает
. В термодинамике доказывается, что S системы совершающей необратимой цикл возрастает 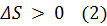 Выражения (1) и (2) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то её S может вести себя любым образом. Соотношения (1) и(2) можно представить в виде неравенства Клаузиуса ΔS ≥ 0 т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов).
Выражения (1) и (2) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то её S может вести себя любым образом. Соотношения (1) и(2) можно представить в виде неравенства Клаузиуса ΔS ≥ 0 т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов).
Второе начало термодинамики
Второе начало термодинамики, принцип, устанавливающий необратимость макроскопических процессов, протекающих с конечной скоростью.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Второе начало термодинамики, как и первое формулируется несколькими способами 1. Энтропия изолированной системы при протекании необратимого процесса может только возрастать dS≥0.2. Клаузиус сформулировал второе начало термодинамики следующим образом: Невозможны такие процессы, единственным конечным результатом которых был бы переход от тела менее нагретого к телу более нагретому. (Второе начало термодинамики не запрещает такой переход (например, такой переход происходит в холодильной машине)однако этот переход не является единственным результатом процесса, сопровождается изменениями в окружающих телах, связанных с совершением работы A') 3.Кельвну принадлежит еще одна формулировка второго начала термодинамики: Невозможны такие процессы, единственным конечным результатом которых являлось бы отнятие от некоторого тела определенного количества тепла и превращение этого тела полностью в работу. С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы.
Дата добавления: 2018-11-24; просмотров: 1367; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
