Окислительно-восстановительные реакции
Примеры заданий
Базовый уровень сложности
1. Окислительно-восстановительной является реакция, уравнение которой
| 1) | H2S + 2KOH = K2S + 2H2O |
| 2) | FeО+ 2HCl = FeCl2 + H2O |
| 3) | SO3 + СaO = CaSO4 |
| 4) | 2H2S + SO2 = 3S + 2H2O |
2. Процесс окисления отражен схемой
| 1) | SO3 → SO 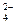
| 3) | S → SO 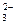
|
| 2) | SO 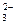 → SO2 → SO2
| 4) | SO 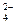 → S → S
|
3. Процесс восстановления отражен схемой
| 1) | NO  → NO → NO 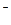
| 3) | NO2 → NO 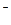
|
| 2) | NO 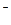 → N2О → N2О
| 4) | N2O3 → NO 
|
4. Процесс восстановления отражен схемой
| 1) | СO2 → СO 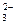
| 3) | СO2 → СО |
| 2) | СO 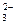 → СO2 → СO2
| 4) | СО → СО2 |
5. Pеакции, уравнение которой
SO2 + Cl2 +2H2O = H2SO4 + 2HCl,
соответствует схема изменения степени окисления серы
| 1) | S+2 → S+4 | 2) | S+4 → S+6 | 3) | S+4 → S+2 | 4) | S-2 → S+4 |
6. Схеме превращений
NO 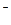 → NO2 → NO
→ NO2 → NO  → N2O
→ N2O
соответствует последовательность изменения степени окисления азота
| 1) | N+3 → N+2 → N+3 → N+1 | 3) | N+5 → N+3 → N+4 → N+2 |
| 2) | N+5 → N+4 → N+3 → N+1 | 4) | N+5 → N+3 → N+4 → N+1 |
7. Схеме превращений
SO2 → SO 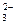 → SO
→ SO 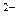 → H2S
→ H2S
соответствует последовательность изменения степени окисления серы
| 1) | S+4 → S+4 → S+6 → S+2 | 3) | S+4 → S+4 → S+6 → S-2 |
| 2) | S+6 → S+4 → S+6 → S-2 | 4) | S+6 → S+4 → S+4 → S+2 |
8. Последовательности изменения степени окисления серы
S+4 → S+4 → S-2 → S+6
соответствует схема превращений
| 1) | SO 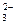 → SO3 → SO2 → SO → SO3 → SO2 → SO 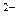
|
| 2) | SO2 → SO 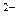 → H2S → SO3 → H2S → SO3
|
| 3) | SO 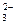 → SO → SO 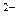 → H2S → SO3 → H2S → SO3
|
| 4) | SO 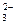 → SO2 → H2S → SO → SO2 → H2S → SO 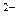
|
|
|
|
9. В схеме превращений
SO2  SO
SO 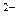
 S
S  SO
SO 
 H2S
H2S
сера проявляет восстановительные свойства на стадиях
| 1) | 1 и 2 | 2) | 1 и 3 | 3) | 3 и 4 | 4) | 2 и 4 |
10. В схеме превращений
NO2  NO
NO 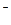
 N2
N2  NH3
NH3  NO
NO
азот проявляет окислительные свойства на стадиях
| 1) | 1 и 2 | 2) | 1 и 3 | 3) | 2 и 3 | 4) | 3 и 4 |
11. Только окислителем за счет атомов марганца может быть соединение, формула которого
| 1) | MnO2 | 2) | K2MnO4 | 3) | KMnO4 | 4) | Mn2O3 |
12. Только восстановителем за счет атомов азота может быть соединение, формула которого
| 1) | Ca3N2 | 2) | KNO2 | 3) | KNO3 | 4) | N2O3 |
13. Только восстановителем может быть
| 1) | C | 2) | N2 | 3) | Al | 4) | Si |
14. Окислительно-восстановительную двойственность за счет атомов азота может проявлять
| 1) | NH4Cl | 2) | KNO3 | 3) | N2O5 | 4) | НNO2 |
15. Окислительно-восстановительную двойственность за счет атомов серы может проявлять
| 1) | SO3 | 2) | H2SO3 | 3) | K2S | 4) | K2SO4 |
16. Восстановительные свойства углерод проявляет в реакции, уравнение которой
| 1) | Ca + 2C = CaC2 | 3) | С + 2Н2 = СН4 |
| 2) | 2С + SiO2 = Si + 2CO | 4) | 3С + 4Al = Al4C3 |
17. Окислительно-восстановительную двойственность сера проявляет в реакции, уравнение которой
| 1) | S + 6HNO3 = H2SO4 + 6NO2 + 2H2O |
| 2) | 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O |
| 3) | 2S + C = CS2 |
| 4) | S + 3F2 = SF6 |
|
|
|
18. Окислительные свойства SО2 проявляет в реакции, уравнение которой
| 1) | SO2 + 2KOH = K2SO3 + H2O |
| 2) | SO2 + NO2 = SO3 + NO |
| 3) | SO2 + C = S + CO2 |
| 4) | SO2 + CaO = CaSO3 |
19. В реакции цинка с концентрированной серной кислотой окислителем и восстановителем соответственно являются
| 1) | H+ и Zn0 | 2) | SO  и Zn0 и Zn0
| 3) | Zn0 и SO 
| 4) | Zn0 и H+ |
20. Оксид железа(II) проявляет восстановительные свойства при взаимодействии с
| 1) | соляной кислотой |
| 2) | разбавленной серной кислотой |
| 3) | концентрированной азотной кислотой |
| 4) | оксидом углерода(II) |
21. Оксид серы(IV) проявляет восстановительные свойства при взаимодействии с
| 1) | гидроксидом натрия |
| 2) | оксидом кальция |
| 3) | Сероводородом |
| 4) | перманганатом калия |
22. Схеме превращения Cr+2 → Cr+3 соответствует реакция, уравнение которой
| 1) | CrCl2 + 2NaOH = Cr(OH)2 + 2 NaOH |
| 2) | 4CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O |
| 3) | CrO + H2SO4 = CrSO4 + H2O |
| 4) | CrО + 2HCl = CrCl2 + H2O |
23. Схеме превращения S+6 → S+4 соответствует реакция, уравнение которой
| 1) | H2SO4 + 2NaOH = Na2SO4 + 2 H2O |
| 2) | 5H2SO4(конц) + 4Zn = 4ZnSO4 + H2S + 4H2O |
| 3) | 2H2SO4(конц) + Cu = CuSO4 + SO2 + 2H2O |
| 4) | Na2SO3 + 2HCl = 2NaCl + SO2 + H2O |
24. Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
|
|
|
| 1) | SO2 + H2S → S + H2O |
| 2) | S + H2SO4 → SO2 + H2O |
| 3) | S + H2SO4 → H2S + H2O |
| 4) | H2SO3 + H2S → S + H2O |
Повышенный уровень сложности
25. Установите соответствие между уравнением реакции и веществом-восстановителем, участвующим в данной реакции.
| УРАВНЕНИЕ РЕАКЦИИ | ВОССТАНОВИТЕЛЬ | ||||
| А) | 4NO2 + O2 + 2H2O = 4HNO3 | 1) | NO2 | ||
| Б) | SO2 + C = S + CO2 | 2) | SO2 | ||
| В) | SO2 + NO2 = SO3 + NO | 3) | O2 | ||
| Г) | SO2 + 2H2S = 3S + 2H2O | 4) | C | ||
|
| 5) | H2S | |||
| А | Б | В | Г | ||
|
|
| ||||
26. Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней.
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ | |||||
| А) | FeO + СО → Fe + СO2 | 1) Fe+2 → Fe0 2) Mn+7 → Mn+2 3) O- → O-2 4) N+3 → N+5 5) Cl+5 → Cl- 6) O- → O0 7) Fe+2 → Fe+3 | ||||
| Б) | FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O | |||||
| В) | H2O2 + KClO3 → KCl + H2O + O2 | |||||
| Г) | H2O2 + KNO2 → KNO3 + H2O | |||||
|
| ||||||
|
| ||||||
|
| ||||||
| А | Б | В | Г | |||
|
|
| |||||
Высокий уровень сложности
27. Используя метод электронного баланса, составьте уравнение реакции:
HNO3(конц) + … → HIO3 + NO2 + …
Определите окислитель и восстановитель.
|
|
|
28. Используя метод электронного баланса, составьте уравнение реакции:
HNO2 + KMnO4 + … → … + MnSO4 + K2SO4 + H2O
Определите окислитель и восстановитель.
29. Используя метод электронного баланса, составьте уравнение реакции:
HNO3(конц) + … → S + … + NaNO3 + H2O
Определите окислитель и восстановитель.
30. Используя метод электронного баланса, составьте уравнение реакции:
FeCl2 + KClO3 + … → FeCl3 + KCl + …
Определите окислитель и восстановитель.
31. Используя метод электронного баланса, составьте уравнение реакции:
… + PbO2 + HNO3 → Cl2 + Pb(NO3)2 + KNO3 + …
Определите окислитель и восстановитель.
32. Используя метод электронного баланса, составьте уравнение реакции:
… + KMnO4 + H2SO4 → Cl2 + … + Na2SO4 + K2SO4 + H2O
Определите окислитель и восстановитель.
33. Используя метод электронного баланса, составьте уравнение реакции:
… + MnO2+ H2SO4 → Cl2 + … + Na2SO4 + …
Определите окислитель и восстановитель.
34. Используя метод электронного баланса, составьте уравнение реакции:
FeCl2 + … + HCl → … + NO + H2O
Определите окислитель и восстановитель.
35. Используя метод электронного баланса, составьте уравнение реакции:
KI + … + H2SO4 → I2 + Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
36. Используя метод электронного баланса, составьте уравнение реакции:
… + MnO2 + H2SO4 → I2 + … + K2SO4 + H2O
Определите окислитель и восстановитель.
37. Используя метод электронного баланса, составьте уравнение реакции:
… + KMnO4 + H2SO4 → I2 + … + K2SO4 + H2O
Определите окислитель и восстановитель.
38. Используя метод электронного баланса, составьте уравнение реакции:
HBr + … → Br2 + MnBr2 + KBr + …
Определите окислитель и восстановитель.
39. Используя метод электронного баланса, составьте уравнение реакции:
SO2 + KMnO4 + … → H2SO4 + MnSO4 + …
Определите окислитель и восстановитель.
40. Используя метод электронного баланса, составьте уравнение реакции:
SO2 + … + HCl → H2SO4 + CrCl3 + KCl + …
Определите окислитель и восстановитель.
41. Используя метод электронного баланса, составьте уравнение реакции:
H2S + Cl2 + … → H2SO4 + …
Определите окислитель и восстановитель.
42. Используя метод электронного баланса, составьте уравнение реакции:
H2S + … → FeBr2 + S + …
Определите окислитель и восстановитель.
43. Используя метод электронного баланса, составьте уравнение реакции:
Na2S + K2Cr2O7 + … → S + Cr2(SO4)3 + … + …+ H2O
Определите окислитель и восстановитель.
44. Используя метод электронного баланса, составьте уравнение реакции:
H2SO4 + … → H2S + I2+ Na2SO4 + …
Определите окислитель и восстановитель.
45. Используя метод электронного баланса, составьте уравнение реакции:
H2SO4 + … → SO2 + Br2+ …
Определите окислитель и восстановитель.
46. Используя метод электронного баланса, составьте уравнение реакции:
… + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + …
Определите окислитель и восстановитель.
47. Используя метод электронного баланса, составьте уравнение реакции:
… + Br2 + H2SO4 → Fe2(SO4)3 + …
Определите окислитель и восстановитель.
48. Используя метод электронного баланса, составьте уравнение реакции:
FeSO4 + CrO3 + … → Fe2(SO4)3 + Cr2(SO4)3 + …
Определите окислитель и восстановитель.
49. Используя метод электронного баланса, составьте уравнение реакции:
FeCl2 + HNO2 + … → FeCl3 + N2 + Fe2(SO4)3 + …
Определите окислитель и восстановитель.
50. Используя метод электронного баланса, составьте уравнение реакции:
Na2SO3 + KClO3 + …→ Na2SO4 + Cl2 + … + H2O
Определите окислитель и восстановитель.
51. Используя метод электронного баланса, составьте уравнение реакции:
N2O + KMnO4 + … → NO2 + MnSO4+ … + …
Определите окислитель и восстановитель.
52. Используя метод электронного баланса, составьте уравнение реакции:
HNO3 + PCl3 + … → … + H3PO4+ HCl
Определите окислитель и восстановитель.
53. Используя метод электронного баланса, составьте уравнение реакции:
HNO3(конц) + … → … + Na2SO4 + H2O
Определите окислитель и восстановитель.
Вариант 1
1. Процесс окисления отражен схемой
| 1) | NO2 → NO 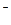
| 3) | NO2 → NO 
|
| 2) | NO 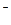 → N2 → N2
| 4) | NO 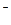 → N2O5 → N2O5
|
2. Схеме превращений
SO3 → SO 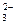 → SO
→ SO 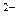 → H2S
→ H2S
соответствует последовательность изменения степени окисления серы
| 1) | S+4 → S+4 → S+6 → S+2 | 3) | S+6 → S+4 → S+4 → S+2 |
| 2) | S+6 → S+4 → S+6 → S-2 | 4) | S+4 → S+4 → S+6 → S-2 |
3. В схеме превращений
Cr(OH)3  CrO
CrO 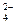
 Cr2O
Cr2O 
 Cr3+
Cr3+  Cr
Cr
хром проявляет окислительные свойства на стадиях
| 1) | 1 и 3 | 2) | 2 и 3 | 3) | 2 и 4 | 4) | 3 и 4 |
4. Только окислительные свойства за счет атомов серы может проявлять
| 1) | сера | 3) | сероводород |
| 2) | серная кислота | 4) | сернистый газ |
5. Окислительно-восстановительную двойственность за счет атомов марганца может проявлять
| 1) | КMnO4 | 2) | Mn2O7 | 3) | MnO2 | 4) | Mn |
6. Окислительно-восстановительную двойственность хлор проявляет в реакции, уравнение которой
| 1) | Cl2 + 2KBr = 2KCl + Br2 |
| 2) | Cl2 + CH4 = CH3Cl + HCl |
| 3) | Cl2 + H2O = HCl + HclO |
| 4) | 3Cl2 + 2Fe = 2FeCl3 |
7. В реакции цинка с концентрированной азотной кислотой окислителем и восстановителем соответственно являются
| 1) | Н+ и Zn0 | 2) | Zn0 и NO 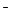
| 3) | NO 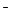 и Zn0 и Zn0
| 4) | Zn0 и H+ |
8. Схеме превращения N+5 → N+4 соответствует реакция, уравнение которой
| 1) | HNO3 + NaOH = NaNO3 + H2O |
| 2) | 8HNO3(разб) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O |
| 3) | 2KNO3 = 2KNO2 + O2 |
| 4) | 2HNO3(конц) + Ag = AgNO3 + NO2 + H2O |
9. Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
| 1) | HNO2 + KMnO4 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O |
| 2) | KMnO4 + NaNO3 + H2SO4 → MnSO4 + NaNO2 + K2SO4 + H2O |
| 3) | KMnO4 + SO2 + H2O → MnSO4 + H2SO4 + K2SO4 |
| 4) | KMnO4 + HBr → Br2 + MnBr2 + KBr + H2O |
10. Установите соответствие между уравнением реакции и веществом-окислителем, участвующим в данной реакции.
| УРАВНЕНИЕ РЕАКЦИИ | ОКИСЛИТЕЛЬ | ||||
| А) | CO + 2H2 = CH3OH | 1) | H2 | ||
| Б) | 2CO + O2 = 2CO2 | 2) | CO | ||
| В) | C + 2H2 = CH4 | 3) | O2 | ||
| Г) | FeO + C = Fe + CO | 4) | C | ||
|
| 5) | FeO | |||
| А | Б | В | Г | ||
|
|
| ||||
11. Используя метод электронного баланса, составьте уравнение реакции:
SO2 + K2Cr2O7 + … → Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
Вариант 2
1. Процесс восстановления отражен схемой
| 1) | Сr2O3 → СrO 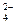
| 3) | Сr2O  → СrO → СrO 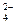
|
| 2) | СrO 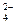 → Сr2O → Сr2O 
| 4) | Сr2O  → Сr3+ → Сr3+
|
2. Последовательности изменения степени окисления азота
N+4 → N+5 → N0 →N-3
соответствует схема превращений
| 1) | NO2 → NO 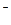 → N2 → NH3 → N2 → NH3
|
| 2) | NO2 → NO 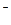 → N2 → N2О3 → N2 → N2О3
|
| 3) | NO  → NO → NO 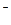 → N2 → NH3 → N2 → NH3
|
| 4) | NO  → NO → NO 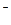 → N2 → N2О3 → N2 → N2О3
|
3. В схеме превращений
MnO2  Mn2+
Mn2+  MnO2
MnO2  MnO
MnO 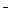
 MnO
MnO 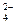
марганец проявляет восстановительные свойства на стадиях
| 1) | 1 и 4 | 2) | 2 и 3 | 3) | 2 и 4 | 4) | 3 и 4 |
4. Только восстановительные свойства за счет атомов серы может проявлять
| 1) | сернистая кислота | 3) | серная кислота |
| 2) | сероводород | 4) | сернистый газ |
5. Окислительно-восстановительную двойственность за счет атомов хрома может проявлять
| 1) | K2CrO4 | 2) | K2Cr2O7 | 3) | Cr(OH)3 | 4) | CrO3 |
6. Окислительные свойства СО2 проявляет в реакции, уравнение которой
| 1) | СO2 + 2NaOH = Na2CO3 + H2O |
| 2) | СO2 + 2Mg = C + 2MgO |
| 3) | СO2 + MgO = MgCO3 |
| 4) | СO2 + H2O + CaCO3 = Ca(HCO3)2 |
7. В реакции цинка с разбавленной серной кислотой окислителем и восстановителем соответственно являются
| 1) | Zn0 и SO 
| 2) | H+ и Zn0 | 3) | SO 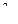 и Zn0 и Zn0
| 4) | Zn0 и Н+ |
8. Схеме превращения Fe+3 → Fe+2 соответствует реакция, уравнение которой
| 1) | FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl |
| 2) | 2FeCl3 + H2S = 2FeCl2 + S + 2HCl |
| 3) | 2Fe(OH)3 = Fe2O3 + 3H2O |
| 4) | Fe3O4 + 4H2 = 3Fe + 4H2O |
9. Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
| 1) | SO2 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O |
| 2) | NaI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O |
| 3) | K2Cr2O7 + Fe + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O |
| 4) | KI + K2Cr2O7 + H2SO4 → I2 + К2CrO4 + K2SO4 + H2O |
10. Установите соответствие между схемой реакции и изменением степени окисления восстановителя в ней.
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ | ||||
| А) | NH3 + Na → NaNH2 + H2 | 1) | N-3 → N0 | ||
| Б) | NH3 + CuO → N2 + Cu + H2O | 2) | H+ → H0 | ||
| В) | NF3 + H2 → N2 + HF | 3) | N+3 → N0 | ||
| Г) | Na + H2 → NaH | 4) | H0 → H- | ||
|
| 5) | H0 → H+ | |||
|
| 6) | Na0 → Na+ | |||
| А | Б | В | Г | ||
|
|
| ||||
11. Используя метод электронного баланса, составьте уравнение реакции:
MnSO4 + PbO2 + … → HMnO4 + PbSO4 + …
Определите окислитель и восстановитель.
Электролиз
Примеры заданий
Базовый уровень сложности
1. При электролизе водного раствора сульфата меди(II) с инертными электродами на катоде выделяется
| 1) | медь | 3) | кислород |
| 2) | водород | 4) | оксид серы(IV) |
2. При электролизе водного раствора нитрата серебра с инертными электродами на аноде выделяется
| 1) | серебро | 3) | кислород |
| 2) | водород | 4) | оксид азота(IV) |
3. При электролизе водного раствора сульфата марганца(II) с инертными электродами на катоде выделяется (выделяются)
| 1) | jксид серы (IV) | 3) | кислород |
| 2) | марганец и водород | 4) | марганец и кислород |
4. При электролизе водного раствора сульфата натрия с инертными электродами на катоде выделяется (выделяются)
| 1) | натрий | 3) | кислород |
| 2) | натрий и водород | 4) | водород |
5. Кислород выделяется на аноде при электролизе с инертными электродами водного раствора
| 1) | хлорида натрия | 3) | йодида натрия |
| 2) | бромида натрия | 4) | фторида натрия |
6. Водород и металл могут выделяться на катоде одновременно при электролизе с инертными электродами водного раствора
| 1) | нитрата кальция | 3) | нитрата хрома(III) |
| 2) | нитрата серебра | 4) | нитрата меди(II) |
7.При электролизе водного раствора хлорида натрия с инертными электродами на катоде и аноде соответственно выделяются
| 1) | натрий и хлор | 3) | водород и кислород |
| 2) | водород и хлор | 4) | натрий и кислород |
8. При электролизе водного раствора хлорида меди(II) с инертными электродами на катоде и аноде соответственно выделяются
| 1) | водород и хлор | 3) | медь и кислород |
| 2) | водород и кислород | 4) | медь и хлор |
9. Только газообразные продукты выделяются на катоде и аноде при электролизе с инертными электродами водного раствора
| 1) | CuCl2 | 3) | ZnSO4 |
| 2) | NaI | 4) | LiNO3 |
10. Электролиз водного раствора соли можно использовать для получения
| 1) | кальция | 2) | бария | 3) | цинка | 4) | лития |
Повышенный уровень сложности
11. Водород и металл могут выделяться на катоде одновременно при электролизе с инертными электродами водного раствора
| 1) | сульфата калия | 4) | сульфата железа(II) |
| 2) | нитрата серебра | 5) | нитрата меди(II) |
| 3) | нитрата цинка | 6) | нитрата марганца(II) |
12. Кислород выделяется на аноде при электролизе с инертными электродами водного раствора
| 1) | нитрата лития | 4) | бромида хрома(II) |
| 2) | хлорида меди(II) | 5) | фторида натрия |
| 3) | сульфата железа(II) | 6) | йодида бария |
13. Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА КАТОДЕ | |||||
| А) | NaI | 1) | металл | |||
| Б) | AgNO3 | 2) | водород | |||
| В) | ZnSO4 | 3) | oкcид азота(IV) | |||
| Г) | NiBr2 | 4) | металл, водород | |||
|
| 5) | галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
14. Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА КАТОДЕ | |||||
| А) | CuSO4 | 1) | металл | |||
| Б) | FeCl2 | 2) | водород | |||
| В) | MnSO4 | 3) | oкcид серы(IV) | |||
| Г) | CrCl2 | 4) | металл, водород | |||
|
| 5) | галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
15. Установите соответствие между формулой соли и продуктом, образующимся на аноде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТ НА АНОДЕ | |||||
| А) | NaF | 1) | O2 | |||
| Б) | Mn(NO3)2 | 2) | H2 | |||
| В) | NiCl2 | 3) | SO2 | |||
| Г) | Na2SO4 | 4) | NO2 | |||
|
| 5) | F2 | ||||
|
| 6) | Cl2 | ||||
| А | Б | В | Г | |||
|
|
| |||||
16. Установите соответствие между формулой соли и продуктами, образующимися на аноде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА АНОДЕ | |||||
| А) | Mn(NO3)2 | 1) | кислород | |||
| Б) | CH3COOK | 2) | метан | |||
| В) | AlBr3 | 3) | этан, оксид углерода(IV) | |||
| Г) | Cr2(SO4)3 | 4) | oкcид азота(IV) | |||
|
| 5) | галоген | ||||
|
| 6) | oкcид серы(IV) | ||||
| А | Б | В | Г | |||
|
|
| |||||
17. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА | |||||
| А) | CsOH | 1) | металл, галоген | |||
| Б) | NiSO4 | 2) | металл, кислород | |||
| В) | CaBr2 | 3) | водород, галоген | |||
| Г) | NaI | 4) | водород, кислород | |||
|
| 5) | металл, водород, кислород | ||||
|
| 6) | металл, водород, галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
18. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА | |||||
| А) | Hg(NO3)2 | 1) | металл, галоген | |||
| Б) | CuSO4 | 2) | металл, кислород | |||
| В) | FeSO4 | 3) | водород, галоген | |||
| Г) | LiOH | 4) | водород, кислород | |||
|
| 5) | металл, водород, кислород | ||||
|
| 6) | металл, водород, галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
19. При электролизе водного раствора нитрата серебра с инертными электродами на катоде выделилось 10,8 г металла. Объем газа, выделившегося на аноде, равен при нормальных условиях ________ л. (Запишите число с точностью до сотых.)
20. При электролизе водного раствора хлорида меди(II) с инертными электродами на катоде выделилось 12,8 г металла. Объем газа, выделившегося на аноде, равен при нормальных условиях ________ л. (Запишите число с точностью до сотых.)
35. 21. При электролизе водного раствора нитрата калия с инертными электродами на аноде выделилось 25 л (н.у.) газа. Объем газа, выделившегося на катоде, равен при нормальных условиях ________ л. (Запишите число с точностью до целых.)
22. При электролизе водного раствора бромида калия с инертными электродами на катоде выделилось 8,96 л (н.у.) газа. Масса брома, выделившегося на аноде, равна ________ г. (Запишите число с точностью до целых.)
37. 23. При электролизе водного раствора нитрата ртути(II) с инертными электродами на аноде выделилось 2,24 л (н.у.) газа. Масса металла, выделившегося на катоде, равна ________ г. (Запишите число с точностью до десятых.)
Вариант 1
1. При электролизе водного раствора нитрата калия с инертными электродами на катоде выделяется (выделяются)
| 1) | калий | 3) | кислород |
| 2) | калий и водород | 4) | водород |
2. Кислород выделяется на аноде при электролизе с инертными электродами водного раствора
| 1) | хлорида меди(II) | 3) | бромида цинка |
| 2) | алюмокалиевых квасцов | 4) | сульфида натрия |
3. При электролизе водного раствора сульфида калия с инертными электродами на катоде и аноде соответственно выделяются
| 1) | водород и сера | 3) | водород и кислород |
| 2) | калий и кислород | 4) | водород и оксид серы(IV) |
4. Только газообразные продукты выделяются на катоде и аноде при электролизе с инертными электродами водного раствора
| 1) | MnCl2 | 3) | Cr2(SO4)3 |
| 2) | KCl | 4) | Cu(NO3)2 |
5. Водород и металл могут выделяться на катоде одновременно при электролизе с инертными электродами водного раствора
| 1) | сульфата калия | 4) | хлорида хрома(II) |
| 2) | нитрата ртути(II) | 5) | нитрата никеля(II) |
| 3) | сульфата железа(II) | 6) | бромида бария |
6. Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА КАТОДЕ | |||||
| А) | CH3COONa | 1) | металл | |||
| Б) | Cu(NO3)2 | 2) | водород | |||
| В) | K2SO4 | 3) | oкcид серы(IV) | |||
| Г) | AlCl3 | 4) | металл, водород | |||
|
| 5) | галоген | ||||
|
| 6) | oкcид азота(IV) | ||||
| А | Б | В | Г | |||
|
|
| |||||
7. Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА | |||||
| А) | KСl | 1) | металл, галоген | |||
| Б) | CuCl2 | 2) | металл, кислород | |||
| В) | КF | 3) | водород, галоген | |||
| Г) | ZnBr2 | 4) | водород, кислород | |||
|
| 5) | металл, водород, кислород | ||||
|
| 6) | металл, водород, галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
8. При электролизе водного раствора нитрата меди(II) с инертными электродами на аноде выделилось 11,2 л (н.у.) газа. Масса кислоты, образовавшейся в электролизере, равна ________ г. (Запишите число с точностью до целых.)
Вариант 2
1. При электролизе водного раствора нитрата цинка с инертными электродами на катоде выделяется (выделяются)
| 1) | оксид азота(IV) | 3) | кислород |
| 2) | цинк и водород | 4) | цинк и кислород |
2. Водород выделяется на катоде при электролизе с инертными электродами водного раствора
| 1) | нитрата калия | 3) | нитрата меди(II) |
| 2) | нитрата серебра | 4) | нитрата ртути(II) |
3. При электролизе водного раствора фторида калия с инертными электродами на катоде и аноде соответственно выделяются
| 1) | водород и фтор | 3) | водород и кислород |
| 2) | калий и кислород | 4) | калий и фтор |
4. Электролиз водного раствора соли нельзяиспользовать для получения
| 1) | магния | 2) | меди | 3) | цинка | 4) | хрома |
5. Кислород не выделяется на аноде при электролизе с инертными электродами водного раствора
| 1) | сульфида лития | 4) | хлорида хрома(III) |
| 2) | сульфата цинка | 5) | фторида калия |
| 3) | нитрата никеля(II) | 6) | бромида кальция |
6. Установите соответствие между формулой соли и продуктом, образующимся на аноде при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТ НА АНОДЕ | |||||
| А) | К3РO4 | 1) | кислород | |||
| Б) | FeCl3 | 2) | oкcид фосфора(V) | |||
| В) | NiSO4 | 3) | oкcид серы(IV) | |||
| Г) | CrBr3 | 4) | водород | |||
|
| 5) | галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
7. Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе с инертными электродами ее водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА | |||||
| А) | Na2SO4 | 1) | металл, галоген | |||
| Б) | KNO3 | 2) | металл, кислород | |||
| В) | AgNO3 | 3) | водород, галоген | |||
| Г) | MnSO4 | 4) | водород, кислород | |||
|
| 5) | металл, водород, кислород | ||||
|
| 6) | металл, водород, галоген | ||||
| А | Б | В | Г | |||
|
|
| |||||
8. При электролизе водного раствора хлорида калия на катоде выделилось 2,24 л (н.у.) газа. Масса щелочи, образовавшейся в электролизере, равна ________ г. (Запишите число с точностью до десятых.)
Неорганическая химия
Дата добавления: 2018-11-24; просмотров: 2620; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
