Характерные химические свойства оксидов металлов и соответствующих им гидроксидов
Примеры заданий
Базовый уровень сложности
1. Основные свойства проявляет оксид
| 1) | PbO2 | 2) | Cu2O | 3) | MnO2 | 4) | Cr2O3 |
2. Амфотерные свойства проявляет оксид
| 1) | СаO | 2) | Cu2O | 3) | СrO3 | 4) | Cr2O3 |
3. Кислотные свойства проявляет оксид
| 1) | MnO | 2) | Mn2O7 | 3) | СrO | 4) | Cr2O3 |
4. Основные свойства проявляет гидроксид
| 1) | марганца(II) | 3) | марганца(IV) |
| 2) | бериллия | 4) | хрома(III) |
5. Амфотерные свойства проявляет гидроксид
| 1) | хрома(III) | 3) | бария |
| 2) | хрома(VI) | 4) | марганца(VII) |
6. К щелочам относится
| 1) | Mn(OH)2 | 2) | Cr(OH)2 | 3) | Ba(OH)2 | 4) | Fe(OH)2 |
7. Основные свойства гидроксидов увеличиваются в ряду
| 1) | Mg(OH)2 – Ca(OH)2 – Zn(OH)2 |
| 2) | Mg(OН)2 – Ca(OН)2 – КOН |
| 3) | Al(OH)3 – Mg(OH)2 – Be(OH)2 |
| 4) | Sr(OH)2 – Ca(OН)2 – Mg(OH)2 |
8. Вода реагирует с каждым из оксидов, содержащихся в паре
| 1) | Na2O и MnO | 3) | Al2O3 и CaO |
| 2) | BeO и ZnO | 4) | K2O и SrO |
9. С образованием щелочи с водой взаимодействует
| 1) | MgO | 2) | CrO3 | 3) | BaO | 4) | Mn2O7 |
10. Cерная кислота реагирует с каждым из оксидов, содержащихся в паре
| 1) | Mn2O7 и MnO | 3) | Cr2O3 и CaO |
| 2) | MgO и CrO3 | 4) | CrO3 и V2O5 |
11. Гидроксид натрия реагирует с каждым из оксидов, содержащихся в паре
| 1) | СаО и MnO | 3) | Cr2O3 и FeO |
| 2) | Mn2O7 и ВаO | 4) | CrO3 и ZnO |
12. И оксид цинка, и оксид натрия реагируют с
| 1) | водой | 3) | сульфатом калия |
| 2) | гидроксидом кальция | 4) | соляной кислотой |
|
|
|
13. И оксид алюминия, и гидроксид калия реагируют с
| 1) | азотной кислотой | 3) | нитратом кальция |
| 2) | оксидом магния | 4) | водой |
14. И оксид хрома(III), и оксид хрома(VI) реагируют с
| 1) | сульфатом магния | 3) | водой |
| 2) | гидроксидом натрия | 4) | серной кислотой |
15. И гидроксид натрия, и гидроксид алюминия реагируют с
| 1) | фосфатом натрия | 3) | гидроксидом стронция |
| 2) | оксидом калия | 4) | азотной кислотой |
16. Реакция возможна между
| 1) | MgO и Ca(OH)2 | 3) | CaO и HCl |
| 2) | CrO3 и HNO3 | 4) | BaO и Na2O |
17. Кислотные свойства гидроксид алюминия проявляет в реакции
| 1) | 2Аl(OH)3 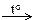 Al2O3 + 3H2O Al2O3 + 3H2O
|
| 2) | Аl(OH)3 + 3HCl = AlCl3 + 3H2O |
| 3) | Al(OH)3 + KOH = K[Al(OH)4] |
| 4) | 2Аl(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O |
187. Основные свойства оксид алюминия проявляет в реакции
| 1) | Al2O3 + 6HСl = 2AlCl3 + 3H2O |
| 2) | Al2O3 + Na2CO3 = 2NaAlO2 + CO2 |
| 3) | Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] |
| 4) | 2Al2O3  4Al + 3O2 4Al + 3O2
|
Повышенный уровень сложности
19. Оксид кальция реагирует с
| 1) | гидроксидом натрия | 4) | соляной кислотой |
| 2) | оксидом бария | 5) | углекислым газом |
| 3) | водой | 6) | хлоридом натрия |
20. Оксид хрома(III) реагирует с
| 1) | хлоридом калия | 4) | азотной кислотой |
| 2) | гидроксидом бария | 5) | алюминием |
| 3) | водой | 6) | сульфатом натрия |
|
|
|
21. Оксид железа(II) реагирует с
| 1) | оксидом кальция | 4) | углеродом |
| 2) | водой | 5) | водородом |
| 3) | серной кислотой | 6) | гидроксидом натрия |
22. Оксид лития реагирует с
| 1) | оксидом серы(VI) | 4) | гидроксидом натрия |
| 2) | водой | 5) | оксидом стронция |
| 3) | соляной кислотой | 6) | нитратом натрия |
23. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Zn + H2O → | 1) | ZnO + H2 | |||
| Б) | Zn + KOH + H2O → | 2) | Zn(OH)2 + H2 | |||
| В) | ZnO + KOH | 3) 4) 5) 6) | Zn(NO3)2 + NH4NO3 + H2O Zn(NO3)2 + NO2 + H2O K2ZnO2 + H2О K2[Zn(OH)4] + H2 | |||
| Г) | Zn + HNO3(конц.) → | |||||
|
| ||||||
|
| ||||||
| А | Б | В | Г | |||
|
|
|
| ||||
24. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Al + KOH + H2O → | 1) | K[Al(OH)4] | |||
| Б) | Al + HNO3(конц.) | 2) | K[Al(OH)4] + H2 | |||
| В) | KOH(р-р) + Al(OH)3 → | 3) | Al(NO3)3 + H2 | |||
| Г) | KOH + Al2O3 | 4) 5) 6) | Al(NO3)3 + NO2 + H2O KAlO2 + H2 KAlO2 + H2O | |||
|
| ||||||
|
| ||||||
| А | Б | В | Г | |||
|
|
|
| ||||
25. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
|
|
|
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Ca + H2O → | 1) | CaO + H2 | |||
| Б) | Ca + HNO3(конц.) → | 2) | Са(OH)2 + H2 | |||
| В) | CaO + HNO3 → | 3) | Са(OH)2 + H2O | |||
| Г) | Ca(OH)2 + HNO3 → | 4) | Ca(NO3)2 + H2 | |||
|
| 5) | Ca(NO3)2 + H2O | ||||
|
| 6) | Ca(NO3)2 + N2O + H2O | ||||
| А | Б | В | Г | |||
|
|
|
| ||||
26. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Mg + H2SO4(разб.) → | 1) | MgSO4 + H2 | |||
| Б) | Mg + H2SO4(конц.) → | 2) | MgSO4 + H2O | |||
| В) | MgO + HNO3 → | 3) | MgSO4 + SO2 + H2O | |||
| Г) | Mg(OH)2 + HNO3 → | 4) | Mg(NO3)2 + H2O | |||
|
| 5) | Mg(NO3)2 + NO2 + H2O | ||||
|
| 6) | Mg(NO3)2 + H2 | ||||
| А | Б | В | Г | |||
|
|
|
| ||||
27. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | CuO + H2SO4 → | 1) | СuSO4 + H2 | |||
| Б) | Cu + H2SO4(конц.) → | 2) | СuSO4 + H2O | |||
| В) | Cu + HNO3(разб.) → | 3) | CuSO4 + SO2 + H2O | |||
| Г) | Cu(OH)2 + HNO3 → | 4) | Cu(NO3)2 + H2 | |||
|
| 5) | CuNO3)2 + NO + H2O | ||||
|
| 6) | Cu(NO3)2 + H2O | ||||
| А | Б | В | Г | |||
|
|
|
| ||||
|
|
|
28. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | MgO + H2SO4 → MgSO4 + … | 1) | H2 | ||||
| Б) | Ag + H2SO4(конц.) → Ag2SO4 + … + H2O | 2) | H2O | ||||
| В) | Fe + HNO3(разб.) → Fe(NO3)3 + … + H2O | 3) | SO2 | ||||
| Г) | Fe(OH)3 + HNO3 → Fe(NO3)3 + … | 4) | H2S | ||||
|
| 5) | NO2 | |||||
|
| 6) | NO | |||||
| А | Б | В | Г | ||||
|
|
|
| |||||
29. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | MgO + HCl → MgCl2 + … | 1) | H2SO4(конц.) | ||||
| Б) | Ag + … → Ag2SO4 + SO2 + H2O | 2) | H2SO4(разб.) | ||||
| В) | Cu + … → Cu(NO3)2 + NO + H2O | 3) | HNO3(конц.) | ||||
| Г) | Cu(OH)2 + HNO3 → Cu(NO3)2 + … | 4) | HNO3(разб.) | ||||
|
| 5) | H2 | |||||
|
| 6) | H2O | |||||
| А | Б | В | Г | ||||
|
|
|
| |||||
30. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | FeO + … → FeSO4 + H2O | 1) | H2SO4(конц.) | ||||
| Б) | FeO + HNO3(конц.) → … + NO2 + H2O | 2) | H2SO4(разб.) | ||||
| В) | Fe + … | 3) | Fe(NO3)2 | ||||
| Г) | Fe + … | 4) | Fe(NO3)3 | ||||
|
| 5) | HNO3(конц.) | |||||
|
| 6) | HNO3(разб.) | |||||
| А | Б | В | Г | ||||
|
|
|
| |||||
31. Определите объем 20%-ного раствора соляной кислоты (плотность 1,098 г/мл), необходимый для полного растворения оксида магния массой 4,0 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
32. Определите объем 14%-ного раствора азотной кислоты (плотность 1,078 г/мл), необходимый для полного растворения оксида меди(II) массой 1,6 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
33. Определите объем 12%-ного раствора гидроксида натрия (плотность 1,131 г/мл), необходимый для полной нейтрализации серной кислоты массой 4,9 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
34. Определите объем 8%-ного раствора гидроксида калия (плотность 1,069 г/мл), необходимый для полной нейтрализации уксусной кислоты массой 18 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
35. К 20,00 г 16%-ного раствора cульфата меди(II) прилили 40,00 г 10%-ого раствора гидроксида натрия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
36. К 25,00 г 15,2%-ного раствора cульфата железа(II) прилили 30,00 г 11,2%-ого раствора гидроксида калия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
37. К 30,00 г 16,25%-ного раствора хлорида железа(III) прилили 50,00 г 12%-ого раствора гидроксида натрия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
38. К 9,5 г 20,0%-ного раствора хлорида магния прилили 20,0 г 22,4%-ого раствора гидроксида калия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
39. Максимальный объем (н.у.) углекислого газа, который может быть полностью поглощен известковой водой массой 530 г с массовой долей Са(ОН)2 0,14%, равен _________ л. (Запишите число с точностью до тысячных.)
40. Минимальный объем 16%-ного раствора гидроксида натрия (плотность 1,18 г/мл), который необходим для поглощения углекислого газа объемом 4,48 л (н.у.), равен _________ мл. (Запишите число с точностью до десятых.)
Высокий уровень сложности
41. Углекислый газ, полученный в результате полного сгорания 0,448 л (н.у.) этилена, пропустили через раствор гидроксида калия объемом 165,9 мл с массовой долей КОН 4,20% (плотность 1,045 г/мл). Определите массовые доли веществ в полученном растворе.
42. К 30%-ному раствору серной кислоты объемом 20 мл (плотность 1,219 г/мл) осторожно прилили 18,25%-ный раствор гидроксида натрия (плотность 1,200 г/мл) до полной нейтрализации кислоты. Определите объем прилитого раствора щелочи. Какой объем воды надо прибавить к полученному раствору, чтобы массовая доля соли в нем стала равна 10%?
43. К 8,3%-ному раствору серной кислоты объемом 45,0 мл (плотность 1,05 г/мл) осторожно прилили 10,0%-ный раствор гидроксида калия (плотность 1,092 г/мл) до полной нейтрализации кислоты. Определите объем прилитого раствора щелочи. Сколько граммов сульфата калия надо добавить к полученному раствору, чтобы массовая доля соли в нем стала равна 10,0%?
44. Углекислый газ, выделившийся в результате взаимодействия 30 г карбоната кальция с избытком азотной кислоты, пропустили через 230,8 мл 11,03%-ного раствора КОН (плотность 1,10 г/мл). Определите массовые доли солей в полученном растворе.
45. Сероводород, выделившийся в результате взаимодействия 4,4 г сульфида железа(II) с избытком соляной кислоты, пропустили через 28,54 мл 10,1%-ный раствор гидроксида натрия (плотность 1,11 г/мл). Определите массовые доли солей в полученном растворе.
46. К 145,1 мл 16%-ного раствора хлорида алюминия (плотность 1,15 г/мл) прилили 292,3мл 12,08%-ного раствора гидроксида калия (плотность 1,11 г/мл). Определите массовые доли солей в растворе над полученным осадком.
Вариант 1
1. Основные свойства оксидов увеличиваются в ряду
| 1) | K2O – Rb2O – Ag2O | 3) | MgO – CaO – K2O |
| 2) | BeO – MgO – Al2O3 | 4) | SrO – CaO – MgO |
2. Оксид кальция реагирует с каждым из трех веществ, содержащихся в группе
| 1) | MgО, Zn(OH)2, HCl | 3) | CO2, Fe2O3, Ba(OH)2 |
| 2) | H2O, HNO3, SO3 | 4) | Cr2O3, NaOH, H2SO4 |
3. Реакция возможна между
| 1) | Ca(OH)2 и Na3PO4 | 3) | Mg(OH)2 и KNO3 |
| 2) | NaOH и Cs2O | 4) | Sr(OH)2 и NaOH |
4. Какие из приведенных утверждений о металлах и свойствах образованных ими оксидов верны?
А. Металлы способны к образованию только основных оксидов.
Б. Все основные оксиды взаимодействуют с водой с образованием щелочей.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. И оксид бария, и оксид алюминия реагируют с
| 1) | NaOH | 4) | H2O |
| 2) | HCl | 5) | CaO |
| 3) | SO3 | 6) | HNO3 |
6. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | NaOH + ZnO | 1) | Zn(OH)2 + Na2O | |||
| Б) | NaOH(избыток) + ZnCl2 → | 2) | Na2[Zn(OH)4] + NaCl | |||
| В) | NaOH(избыток) + CO2 → | 3) | Na2ZnO2 + H2O | |||
| Г) | NaOH + CO2(избыток) → | 4) | Zn(OH)2 + NaCl | |||
|
| 5) | Na2CO3 + H2O | ||||
|
| 6) | NaHCO3 | ||||
| А | Б | В | Г | |||
|
|
|
| ||||
7. Максимальный объем (н.у.) сернистого газа, который может быть полностью поглощен раствором гидроксида натрия массой 100 г с массовой долей NaOH 10%, равен _________ л. (Запишите число с точностью до десятых.)
8. Натрий массой 4,6 г полностью растворили в 80 мл воды. К полученному раствору щелочи прилили 86 мл 20%-ного раствора серной кислоты (плотность 1,14 г/мл). Определите массовую долю соли в полученном растворе.
Вариант 2
1. Кислотные свойства проявляет гидроксид
| 1) | хрома(II) | 3) | марганца(IV) |
| 2) | хрома(VI) | 4) | марганца(II) |
2. Оксид лития реагирует с каждым из трех веществ, содержащихся в группе
| 1) | Mg(ОH)2, CO2, HClO4 | 3) | SO2, CrO3, H2SO4 |
| 2) | H2O, KNO3, MnO | 4) | ZnO, Ca(OH)2, BaO |
3. Реакция невозможна между
| 1) | Ва(OH)2 и CaO | 3) | MgO и HBr |
| 2) | NaOH и HNO3 | 4) | Ca(OH)2 и CO2 |
4. Какие из приведенных утверждений о свойствах оксидов и гидроксидов верны?
А. Все оксиды, образованные металлами II группы периодической таблицы Д.И. Менделеева, проявляют только основные свойства.
Б. Амфотерные оксиды и гидроксиды взаимодействуют и с кислотами, и со щелочами.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. И оксид натрия, и оксид цинка реагируют с
| 1) | H2O | 4) | Ba(OH)2 |
| 2) | H2SO4 | 5) | CaO |
| 3) | HCOOH | 6) | SO3 |
6. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | Na + H2O → … + H2 | 1) | O2 | ||||
| Б) | NaH + … → NaOH + H2 | 2) | Na2O | ||||
| В) | NaOH + ZnO | 3) 4) 5) 6) | H2O Na2[Zn(OH)4] Na2ZnO2 NaOH | ||||
| Г) | NaOH + Zn(OH)2 | ||||||
|
| |||||||
|
| |||||||
| А | Б | В | Г | ||||
|
|
|
| |||||
7. Минимальный объем 10%-ного раствора гидроксида калия (плотность 1,08 г/мл), который необходим для поглощения сероводорода объемом 6,72 л (н.у.), равен _________ мл. (Запишите число с точностью до десятых.)
8. К 290,9 мл 10%-ного раствора сульфата цинка (плотность 1,107 г/мл) прилили 163,7 мл 11,01%-ного раствора гидроксида натрия (плотность 1,110 г/мл). Определите массовые доли солей в растворе над полученным осадком.
Дата добавления: 2018-11-24; просмотров: 2468; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!