Скорость химической реакции. Химическое равновесие
Примеры заданий
Базовый уровень сложности
1. Скорость химической реакции между магнием и серной кислотой зависит от
| 1) | Давления |
| 2) | объема раствора кислоты |
| 3) | степени измельчения магния |
| 4) | массы магния |
2. Для увеличения скорости химической реакции необходимо
| 1) | понизить температуру |
| 2) | ввести в систему ингибитор |
| 3) | повысить температуру |
| 4) | увеличить концентрацию продуктов реакции |
3. С наибольшей скоростью при комнатной температуре протекает реакция между разбавленной серной кислотой и
| 1) | магнием | 2) | цинком | 3) | железом | 4) | свинцом |
4. С наибольшей скоростью при обычных условиях протекает реакция
| 1) | 2Ca + O2 = 2CaO |
| 2) | Na2S(р-р) + CuCl2(р-р) = CuS↓ + 2NaCl |
| 3) | Zn + 2HCl(р-р) = ZnCl2 + H2↑ |
| 4) | CaO + CO2 = CaCO3 |
5. Для увеличения скорости химической реакции
CO2(г) + C(тв) = 2COг)
необходимо
| 1) | добавить углерод |
| 2) | повысить концентрацию оксида углерода (II) |
| 3) | повысить температуру |
| 4) | понизить температуру |
6. Для увеличения скорости химической реакции
Fe2O3(тв) + 3Н2(г) = 2Fe(тв) + 3H2O(г)
необходимо
| 1) | добавить Fe2O3 |
| 2) | измельчить Fe2O3 |
| 3) | уменьшить температуру |
| 4) | понизить концентрацию водорода |
7.Для увеличения скорости химической реакции
Zn(тв) + 2HCl(р-р) = ZnCl2(р-р) + H2(г)
необходимо
| 1) | понизить концентрацию соляной кислоты |
| 2) | повысить давление |
| 3) | измельчить цинк |
| 4) | добавить несколько кусочков цинка |
8. С наибольшей скоростью при комнатной температуре протекает реакция между
| 1) | порошком цинка и 5%-ным раствором соляной кислоты |
| 2) | порошком цинка и 10%-ным раствором соляной кислоты |
| 3) | гранулированным цинком и 5%-ным раствором соляной кислоты |
| 4) | гранулированным цинком и 10%-ным раствором соляной кислоты |
9. Какие из приведенных утверждений верны?
А. О скорости химической реакции можно судить по изменению концентрации как исходных веществ, так и продуктов реакции.
Б. Ферменты – это биологические катализаторы белковой природы.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
10. Обратимой реакции соответствует уравнение
| 1) | HNO3 + NaOH = NaNO3 + H2O |
| 2) | 2K + 2H2O = 2KOH + H2↑ |
| 3) | 2Na + Cl2 = 2NaCl |
| 4) | Н2 + I2 = 2HI |
11. Обратимой реакции соответствует уравнение
| 1) | KOH + HBr = KBr + H2O |
| 2) | CO2 + C = 2CO |
| 3) | 2Mg + O2 = 2MgO |
| 4) | CuCl2 + K2S = CuS + 2KCl |
12. В системе
N2(г) + 3H2(г)  2NH3(г) + Q
2NH3(г) + Q
смещению химического равновесия в сторону продуктов реакции будет способствовать
| 1) | введение катализатора |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации аммиака |
| 4) | повышение температуры |
13. В системе
2CO(г)  CO2(г) + C(тв) + Q
CO2(г) + C(тв) + Q
смещению химического равновесия в сторону исходного вещества будет способствовать
| 1) | увеличение концентрации CO |
| 2) | увеличение давления |
| 3) | уменьшение концентрации СО2 |
| 4) | повышение температуры |
14. Какие из приведенных утверждений о смещении химического равновесия в системе
2SO2(г) + O2(г)  2SO3(г) + Q
2SO3(г) + Q
верны?
А. Для смещения равновесия в сторону образования оксида серы(VI) необходимо ввести катализатор.
Б. Увеличение давления приводит к смещению равновесия в сторону прямой реакции.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
15. На смещение химического равновесия в системе
СO(г) + Н2O(г)  СO2(г) + Н2(г) + Q
СO2(г) + Н2(г) + Q
не оказывает влияния
| 1) | повышение концентрации СО2 |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации водорода |
| 4) | повышение температуры |
16. При одновременном увеличении температуры и понижении давления равновесие сместится вправо в cистеме
| 1) | H2(г) + S(тв)  H2S(г) + Q H2S(г) + Q
|
| 2) | H2(г) + Cl2(г)  2HCl(г) + Q 2HCl(г) + Q
|
| 3) | 2NH3(г)  N2(г) + 3H2(г) – Q N2(г) + 3H2(г) – Q
|
| 4) | N2(г) + O2(г)  2NO(г) – Q 2NO(г) – Q
|
17. При одновременном увеличении температуры и увеличении давления равновесие сместится вправо в cистеме
| 1) | PCl5(г)  PCl3(г) + Cl2(г) – Q PCl3(г) + Cl2(г) – Q
|
| 2) | СаO(тв) + СО2(г)  СаСО3(тв) + Q СаСО3(тв) + Q
|
| 3) | 3О2(г)  2О3(г) – Q 2О3(г) – Q
|
| 4) | 2СO(г)  CO2(г) + C(тв) + Q CO2(г) + C(тв) + Q
|
18. Химическое равновесие в системе
2Н2О(г)  2Н2(г) + О2(г) – Q
2Н2(г) + О2(г) – Q
можно сместить в сторону продуктов реакции при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
19. Химическое равновесие в системе
СаO(тв) + СО2(г)  СаСО3(тв) +Q
СаСО3(тв) +Q
можно сместить в сторону продукта реакции при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
20. Какие из приведенных утверждений о смещении химического равновесия в системе
С4Н8(г) + Н2 (г)  С4Н10 (г) + Q
С4Н10 (г) + Q
верны?
А. Уменьшение температуры приводит к смещению равновесия в сторону обратной реакции.
Б. Для смещения равновесия в сторону образования бутана необходимо увеличить давление.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Вариант 1
1. С наибольшей скоростью при обычных условиях протекает реакция между
| 1) | раствором соляной кислоты и мрамором |
| 2) | раствором серной кислоты и магнием |
| 3) | известковой водой и углекислым газом |
| 4) | раствором сульфата натрия и раствором нитрата бария |
2. Для увеличения скорости химической реакции
2SO2(г) + O2(г) = 2SO3(г)
необходимо
| 1) | повысить концентрацию кислорода |
| 2) | повысить концентрацию оксида серы (VI) |
| 3) | уменьшить температуру |
| 4) | ввести в систему ингибитор |
3. Для уменьшения скорости химической реакции
FeO(тв) + СО(г) = Fe(тв) + СO2(г)
необходимо
| 1) | измельчить FeO |
| 2) | повысить концентрацию СО |
| 3) | уменьшить температуру |
| 4) | повысить концентрацию СO2 |
4. Какие из приведенных утверждений верны?
А. Скорость химической реакции зависит от массы реагирующих веществ.
Б. Действие катализаторов избирательно (селективно).
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. На смещение химического равновесия в системе
С2Н5ОН(ж) + СН3СООН(ж)  СН3СООС2Н5(ж) + Н2О(ж) + Q
СН3СООС2Н5(ж) + Н2О(ж) + Q
не оказывает влияния
| 1) | увеличение концентрации этилацетата |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации этанола |
| 4) | повышение температуры |
6. Химическое равновесие в системе
Fe2O3(тв) + 3Н2(г)  2Fe(тв) + 3H2O(г) – Q
2Fe(тв) + 3H2O(г) – Q
можно сместить в сторону продуктов реакции при
| 1) | добавлении Fe2O3 |
| 2) | уменьшении температуры |
| 3) | увеличении давления |
| 4) | увеличении температуры |
7. Химическое равновесие в системе
СО2(г) + Н2О(ж)  Н2СО3(ж) + Q
Н2СО3(ж) + Q
можно сместить в сторону исходных веществ при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
8. Какие из приведенных утверждений о химическом равновесии верны?
А. В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции.
Б. При введении катализатора химическое равновесие смещается в сторону прямой реакции.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Вариант 2
1. С наибольшей скоростью при обычных условиях протекает реакция
| 1) | 2Mg + O2 = 2MgO |
| 2) | Mg + Cl2 = MgCl2 |
| 3) | Mg2+ + CO 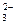 = MgCO3 = MgCO3
|
| 4) | Mg + 2H+ = Mg2+ + H2 |
2. Для уменьшения скорости химической реакции
Mg(тв) + 2H+ = Mg2+ + H2(г)
необходимо
| 1) | повысить концентрацию соляной кислоты |
| 2) | повысить концентрацию ионов Mg2+ |
| 3) | измельчить магний |
| 4) | понизить температуру |
3. Для увеличения скорости реакции
N2(г) + 3H2(г) = 2NH3(г)
необходимо
| 1) | понизить давление |
| 2) | повысить концентрацию NH3 |
| 3) | ввести в систему катализатор |
| 4) | понизить температуру |
4. Какие из приведенных утверждений верны?
А. Скорость гетерогенной реакции увеличивается при добавлении твердого реагента.
Б. Масса катализатора уменьшается в результате реакции.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. Химическое равновесие в системе
CO2(г) + C(тв)  2CO(г) – Q
2CO(г) – Q
можно сместить в сторону продукта реакции при
| 1) | добавлении угля |
| 2) | увеличении концентрации СО |
| 3) | увеличении концентрации СО2 |
| 4) | увеличении давления |
6. Изменение давления не оказывает влияния на смещение равновесия в системе
| 1) | H2(г) + С2Н4(г)  С2H6(г) С2H6(г)
|
| 2) | 2HCl(г)  H2(г) + Cl2(г)0 H2(г) + Cl2(г)0
|
| 3) | 2NH3(г)  N2(г) + 3H2(г) N2(г) + 3H2(г)
|
| 4) | 2SO2(г) + O2(г)  2SO3(г) 2SO3(г)
|
7. Химическое равновесие в системе
N2О4(г)  2NO2(г) – Q
2NO2(г) – Q
можно сместить в сторону исходного вещества при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
8. Какие из приведенных утверждений верны?
А. В состоянии химического равновесия концентрация исходных веществ равна концентрации продуктов реакции.
Б. Введение катализатора не влияет на смещение химического равновесия.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Дата добавления: 2018-11-24; просмотров: 3368; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
