Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Примеры заданий
Базовый уровень сложности
1. Молекулярное строение имеет
| 1) | хлорид калия | 3) | хлорид фосфора(V) |
| 2) | оксид бария | 4) | фосфат натрия |
2. Молекулярное строение имеет
| 1) | сульфат натрия | 3) | хлорид калия |
| 2) | гидроксид кальция | 4) | хлорид фосфора(III) |
3. Молекулярное строение имеет
| 1) | оксид кремния(IV) | 3) | никель |
| 2) | оксид азота(IV) | 4) | нитрат аммония |
4. Молекулярную кристаллическую решетку имеет
| 1) | СО2 | 2) | ВaO | 3) | SiO2 | 4) | K |
5. Атомную кристаллическую решетку имеет
| 1) | О2 | 2) | SiO2 | 3) | P4 | 4) | Mg |
6. Атомы являются структурной частицей в кристаллической решетке
| 1) | бензола | 2) | кварца | 3) | воды | 4) | азота |
7. Кристаллическую решетку, подобную кристаллической решетке алмаза, имеет
| 1) | ВaO | 2) | AlCl3 | 3) | SiC | 4) | CO |
8. Какие из приведенных утверждений верны?
А. В молекуле углекислого газа химические связи между атомами полярные, но сама молекула является неполярной.
Б. Вещества с атомной кристаллической решеткой характеризуются тугоплавкостью и высокой твердостью.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Повышенный уровень сложности
9. Атомную кристаллическую решетку имеют
| 1) | хром | 4) | карбид кремния |
| 2) | хлор | 5) | аммиак |
| 3) | кварц | 6) | алмаз |
|
|
|
10. Ионную кристаллическую решетку имеют
| 1) | метан | 4) | кремний |
| 2) | вода | 5) | поваренная соль |
| 3) | хлорид метиламмония | 6) | нитрат кальция |
11. Установите соответствие между типом кристаллической решетки вещества и его свойствами.
| ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ | СВОЙСТВА ВЕЩЕСТВ | ||||
| А) Б) В) Г) | атомная ионная молекулярная металлическая | 1) | ковкие, пластичные, обладают высокой тепло- и электропроводностью | ||
| 2) | очень твердые, тугоплавкие, практически не растворяются ни в каких растворителях | ||||
| 3) | летучие, имеют низкие температуры плавления, не проводят электрический ток | ||||
| 4) | тугоплавкие, твердые, малолетучие, в растворах и расплавах проводят электрический ток | ||||
| А | Б | В | Г | ||
|
|
| ||||
Вариант 1
1. Молекулярное строение имеет
| 1) | углекислый газ | 3) | хлорид метиламмония |
| 2) | железо | 4) | медный купорос |
2. Ионы являются структурной частицей в кристаллической решетке
| 1) | нитрата калия | 3) | графита |
| 2) | аммиака | 4) | белого фосфора |
3. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду
| 1) | калий, оксид кремния (IV), хлорид кальция |
| 2) | углекислый газ, азот, барий |
| 3) | алмаз, гидроксид кальция, метан |
| 4) | оксид калия, хлорид аммония, сульфат лития |
|
|
|
4. Какие из приведенных утверждений верны?
А. Аномально высокая температура кипения воды по сравнению с сероводородом обусловлена наличием водородных связей между ее молекулами.
Б. Вещества, газообразные при обычных условиях, имеют, как правило, молекулярную кристаллическую решетку.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. Молекулярную кристаллическую решетку имеют
| 1) | фенол | 4) | карбид кремния |
| 2) | белый фосфор | 5) | йод |
| 3) | кварц | 6) | алмаз |
Вариант 2
1. Немолекулярное строение имеют все вещества, расположенные в ряду
| 1) | азот, белый фосфор, хлорид калия |
| 2) | алмаз, оксид кремния(IV), карбид кремния |
| 3) | вода, белый фосфор, кремний |
| 4) | бор, оксид углерода(IV), графит |
2. Молекулы являются структурной частицей в кристаллической решетке
| 1) | фосфата кальция | 3) | алмаза |
| 2) | оксида бария | 4) | йода |
3. Молекулярную кристаллическую решетку имеет каждое из веществ, расположенных в ряду
| 1) | метан, оксид кальция, алмаз |
| 2) | углекислый газ, силан, сульфат бария |
| 3) | оксид углерода (IV), белый фосфор, вода |
| 4) | оксид фосфора (V), хлорид магния, карбонат калия |
|
|
|
4.Какие из приведенных утверждений верны?
А. Вещества с металлической кристаллической решеткой пластичны и обладают высокой электро- и теплопроводностью.
Б. Все вещества с ионной кристаллической решеткой хорошо растворимы в воде.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. Установите соответствие между названием вещества и типом его кристаллической решетки.
| НАЗВАНИЕ ВЕЩЕСТВА | ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ | ||||
| А) | кварц | 1) | атомная | ||
| Б) | нитрат аммония | 2) | ионная | ||
| В) | литий | 3) | молекулярная | ||
| Г) | аммиак | 4) | металлическая | ||
| А | Б | В | Г | ||
|
|
| ||||
Классификация химических реакций в неорганической и органической химии. Тепловой эффект химических реакций
Примеры заданий
Базовый уровень сложности
1. Взаимодействие водорода с бромом относится к реакциям
| 1) | соединения, экзотермическим |
| 2) | соединения, эндотермическим |
| 3) | обмена, экзотермическим |
| 4) | разложения, экзотермическим |
|
|
|
2. Уравнение СaO + H2O = Сa(OH)2 соответствует реакции
| 1) | соединения | 2) | разложения | 3) | обмена | 4) | замещения |
3. Реакция нейтрализации относится к реакциям
| 1) | соединения | 2) | разложения | 3) | обмена | 4) | замещения |
4. Реакции нейтрализации соответствует уравнение
| 1) | Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
| 2) | 2NaOH + H2SO4 = Na2SO4 + 2H2O |
| 3) | K2SO4 + BaCl2 = BaSO4↓ + 2KCl |
| 4) | 2KOH + CaCl2 = Ca(OH)2↓ + 2KCl |
5. Горение метана
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + Q
является реакцией
| 1) | соединения, каталитической, эндотермической |
| 2) | разложения, каталитической, экзотермической |
| 3) | обмена, некаталитической, эндотермической |
| 4) | окислительно-восстановительной, некаталитической, экзотермической |
6. К необратимым относится реакция взаимодействия между
| 1) | N2 и H2 | 2) | SO2 и O2 | 3) | Mg и O2 | 4) | I2 и H2 |
7. Обратимой является реакция взаимодействия между
| 1) | карбонатом натрия и азотной кислотой |
| 2) | сульфатом калия и хлоридом бария |
| 3) | азотной кислотой и гидроксидом натрия |
| 4) | нитратом калия и сульфатом натрия |
8. Окислительно-восстановительной является реакция, уравнение которой
| 1) | 2NaHCO3 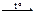 Na2CO3 + CO2 + H2O Na2CO3 + CO2 + H2O
|
| 2) | 2KMnO4 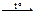 K2MnO4 + MnO2 + O2 K2MnO4 + MnO2 + O2
|
| 3) | SO3 + H2O = H2SO4 |
| 4) | Аl(OH)3 + KOH = K[Al(OH)4] |
9. Процесс превращения этилена в этанол относится к реакциям
| 1) | гидрирования | 3) | гидратации |
| 2) | изомеризации | 4) | дегидратации |
10. Процесс превращения бутана в метилпропан в присутствии катализатора относится к реакциям
| 1) | гидрирования | 3) | гидратации |
| 2) | изомеризации | 4) | дегидратации |
11. Процесс превращения пентана в 2-метилбутан при нагревании в присутствии катализатора относится к реакциям
| 1) | гидрирования | 3) | гидратации |
| 2) | изомеризации | 4) | дегидратации |
12. В результате реакции, термохимическое уравнение которой
2Mg + O2 = 2MgO + 1200 кДж,
выделилось 600 кДж теплоты. Объем (н.у.) вступившего при этом в реакцию кислорода равен
| 1) | 44,8 л | 2) | 22,4 л | 3) | 11,2 л | 4) | 112 л |
13. В результате реакции, термохимическое уравнение которой
2Сa + O2 = 2CaO + 1270 кДж,
образовалось 56 г оксида кальция. Количество выделившейся при этом теплоты равно
| 1) | 635 кДж | 2) | 2540 кДж | 3) | 317,5 кДж | 4) | 254 кДж |
14. В соответствии с термохимическим уравнением реакции
4Al(тв) + 3O2(г) = 2Al2O3(тв) + 3352 кДж
количество теплоты, выделяющееся при сгорании 270 г алюминия, равно
| 1) | 6704 кДж | 2) | 1340,8 кДж | 3) | 8380 кДж | 4) | 838 кДж |
15. В результате реакции, термохимическое уравнение которой
S(тв) + O2(г) = SO2(г) + 297 кДж,
выделилось 1188 кДж теплоты. Объем (н.у.) образовавшегося при этом сернистого газа равен
| 1) | 44,8 л | 2) | 89,6 л | 3) | 890 л | 4) | 112 л |
16. В результате реакции, термохимическое уравнение которой
2SO2(г) + O2(г) = 2SO3(г) + 198 кДж,
выделилось 990 кДж теплоты. Масса вступившего в реакцию сернистого газа равна
| 1) | 1280 г | 2) | 1600 г | 3) | 320 г | 4) | 640 г |
17. В соответствии с термохимическим уравнением реакции
2СО(г) + О2(г) = 2СО2(г) + 568 кДж
количество теплоты, выделившейся при сгорании 11,2 л (н.у.) оксида углерода(II), равно
| 1) | 113,6 кДж | 2) | 142 кДж | 3) | 284 кДж | 4) | 838 кДж |
18. В результате реакции, термохимическое уравнение которой
N2(г) + 3Н2(г) = 2NН3(г) + 92 кДж,
выделилось 46 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 67, 2 л | 2) | 44,8 л | 3) | 11,2 л | 4) | 33,6 л |
19. В результате реакции, термохимическое уравнение которой
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) + 1532 кДж,
образовалось 22,4 л (н.у.) азота. Количество выделившейся при этом теплоты равно
| 1) | 1532 кДж | 2) | 766 кДж | 3) | 306,4 кДж | 4) | 3064 кДж |
20. В результате реакции, термохимическое уравнение которой
2Н2(г) + О2(г) = 2Н2О(ж) + 572 кДж,
образовалось 7,2 г воды. Количество выделившейся при этом теплоты равно
| 1) | 114,4 кДж | 2) | 57,2 кДж | 3) | 143 кДж | 4) | 228,8 кДж |
21. В результате реакции, термохимическое уравнение которой
С(графит) + 2Н2(г) = СН4(г) + 74,6 кДж,
выделилось 373 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 448 л | 2) | 56 л | 3) | 112 л | 4) | 224 л |
22. В соответствии с термохимическим уравнением реакции
2С2Н2 + 5O2 = 4CO2 + 2H2O + 2610 кДж
при сгорании 26 г ацетилена количество выделившейся теплоты равно
| 1) | 1305 кДж | 2) | 5220 кДж | 3) | 522 кДж | 4) | 652,5 кДж |
23. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж,
выделилось 458 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 144,4 | 2) | 33,6 л | 3) | 67,2 л | 4) | 22,4 л |
24. В результате реакции, термохимическое уравнение которой
2NO(г) + O2(г) = 2NO2(г) + 114 кДж,
выделилось 570 кДж теплоты. Объем (н.у.) вступившего в реакцию оксида азота(II) равен
| 1) | 144,4 | 2) | 336 л | 3) | 112 л | 4) | 224 л |
25. В результате реакции, термохимическое уравнение которой
N2(г) + O2(г) = 2NO(г) – 180,8 кДж,
образовалось 56 л (н.у.) оксида азота(II). Количество поглотившейся при этом теплоты равно
| 1) | 90,4 кДж | 2) | 113 кДж | 3) | 226 кДж | 4) | 452 кДж |
26. В результате реакции, термохимическое уравнение которой
2AgNO3(тв) = 2Ag(тв) + 2NO2(г) + O2(г) – 317 кДж,
образовалось 10,8 г серебра. Количество поглотившейся при этом теплоты равно
| 1) | 31,7 кДж | 2) | 15,85 кДж | 3) | 63,4 кДж | 4) | 12,68 кДж |
Повышенный уровень сложности
27. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||||
| А) | соединения | 1) | 2KClO3 = 2KCl + 3O2 | ||
| Б) | разложения | 2) | 2СО + О2 = 2СО2 | ||
| В) | замещения | 3) | С2Н6 + Cl2 → С2Н5Cl + HCl | ||
| Г) | обмена | 4) | НNO3 + KОН = КNO3 + Н2О | ||
| А | Б | В | Г | ||
|
|
| ||||
Вариант 1
1. Взаимодействие натрия с водой является реакцией
| 1) | соединения, эндотермической |
| 2) | разложения, экзотермической |
| 3) | обмена, эндотермической |
| 4) | замещения, экзотермической |
2. Эндотермической является реакция
| 1) | горения пропана |
| 2) | разложения карбоната кальция |
| 3) | окисления глюкозы |
| 4) | Нейтрализации |
3. Процесс превращения уксусного альдегида в этанол относится к реакциям
| 1) | гидрирования | 3) | гидратации |
| 2) | изомеризации | 4) | дегидратации |
4. По радикальному механизму протекает реакция
| 1) | гидратации этилена |
| 2) | хлорирования метана |
| 3) | омыления жиров |
| 4) | щелочного гидролиза 2-хлорпропана |
5. Какие из приведенных утверждений верны?
А. Изомеризация алканов происходит с изменением состава вещества.
Б. Реакции обмена, протекающие с образованием осадка, являются практически необратимыми.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
6. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||||
| А) | соединения | 1) | 2СН4 → С2Н2 + 3Н2 | ||
| Б) | разложения | 2) | 2SO2 + O2 = 2SO3 | ||
| В) | замещения | 3) | BaCl2 + Na2SO4= BaSO4↓ + 2NaCl | ||
| Г) | обмена | 4) | С2Н6 + Cl2 → С2Н5Cl + HCl | ||
| А | Б | В | Г | ||
|
|
| ||||
7. В результате реакции, термохимическое уравнение которой
CO2(г) + C(графит) = 2CO(г) – 173 кДж,
поглотилось 34,6 кДж теплоты. Объем (н.у.) образовавшегося при этом оксида углерода(II) равен
| 1) | 22,4 л | 2) | 4,48 л | 3) | 8,96 л | 4) | 11,2 л |
Вариант 2
1. Взаимодействие метана с хлором является реакцией
| 1) | соединения, каталитической, эндотермической |
| 2) | разложения, некаталитической, экзотермической |
| 3) | обмена, окислительно-восстановительной, эндотермической |
| 4) | замещения, окислительно-восстановительной, экзотермической |
2. Гомогенной является реакция взаимодействия между
| 1) | О2 и H2 | 2) | S и Fe | 3) | Ca и O2 | 4) | CuO и H2 |
3. Процесс превращения уксусного альдегида в уксусную кислоту относится к реакциям
| 1) | гидрирования | 3) | окисления |
| 2) | изомеризации | 4) | дегидратации |
4. По ионному механизму протекает реакция
| 1) | хлорирования метана |
| 2) | гидратации пропилена |
| 3) | горения пропана |
| 4) | крекинга октана |
5. Какие из приведенных утверждений верны?
А. Все реакции соединения являются экзотермическими.
Б. В химических реакциях процесс окисления не всегда сопровождается процессом восстановления.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
6. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||||
| А) | соединения, эндотермическая | 1) | Fe(OH)2 | ||
| Б) | соединения, экзотермическая | 2) | CaO + H2O = Ca(OH)2 | ||
| В) | разложения, эндотермическая | 3) | N2 + O2 | ||
| Г) | обмена, экзотермическая | 4) | Ba + 2H2O = Ba(OH)2 + H2 | ||
|
| 5) | HBr + NaOH = NaBr + H2O | |||
| А | Б | В | Г | ||
|
|
| ||||
7. В результате реакции, термохимическое уравнение которой
Н2(г) + Сl2(г) = 2НСl(г) + 184,6 кДж,
образовалось 11,2 л (н.у.) хлороводорода. Количество выделившейся при этом теплоты равно
| 1) | 18,46 кДж | 2) | 37,92 кДж | 3) | 46,15 кДж | 4) | 92,3 кДж |
Дата добавления: 2018-11-24; просмотров: 2522; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 FeO + H2O
FeO + H2O 2NO
2NO