Студент: фамилия, и.о. группа
Форма отчета к лабораторной работе
Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции: 1) от концентрации реагирующих веществ; 2) от температуры процесса; 3) расчет величины энергии активации реакции.
Краткая теоретическая часть
Скоростью химической реакции (υ) называется: _______________________
_________________________________________________________________
Скорость реакции зависит от следующих факторов:
1. _____________________________ 2. _______________________________
3. ____________________________ _ 4. _______________________________
Зависимость скорости химической реакции от концентрации (C) реагирующих веществ описывается законом__________________________________________
Кинетическое уравнение (как частный случай закона действующих масс) это функциональная зависимость:_______________________________________ _________________________________________________________________
Константа скорости: _______________________________________________
численное значение константы скорости определяется:__________________
_________________________________________________________________
Влияние температуры на скорость реакции описывается:
1) эмпирическим правилом Вант-Гоффа (формулировка и математическая запись)
__________________________________________________________________;
2) уравнением Аррениуса (логарифмическая и экспоненциальная формы уравнения)_________________________________________________________
Энергия активации ЕА – это _________________________________________ _______________________________________________________________________________________________________________________________________
Единицы измерения ЕА:_____________________________________________
|
|
|
Экспериментальная часть
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ.
υ = f (C)
Исследуемая реакция в молекулярном виде:
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S
Na2S2O3 + H2SO4 = S + H2O + SO2 + Na2SO4
Ионный вид уравнения: (S2O3)2- + 2H+ → S + H2O + SO2
Кинетическое уравнение (закон действующих масс) для данной реакции при переменной концентрации реагирующих веществ имеет вид: ________________________________________________________________
Кинетические уравнения и вид теоретических графических зависимостей при постоянстве концентрации одного из реагирующих веществ:
а) С(H+) = const б) С(S2O32-) = const
υ = ____________________ υ = ____________________
| υ |
| υ |
| С(S2O32-) |
| С(H+) |
Таблица 7.4.2
Экспериментальные данные υ = f ( C )
| № системы | Объём реагентов, мл | С (S2O32-) | Время (τ) появления голубого окрашивания, с | Относительная скорость ύ = 1/τ , с-1 | ||
| А | Б | В | ||||
| 1 | 1 | 2 | 1 | 1С | ||
| 2 | 2 | 1 | 1 | 2С | ||
| 3 | 3 | 0 | 1 | 3С | ||
Реагенты: А- тиосульфат натрия (Na2S2O3), Б- вода (H2O), В – серная кислота (H2SO4)
| Рис.2. Экспериментальная зависимость скорости реакции от концентрации тиосульфат иона |
| С(S2O32-) |
| ύ∙102, с-1 |
|
|
|
Опыт 2. Зависимость скорости реакции от температуры.
υ = f (Т) или ln(ύ) = f (1/Т)
Исходные концентрации реагирующих веществ во всех системах С(Na2S2O3) и С(H2SO4) одинаковы.
Математическая запись правила Вант-Гоффа ________________________________________________________________
Уравнение Аррениуса в логарифмическом виде - это уравнение прямой линии:
ln (ύ) 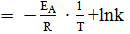
Таблица 7.4.3
Экспериментальные данные: υ = f (Т) или ln (ύ) = f (1/Т)
| № системы | Температура | ( 1 / T )∙103 | Время (τ) появления голубого окрашивания, с | Относительная скорость ύ = 1/τ , с-1 | − ln (ύ) | |
| t , 0 C | T , K | |||||
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
| − ln(ύ) |
| а) |
| б) |
| (1/T)∙103 |
| Рис. 3. Графики экспериментальных зависимостей: а) υ = f (Т); б) ln(ύ) = f (1/Т) )∙103 |
| t0, C |
| ύ∙102, с-1 |
Расчет температурного коэффициента (коэффициента Вант-Гоффа - γ).
γ1 = ύ3/ ύ2, γ2 = ύ2/ ύ1, γсред = (γ1 + γ2)/2.
Расчет энергии активации реакции: ________________________________________________________________________________________________________________________________________
Выводы по работе:
|
|
|
1._________________________________________________________________
___________________________________________________________________
2._________________________________________________________________
___________________________________________________________________
3._________________________________________________________________
___________________________________________________________________
Лабораторная работа
Химическое равновесие
(для бакалавриата)
Цель работы:
1) Сформулировать закон действующих масс и привести математическое выражение константы равновесия;
2) изучить влияние различных факторов на состояние равновесия (количеств взаимодействующих веществ и температуры), научиться прогнозировать сдвиг равновесия при действии различных факторов;
3) освоить математическое выражение уравнения химического сродства.
Рекомендации: при подготовке к работе необходимо повторить разделы «Химическая термодинамика», «Химическая кинетика» и ответить на все контрольные вопросы.
Важнейшие понятия: химическое равновесие, константа равновесия, уравнения изобары и изотермы реакции.
Следует уметь: приводить выражения кинетической и термодинамической констант равновесия; рассчитывать и связывать константу равновесия со свободной энергией Гиббса; определять направления смещения равновесия и оптимальные условия протекания процессов, используя принцип Ле- Шателье; рассчитывать температуру равновесного состояния системы.
|
|
|
Краткая теоретическая часть
Устойчивое равновесное состояние термодинамических систем характеризуется следующими общими условиями:
1) неизменностью равновесного состояния системы при сохранении внешних условий;
2) подвижностью равновесия (самопроизвольным восстановлением равновесия после прекращения внешнего воздействия, вызвавшего незначительное отклонение системы от положения равновесия);
3) динамическим характером равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов;
4) возможностью подхода к состоянию равновесия с двух противоположных сторон;
5) минимальным значением изменения изобарно-изотермического или изохорно-изотермического потенциалов ( 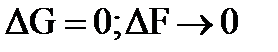 ). Выражением этих условий является закон действия масс (константы равновесия).
). Выражением этих условий является закон действия масс (константы равновесия).
Для химической реакции в общем виде 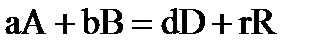 ,
,
протекающей в газовой фазе в изобарно-изотермических условиях, константа равновесия имеет вид: 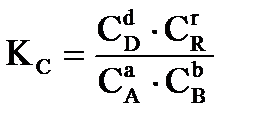 ;
; 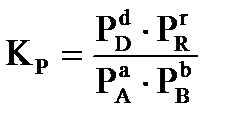 ;
;
где C и P- равновесные значения концентраций веществ (в моль/л), парциальных давлений в кПа, соответственно.
Константа равновесия, выраженная через парциальные давления компонентов газовой смеси, связана с константой Кс соотношением: 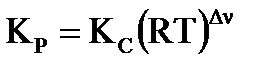 , где
, где 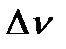 - изменение числа молей газа в реакции,
- изменение числа молей газа в реакции, 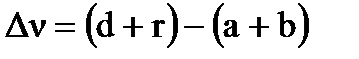 .
.
В основе термодинамического расчета констант равновесия и равновесных выходов продуктов лежит уравнение изотермы химической реакции Вант-Гоффа: 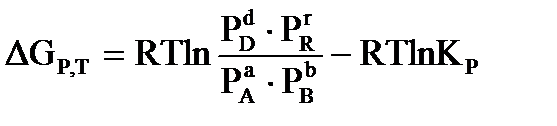 , где
, где 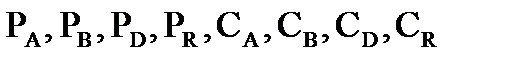 - произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
- произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
Для стандартного состояния системы, уравнения химического сродства имеют вид: 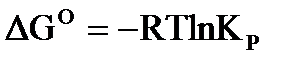 .
.
Для расчета константы равновесия можно применить уравнение изобары Вант-Гоффа 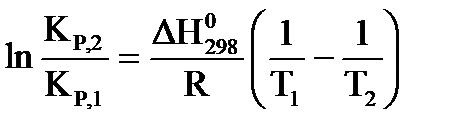 .
.
Примеры решения типовых задач
Пример 1. Константа равновесия реакции H2 (г)+I2 (г) =2 HI (г) при 693 К КС=50,25. Вычислите массу образующегося иодида водорода, если в сосуд вместимостью 1 л введено 846 г йода и 21,2 г водорода.
Дано:
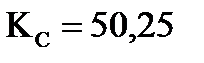 V = 1л
m(I2) = 846 г
m(H2) = 21,2 г
V = 1л
m(I2) = 846 г
m(H2) = 21,2 г
| Решение:
Уравнение процесса: H2 (г)+I2 (г) =2 HI (г).
Определим количество моль исходных веществ по формуле ν(Х) = m(Х)/M(Х):
ν0(H2) = 21,2/2 = 0,0106 моль, ν0(I2) = 846/254 = 0,0033 моль.
Число моль иодида водорода в исходном состоянии равно нулю (ν0(HI)=0). Изменение числа моль к моменту равновесия йода и водорода (Δν(H2)= Δν(I2)= х) будет одинаковым (исходя из уравнения процесса), а равновесное число моль HI будет определяться удвоенным изменением числа моль H2 или I2: νравн.(HI)=2∙Δν=2х. Равновесное число моль остальных веществ в системе составит:
νравн.(H2)= ν0(H2) –х =(10,6∙10-3 – х ) моль,
νравн.(I2)= ν0(I2) –х =(3,33∙10-3 – х) моль.
Находим: 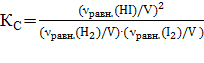 , ,
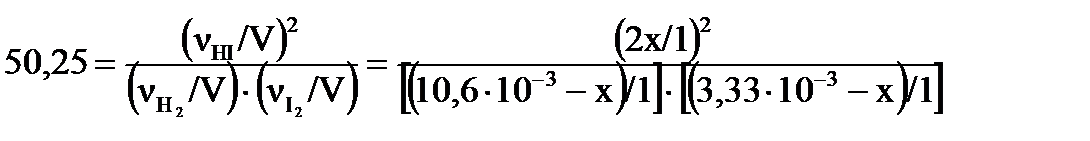 Решение этого уравнения дает:
Решение этого уравнения дает:  .
Откуда: .
Откуда: 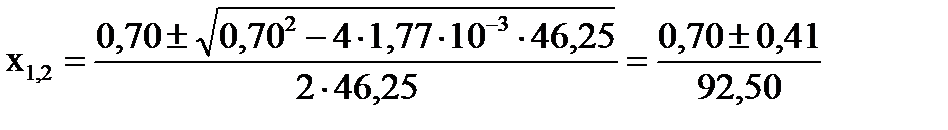 , ,
 , , 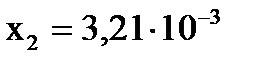 .
Первый корень уравнения не имеет физического смысла, так как величина х1 не может быть больше ν0(H2), т.е. .
Первый корень уравнения не имеет физического смысла, так как величина х1 не может быть больше ν0(H2), т.е. 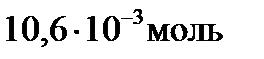 . Следовательно, равновесное количество полученного йодистого водорода будет составлять: . Следовательно, равновесное количество полученного йодистого водорода будет составлять:
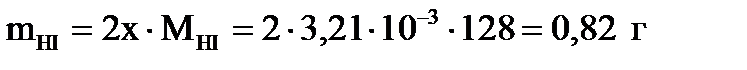 . .
|
| Найти: m(HI)? | Ответ: m(HI) = 0,82 г. |
Пример 2. В закрытый сосуд вместимостью 0,05 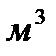 введено 10 моль вещества А и 1 моль вещества В. В результате реакции 2A+B=D установилось равновесие с общим давлением в системе 485 кПа. Вычислите равновесные количества всех веществ в системе при 298 К. Чему равно значение
введено 10 моль вещества А и 1 моль вещества В. В результате реакции 2A+B=D установилось равновесие с общим давлением в системе 485 кПа. Вычислите равновесные количества всех веществ в системе при 298 К. Чему равно значение 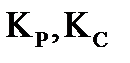 при этой температуре? Система подчиняется законам идеального газа.
при этой температуре? Система подчиняется законам идеального газа.
| Дано: V= 0,05 м3 ν0(А)=10 моль ν0(В)=1 моль ν0(D)=0 моль Робщ = 485 кПа Т=298 К | Решение:
Уравнение процесса: 2A(г)+B(г)=D(г). Если обозначить количество превращенных моль вещества В через х, то Δν(В)=х, Δν(А)=2х, Δν(D)= х (согласно уравнению реакции). Равновесное число моль веществ в системе можно рассчитать: νравн.= ν0 –Δν; νравн.(А)= 10–2х моль, νравн.(В)= 1–х моль, νравн.(D)= х моль.
Сумма моль в равновесной системе составит:
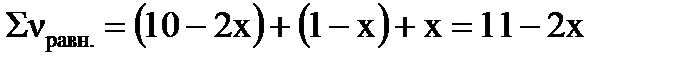 .
По уравнению Менделеева-Клапейрона .
По уравнению Менделеева-Клапейрона 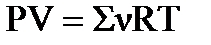 находим значение х: находим значение х:  , , 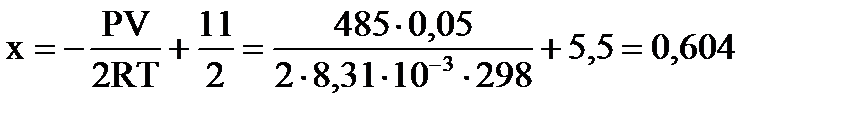 моль.
Равновесные количества веществ в системе составят:
νравн.(А) =10–2∙0,604=8,792 моль, νравн.(В)=1–0,604=0,396 моль, νравн.(D)=0,604 моль.
Константы равновесия рассчитываем по уравнениям: моль.
Равновесные количества веществ в системе составят:
νравн.(А) =10–2∙0,604=8,792 моль, νравн.(В)=1–0,604=0,396 моль, νравн.(D)=0,604 моль.
Константы равновесия рассчитываем по уравнениям:
 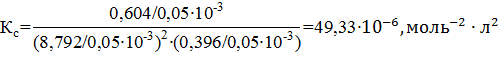 Изменение числа моль газов в результате процесса
Изменение числа моль газов в результате процесса  по уравнению составляет Δν = 1–2–1 = – 2 моль, по уравнению составляет Δν = 1–2–1 = – 2 моль, 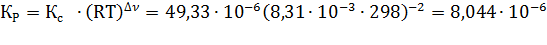
|
| Найти: νравн.(А), νравн.(В), νравн.(D), Кр, Кс ? | Ответ: νравн.(А)=8,792 моль, νравн.(В)= 0,396 моль, νравн.(D)= 0,604 моль, Кс=49,33∙10-6, Кр=8,044∙10−6. |
Пример 3. Вычислите степень превращения (α) исходных веществ реакции A+4B=D и равновесный выход (ХD) конечного продукта реакции D, если начальные количества исходных веществ: 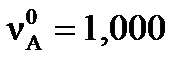 моль,
моль, 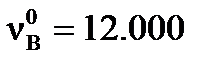 моль. При достижении равновесия:
моль. При достижении равновесия: 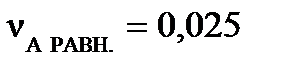 моль,
моль, 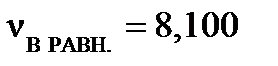 моль,
моль, 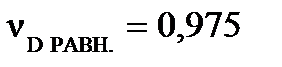 моль. Рассчитайте константу равновесия КС, если объем реакционного сосуда равен 50 л.
моль. Рассчитайте константу равновесия КС, если объем реакционного сосуда равен 50 л.
Дано:
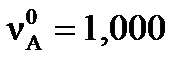 моль моль
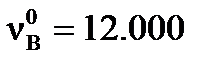 моль моль
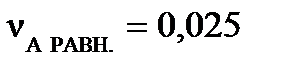 моль моль
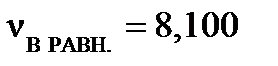 моль моль
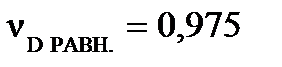 моль
V=50 л моль
V=50 л
| Решение.
Степень превращения исходных веществ можно найти: 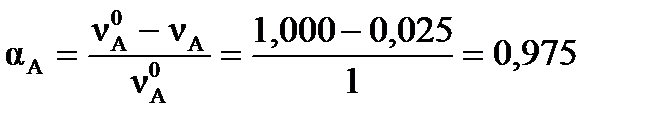 , , 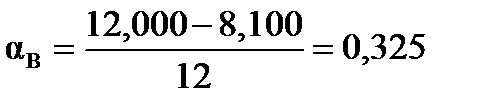 .
Равновесный выход вещества D определим по молярной доле этого вещества в равновесном состоянии системы: .
Равновесный выход вещества D определим по молярной доле этого вещества в равновесном состоянии системы: 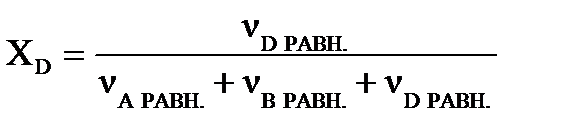 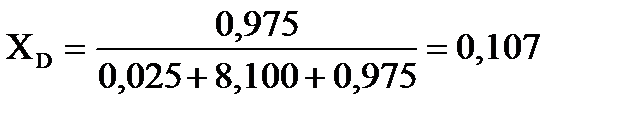 .
Равновесный выход (в %) вещества D (ХD) составит: ХD = 0,107∙100=10,7 %.
Константу равновесия рассчитаем: .
Равновесный выход (в %) вещества D (ХD) составит: ХD = 0,107∙100=10,7 %.
Константу равновесия рассчитаем:
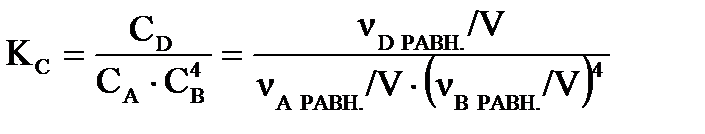
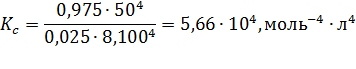
|
| Найти: αА, αВ, ХD, КС? | Ответ: αА =0,975, αВ =0,325, ХD=10,7%, КС =5,66∙104, моль-4∙л4 |
Контрольные вопросы и задания:
1. Что называют химическим равновесием? Укажите термодинамическое и кинетическое условия равновесия.
2. Что называют константой равновесия, и от каких факторов она зависит? Приведите примеры для гомогенных и гетерогенных систем.
3. Сформулируйте принцип Ле-Шателье. Как влияет изменение внешних условий на состояние равновесия обратимой химической реакции?
СаСО3(т) = СаО(т) + СО2(г); ∆Н0 х.р. = 176,1 кДж/моль.
4. Рассчитайте температуру, при которой равновероятны оба направления реакции синтеза аммиака из азота и водорода.
5. Константа равновесия реакции N2O4 (г) = 2 NO2 (г) при 250 С равна 4,64∙10-3. В каком направлении будет идти реакция при следующих концентрациях веществ: С(N2O4) = 0,046 моль/л; С(NO2) = 0,0095 моль/л.
6. В каком направлении сместится равновесие в системе N2(г) + 3H2(г) ↔ 2NH3(г), при условии, что ΔH0хр <0: а) при увеличении концентрации N2; б) при увеличении концентрации Н2; в) при повышении температуры; г) при уменьшении давления?
7. В системе 2NO(г)+O2 (г)= 2NO2 (г) равновесные концентрации веществ равны [NO]=0,2 моль/дм  , [O2]=0,3 моль/дм
, [O2]=0,3 моль/дм  , [NO2]=0,4 моль/дм
, [NO2]=0,4 моль/дм  . Укажите преимущественное направление реакции.
. Укажите преимущественное направление реакции.
Экспериментальная часть
Дата добавления: 2018-11-24; просмотров: 221; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
