Приклади розв ’ язання типових задач
Приклад 1 . Скільки грамів металу, молярна маса еквівалента якого 12,16 г/моль, взаємодіє з 310 см3 кисню (за нормальних умов)?
Розв ’ язання. Моль кисню, молярна маса якого 32 г/моль, за нормальних умов займає об'єм 22,4 дм3. Молярна маса еквівалента оксигену становить:М(  О) = 16/2=8 г/моль.
О) = 16/2=8 г/моль.
32 г – 22,4 дм3
8г – х дм3.
Звідси випливає, що об'єм еквівалента оксигену становить:
22,4/4 =5,6 дм3. За законом еквівалентів:

 . Підставимо значення
. Підставимо значення 
звідки 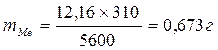
Приклад 2. При відновленні воднем 1,34 г оксиду металу утворилося 0,324 г води. Розрахуйте молярну масу еквівалента металу. Визначте, який це метал.
Розв ’ язання . За законом еквівалентів
 , (1)
, (1)
де
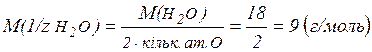 ;
;
 .
.
Якщо підставити цей вираз у перше рівняння, то можна вивести формулу для розрахунку М(1/ z Ме).
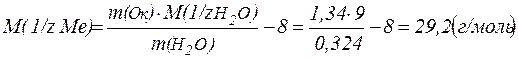
А r (Ме) = М(1/ z Ме)· z
z- валентність металу (цілі числа від 1 до 8).
Складемо таблицю:
z 1 2 3 4 5 6 7 8
ММе 29,2 58,4 87,6 116,8 146 175,2 204,4 233,6
Метал - Ni - Sr - Lu Tl -
Стронцій, лютецій і талій не можуть мати таких високих ступенів окиснення, значить Ме – нікель.
Контрольні завдання
1. Визначте молярні маси еквівалентів вихідних речовин для реакції:
2НВ r +Са(О H )2=  ?
?
2. При відновленні 2,32 г Вольфрам оксиду воднем виділяється 0,54 г води. Визначте молярну масу еквівалента Вольфраму в цій сполуці і встановіть формулу Вольфрам оксиду.
|
|
|
3. Визначте молярні маси еквівалентів вихідних речовин для реакції:
 .
.
4. При окисненні 0,608г металу витрачається 280 см3 кисню (за нормальних умов). Визначте молярну масу еквівалента металу та встановіть, який це метал.
5. Визначте молярні маси еквівалентів вихідних речовин для реакції:
 ?
?
6. 2 г NаОНпрореагували з 2,45 г фосфатної кислоти (Н3РО4). Визначте молярну масу еквівалента кислоти, основність кислоти в даній реакції. Наведіть рівняння відповідної реакції.
7. Визначте молярні маси еквівалентів вихідних речовин для реакції:

8. Скільки металу, молярна маса еквівалента якого дорівнює 12,16 г/моль, (умови нормальні) взаємодіють з 310 см3 кисню?
9. Визначте молярні маси еквівалентів вихідних речовин для реакції:
2  ?
?
10. 24 г якогось елемента при спаленні утворили 56 г оксиду. Визначте елемент і формулу оксиду.
11. Визначте молярні маси еквівалентів вихідних речовин для реакції:
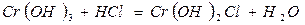
12. При згорянні 5,00 г металу утворюється 9,44 г метал оксиду. Визначте молярну масу еквівалента цього металу.
13. Визначте молярні маси еквівалентів вихідних речовин для реакції:
|
|
|

14. Визначте атомну масу двовалентного металу, якщо 8,34 г його окиснюється 0,680 дм3 кисню (за нормальних умов). Який це метал?
15. Визначте молярні маси еквівалентів вихідних речовин для реакції:

Тема 2. Будова атому. Мінеральні речовини.
Макро- и мікроелементи.
При вивченні цього розділу необхідно звернути увагу на сучасну квантово-механічну уяву про будову атома.
Атом складається з позитивно зарядженого ядра, у якому зосереджена майже вся маса атома, і негативно заряджених електронів, які обертаються навколо ядра.
При всіх хімічних процесах змінюється не ядро атомів, а тільки електронні оболонки. Хімічна енергія, таким чином, сполучена з енергією електронів. Електрон ( e - ) – частинка, що має елементарний негативний заряд (1,602×10-19 Кл). Маса покою електрона мала і становить 1/1837,14 маси протону.
За законами квантової механіки електрон поряд з властивостями речовини (частинки) має і властивості електромагнітного поля. Таким чином, у властивостях електрона, в законах його руху виявляється нерозривність двох якісно різних форм існування матерії: речовини і поля. Електрону, як і будь-якому мікрооб’єкту, притаманна двоїста корпускулярно-хвильова природа.
|
|
|
Рух електрона в атомі носить ймовірностно-хвильовий характер. Простір навколо ядра, в якому з найбільшою ймовірністю може знаходитися електрон, називають атомною орбіталлю (АО). Атомна орбіталь, як люба геометрична фігура, характеризується трьома параметрами (координатами), що одержали назву квантових чисел (n, l, ml). Вони визначають розмір (n), форму (l) і орієнтацію (ml) атомної орбіталі у просторі. Займаючи ту чи іншу атомну орбіталь, електрон утворює електронну хмару (електронну орбіталь). Форми електронних хмар аналогічні атомним орбіталям (рис.1). Електронна хмара характеризується чотирма квантовими числами (n, l, ml, ms).

Рис.1. Форми і просторова орієнтація s-, p-, d-орбіталей
Набором цих чисел можна повністю охарактеризувати стан будь-якого електрону в атомі.
Головне квантове число n визначає основну характеристику електрону в атомі – його енергію та енергетичний рівень. Воно визначає також розміри атомних орбіталей.
Для електронів, що знаходяться у незбудженому стані, n приймає значення від 1 до 7 (відповідно номеру періоду в періодичній системі елементів Д.І.Менделєєва). Сукупність електронів в атомі, що мають однакове значення n, називають електронним шаром . Ці шари позначають:
|
|
|
n = 1 2 3 4 5 6 7 – енергетичні рівні
К L M N O P Q.
Кожен енергетичний рівень має свої підрівні, які відрізняються формою (s, p, d, f, g – підрівні). Знаходження електрона на якомусь певному підрівні визначає орбітальне квантове число.
Орбітальне квантове число l характеризує енергетичний стан електрона на підрівні і формуелектронної хмари.
Для кожного n орбітальне квантове число може приймати значення цілих чисел від 0 до (n-1). Тобто кожному значенню n відповідає таке ж число значень l. Це означає, що число підрівнів на кожному рівні дорівнює номеру рівня n (на першому рівні знаходиться один підрівень, на другому – два, і так далі, але не може бути більше 4).
l = 0, 1, 2, 3, … , (n-1) - підрівні
s, p, d, f, g
(для зручності чисельним значенням ставляться у відповідність літери: s, p, d, f, g).
Якщо n = 1, то l = 0 - кількість підрівнів 1 - 1s.
Якщо n = 2, то l = 0 і 1 - кількість підрівнів 2 - 2s 2р.
Якщо n = 3, то l = 0, 1, 2 - кількість підрівнів 3 - 3s 3р 3d.
Наступні рівні мають по 4 підрівня (s-, p-, d- і f-підрівні).
s–підрівень складається з однієї s–орбіталі. Вона має сферичну форму і знак хвильової функції плюс або мінус. Така орбіталь не має вузла – місця, в якому електронна густина, що визначається йовірностю знаходження електрону поблизу даної точки, дорівнює нулю. Електрони на цьому підрівні (l=0) називаються s- електронами.
p-підрівень (l=1) складають три p-орбіталі (рх, py, pz). Вони мають форму гантелі, що складається із зв’язаних через вузол двох частин з протилежними знаками хвильової функції. p-орбіталі знаходяться на перпендикулярних вісях (х,у, z) у просторі. Тут розташовуються р-електрони.
d- і f-орбіталі (l=2 і 3) мають більш складну форму, на них розташовуються d- і f-електрони.
Магнітне квантове число mlхарактеризує орієнтацію(магнітний момент) орбіталі у просторі. Тобто воно визначає, на якій саме орбіталі знаходиться електрон, наприклад на якій з трьох р-орбіталей знаходиться певний р-електрон. Для кожного числа l магнітне квантове число ml приймає значення цілих чисел, що змінюються на одиницю від + l до – l через 0.
ml = + l, ...., 0 , ....., – l
Сумарне число можливих значень ml дорівнює 2l+1 та визначає кількість орбіталей на даному підрівні. Так s–підрівень (l=0, ml=0), як було сказано вище, складається тільки з однієї s–орбіталі, бо має одне значення ml. Для p-підрівня (l=1) магнітне квантове число має три значення ml = +1, 0, -1, тому цей підрівень складається з трьох p-орбіталей (рх, py, pz), що розташовані взаємно перпендикулярно уздовж вісей координат. Для d-орбіталей, відповідно, відомо п'ять варіантів розташування в просторі (2l+1=2·2+1=5). Відповідність орбітального та магнітного квантових чисел кількості орбіталей на підрівні можна представити таблицею 2.
Таким чином, на першому рівні тільки один s-підрівень і на ньому знаходиться тільки одна атомна орбіталь; на другому рівні – два підрівня (s- і р-підрівень), які вміщюють разом чотири орбіталі, на третьому - дев’ять орбіталей (одна на s-підрівні, три на р-підрівні і п’ять на d-підрівні). Звідси можна зробити висновок, що кількість орбіталей на рівні дорівнює квадрату значення рівня n2 .
Таблиця 2
Значення орбітального l, магнітного ml квантових чисел та кількості орбіталей на підрівнях атому.
| Підрівні | l | ml | Кількість орбіталей |
| s | 0 | 1 | 1 |
| p | 1 | +1,0,-1 | 3 |
| d | 2 | +2,+1,0,-1,-2 | 5 |
| f | 3 | від +3 до -3 | 7 |
Спінове квантове число ms характеризує напрямок руху електронів навколо своєї вісі. Воно може приймати значення:
ms= +1/2 або –1/2.
Електрони з різними спінами (з різним напрямком обертання навколо своєї вісі), зображуються стрілками і ¯.
 Атомнаорбіталь схематично зображується квантовою (енергетичною) коміркою
Атомнаорбіталь схематично зображується квантовою (енергетичною) коміркою
Розподіл електронів в атомі по атомним орбіталям здійснюється відповідно до правила найменшої енергії, принципів Паулі і Хунда.
1. Правило найменшої енергії – електрони заповнюють орбіталі відповідно зростанню енергії останніх, які розташовуються у такій послідовності:
1s2 ® 2s2 ® 2p6 ® 3s2 ® 3p6 ® 4s2 ® 3d10 ® 4p6 ® 5s2 ® 4d10 ® 5p6 ® 6s2 ® 5d1 ® 4f14 ® 5d2-10 ® 6p6 ® 7s2 ® 6d1 ® 5f14 ® 6d2-10 ® 7p6,
де s, p, d, f - енергетичні підрівні, цифри перед буквами означають енергетичний рівень, на якому знаходяться електрони, а індекс зверху праворуч показує число електронів на даному підрівні.
Цей ряд можна одержати за допомогою правила Клечковського – більшу енергію мають орбіталі з більшим числом суми головного та побічного квантових чисел (n + l); якщо для двох орбіталей сума однакова, то меншу енергію має орбіталь з меншим значенням n.
1s – n + l = 1+ 0 = 1
2s – n + l = 2+ 0 = 2
2p – n + l = 2+ 1 = 3
3s – n + l = 3+ 0 =3
3p – n + l = 3+ 1 =4
4s – n + l = 4+ 0 =4
3d – n + l = 3+ 2 =5
Так можно пояснити той факт, що спочатку заповнюється 4s-орбіталь, а потім вже 3d і так далі.
2. Принцип Паулі – в атомі не може бути двох електронів з однаковим набором чотирьох квантових чисел, цей набір повинен відрізнятися хоча б однією цифрою.
Виходячи з цього, можна встановити, скільки електронів може міститись на одній орбіталі.
|
Спареними ¯називаютьдва електрони з однаковими значеннями n, l, ml але з різними значеннями ms.
Загальна кількість електронів на енергетичному рівні визначається за допомогою формули: 
3. Правило Хунда. Електронна система атома в межах підрівня намагається набути максимальне значення спіну. А це можливо, якщо на орбіталях підрівня електрони розташовуються спочатку по одному, а потім по другому з протилежно спрямованими спінами.
Наприклад, якщо три р-орбіталі (рx,рy,рz) необхідно заповнити трьома р-електронами, то вони повинні розподілитися по одному на кожній окремій орбіталі (в окремій комірці). Схематичний розподіл електронів у квантових комірках буде таким:
|
|
|
|
|
|
.
Тоді сумарний спін визначається так і має максимальне значення за модулем:
Σ ms = + ½ + ½ + ½ = +1½ Σ ms = - ½ - ½ - ½ = -1½
Якщо електрони будуть розташовані таким чином:
| |
|
|
,
то значення сумарного спіну дорівнює:
Σ ms = + ½ - ½ + ½ = +½ і він не буде мати максимальне значення.
Будова електронних оболонок тісно зв’язана з періодичною системою елементів Д.І. Менделєєва. Номер періоду дорівнює кількості енергетичних рівнів (електронна оболонка атомів елементів 2-го періоду має два енергетичних рівня, 3-го періоду – три, 4-го періоду – чотири тощо). Усього 7 енергетичних рівнів та відповідно 7 періодів. Довжина періодів визначається максимальною ємністю рівнів; 2, 8, 18, 32 електрони. У першому періоді 2 елементи, у другому та третьому – 8 елементів; у четвертому та п’ятому – 18 елементів; у шостому – 32 елемента; сьомий період не закінчений.
У залежності від того, на який енергетичний підрівень в атомі поступає останній електрон, елементи поділяються на s, p, d, f –елементи.
При цьому s -елементи складають I та II головні підгрупи періодичної системи (а також Н та He); р-елементи складають III, IV,V,VI,VII,VIII головні підгрупи періодичної системи елементів; d -елементи складають побічні підгрупи періодичної системи.
У s- і p-елементів валентні електрони знаходяться на зовнішньому енергетичному рівні, у d-елементів – на s-підрівні зовнішнього енергетичного рівня і передзовнішнього незавершеного d-підрівня, f-елементи у короткоперіодному варіанті періодичної системи виділені окремо.
На основі розглянутих положень можна представити розподіл електронів на енергетичних рівнях і підрівнях у атомах будь-яких елементів. Цей розподіл електронів у атомі записується у вигляді електронних формул. Щоб скласти електронну формулу атома любого елементу, слід знати номер даного елемента у періодичній системі та перелічені вище положення. Наприклад, електронна формула атома Фосфору буде складатися таким чином: атом Фосфору знаходиться у 3-му періоді, порядковий номер 15, це означає, що 15 електронів будуть розташовуватися на трьох енергетичних рівнях (15Р 1s22s22p63s23p3).
Електронна структура атома може бути зображена у вигляді розміщення електронів у квантових ячейках (атомних орбіталях). Для атома Фосфору це буде мати вигляд:
s
|
n = 1
| |
|
|
|
|





|
|
|
|
n = 3
Властивості елементів тісно пов’язані з будовою їх атомів. Періодична повторюваність властивостей елементів обумовлена періодичним повторюванням схожих електронних угруповань атомів. Наприклад, усі атоми головної підгрупи першої групи H, Li, Na, K, Rb, Cs, Fr мають на зовнішньому рівні по одному s-електрону; усі атоми елементів головної підгрупи другої групи Be, Mg, Ca, Sr, Ba, Ra – по два s-електрони (це s-елементи); атоми елементів головної підгрупи третьої групи B, AI, Ga, In, TI – два s-електрони і один p-електрон; атоми елементів головної підгрупи четвертої групи C, Si, Ge, Sn, Pb – два s-електрони і два p-електрони (тобто зовнішній енергетичний рівень цих атомів має однакову конфігурацію s2p2). Конфігурація зовнішнього енергетичного рівня атомів елементів головної підгрупи п’ятої групи – s2p3, головної підгрупи шостої групи – s2p4, головної підгрупи сьомої – s2p5, головної підгрупи восьмої – s2p6. Відповідно елементи головних підгруп III-VIII груп називаються p-елементами і належать до p-електронного сімейства. Елементи побічних підгруп належать до d-електронного сімейства. Елементи, що йдуть за Лантаном (лантаноїди) і за Актинієм (актиноїди), належать до f-електронного сімейства.
Хімічна природа елемента обумовлюється здатністю його атома губити і здобувати електрони. Ця здатність може бути кількісно оцінена енергією іонізації атома і енергією спорідненіст ю до електрона.
Енергією іонізації називають кількість енергії, що необхідна для відриву електрона від атома, який знаходиться в незбудженому стані. Спорідненістю до електрона називають енергетичний ефект процесу приєднання електрона до нейтрального атома з перетворенням його у негативно заряджений іон. Енергія іонізації є мірою металічних і у першому наближенні відновних властивостей елементів. Енергія спорідненості до електрона є мірою неметалічних і непрямих окиснювальних властивостей елементів. Найбільш повну характеристику металічних і неметалічних властивостей елементів, а також здатності атома даного елементу до відтягування на себе електронної густини у порівнянні до других елементів сполуки, дає величина, що називається електронегативністю (ЕН). Електронегативність атома може визначатися як арифметична напівсума його енергії іонізації та спорідненості до електрону. Чим більше ця величина, тим в більшій ступені елемент проявляє неметалічні властивості. Електронегативність має розмірність енергії. Користуватися її абсолютними значеннями незручно. Якщо прийняти електронегативність Літію за одиницю і порівняти з нею електронегативність інших елементів, то можна отримати прості і зручні для співставлення величини (таблиця 3).
У межах головних підгруп зверху донизу енергія іонізації, енергія спорідненості до електрона та електронегативність зменшуються, таким чином, у головних підгрупах зверху вниз збільшуються металічні властивості елементів, основні властивості гідроксидів і відновні властивості відповідних сполук.
Таблиця 3
Відносні електронегативності елементів
|
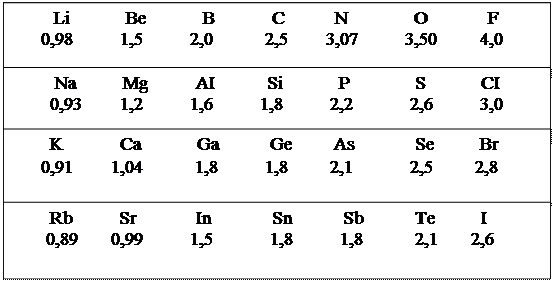
У періодах зліва направо енергія іонізації, енергія спорідненості до електрона і електронегативність збільшується. У періодах зліва направо відбувається поступове зменшення металічних і зростання неметалічних властивостей.
Найактивніший неметал – Флуор, він є найбільш сильним окисником; найактивніші метали – Рубідій, Цезій, Францій, вони є найбільш сильними відновниками, а їх гідроксиди – найсильніші основи.
Номер групи, в якій знаходиться елемент, дорівнює значенню вищого ступеня окиснення його атома. Такого ступеня окиснення можуть досягати не всі елементи даної групи (наприклад, Оксиген, Флуор). Для деяких елементів (Купрум, Аргентум, Аурум) відомі сполуки, в яких вони проявляють ступінь окиснення більший, ніж номер групи. Для неметалів нижчий ступінь окиснення відповідає числу електронів, які атому необхідно приєднати для утворення стійкої восьмиелектронної конфігурації. Так, для p-елементів VII, VI, V і IV груп вона дорівнює відповідно -1, - 2, - 3, - 4.
Форма і властивості сполук, що утворені даним елементом, визначає ступінь оксидації його атомів. Так, наприклад, формула селенової кислоти H2SeO4 аналогічна формулі сульфатної кислоти H2SO4. Властивості оксидів і гідроксидів залежать від ступеня оксидації елементів, що їх утворюють. Якщо даний елемент проявляє змінну ступінь окиснення, то із збільшенням ступеня окиснення властивості останніх змінюються від основних через амфотерні до кислотних.
s -Елементи
s -Елементами називають елементи періодичної системи, які мають будову зовнішнього енергетичного рівня ns1-2, де n – головне квантове число. Вони об’єднуються у s-електронне сімейство, яке поділяють на ns1 – (підгрупа IА) та ns2 – елементи (підгрупа IIА). Гідроген і Гелій відрізняються від типових s-елементів і більш близькі до р-елементів VII та VIII підгруп, тому їх властивості звичайно розглядають при огляді властивостей елементів цих підгруп.
s-Елементи IА-підгрупи називають лужними металами. Вони мають на зовнішньому рівні один електрон і віддають його при хімічних реакціях, таким чином, вони є активними відновниками. При збільшенні порядкового номера елемента відбувається збільшення атомного радіусу і зменшення енергії іонізації, відновлювальна активність лужних металів зростає зверху донизу в головних підгрупах періодичної системи Д.І.Менделєєва.
При взаємодії з киснем повітря тільки літій утворює оксид Li2O; натрій – пероксид Na2O2; останні лужні метали – супероксиди МеО2, оксиди добувають непрямим шляхом. Лужні метали з водою утворюють гідроксиди (луги) і водень. Усі гідроксиди лужних металів є сильними основами і добре розчиняються у воді.
Елементи IIА-підгрупи на зовнішньому енергетичному рівні мають два спарених електрони, один з яких при збудженні переходить на р-орбіталь, таким чином, валентність атомів досягає 2. Радіуси атомів IIА-підгрупи менше, ніж у лужних металів, а енергія іонізації відповідно більше, відновлювальні властивості також, як у лужних металів, збільшуються зверху донизу у періодичній системі Д.І.Менделєєва.
Перші два елементи підгрупи – Берилій і Магній – відрізняються за своїми властивостями від інших елементів. Берилій за властивостями наближується до Алюмінію, оксид і гідроксид Берилію амфотерні. Берилій окиснюється киснем лише з поверхні, не реагує з водою. Магній взаємодіє з водою лише при нагріванні, його гідроксид є основою середньої сили. Останні елементи IIА-підгрупи при взаємодії з киснем утворюють оксиди МеО, які при розчиненні у воді утворюють луги, у зв’язку з чим метали IIА-підгрупи, починаючи з Кальцію, називають лужно-земельними. Розчинність і основні властивості гідроксидів лужно-земельних металів зростають зверху донизу в групі у періодичній системі Д.І.Менделєєва.
р-Елементи
До р-сімейства відносять елементи, в яких останній валентний електрон займає р-підрівень зовнішнього рівня. Тобто, елементи, що стоять у головних підгрупах III-VIII груп періодичної системи Д.І.Менделєєва, є р-елементами і загальна електронна формула їх ns2np1-6, де n – головне квантове число.
Найважливіші властивості елементів – валентність, окисно-відновна здатність, металічний і неметалічний характер – обумовлюються будовою їх атомів. Із збільшенням порядкового номеру елементу в періоді зростає енергія іонізації, енергія спорідненості до електрону і електронегативність у р-елементів. У підгрупах р-елементів зверху донизу константи зменшуються, тому що із збільшенням числа електронних шарів розміри атомів, як правило, збільшуються, і зовнішні валентні електрони знаходяться далі від позитивного ядра.
Валентні електрони р-елементів розташовані на зовнішньому енергетичному рівні, при цьому максимальна валентність дорівнює сумі зовнішніх s- і р-електронів і визначає номер групи елемента (виключення – атоми Нітрогена, Флуору, Оксигену).
Більшість р-елементів відноситься до неметалів, тому що на зовнішньому рівні у них знаходиться три і більше електронів. Такі елементи, як AI, Ge, Pb, Sb, Bi та ін. умовно розглядають як металічні, хоч вони зберігають багато властивостей неметалів.
Валентність р-елементів при утворенні гідрогенових сполук відповідає числу електронів, які необхідно приєднати до атому для завершення стійкої 8-електронної зовнішньої оболонки.
При зростанні порядкового номера р-елементів у межах групи зверху донизу неметалічні властивості зменшуються, а металічні зростають, отже, основні властивості оксидів і гідроксидів посилюються, а кислотні зменшуються. Якщо р-елемент проявляє змінний ступінь оксидації, то із зростанням ступеня оксидації збільшуються кислотні властивості його оксидів і гідроксидів.
Атоми р-елементів ви являють змінну валентність, при цьому для атомів, що належать до парних груп періодичної системи Д.І.Менделєєва, вона - парна, а у непарних групах – непарна. Це явище пояснюється розпарюванням р-електронів при збудженні. На відміну від елементів s- (крім Гідрогену), d-сімейств, що проявляють здебільшого відновні властивості, р-елементи можуть виявляти окисно-відновну двоїстість, тому що вони мають на зовнішньому рівні від трьох до восьми електронів.У зв’язку з цим більшість р-елементів схильна до реакції диспропорціювання, де один і той же елемент є окисником і відновником. Для кислот, утворених р-елементами, у проміжному ступені оксидації також характерна реакція диспропорціювання.
d –Елементи
Загальна електронна формула елементів d-сімейства (n-1)d1-10ns1-2, де n - головне квантове число. d -Елементи складають побічні підгрупи періодичної системи Д.І.Менделєєва, їх називають перехідними . Усі 32 елементи цього сімейства є метали, тому що їх атоми на зовнішньому енергетичному рівні містять один або два електрони (за виключенням Паладію). Внаслідок цього атоми перехідних елементів мають порівняно невисокі потенціали іонізації і у сполуках, як і s-елементи, виявляють тільки позитивні ступені оксидації. Однак між металами головних і побічних підгруп є і суттєва різниця: для утворення хімічних зв’язків атоми перехідних елементів можуть використовувати не тільки зовнішній електронний шар (як s-елементи), але також й d-електрони і вільні d-орбіталі передостаннього шару. Тому для більшості d-елементів характерний цілий ряд ступенів оксидації, кислотно-основних і окисно-відновних властивостей.
Мінеральні речовини
Багато елементів у вигляді мінеральних солей, іонів, комплексних сполук і органічних речовин входять до складу живої матерії і є незамінними нутрієнтами, які повинні щоденно застосовуватися з їжею. Роль мінеральних речовин в організмі різноманітна.
Мінеральні речовини поруч з білками, вуглеводами і вітамінами є життєво важливими для побудови хімічних структур живих тканин, для біохімічних і фізіологічних процесів, що лежать в основі життєдіяльності організму. З ними пов’язані процеси кровотворення і зсідання крові. Крім того, вони входять до складу або активізують дію ферментів, гормонів, вітамінів і, таким чином, приймають участь в усіх видах обміну речовин.
Терміновий дефіцит або, напроти, надлишок мінеральних речовин веде до порушення обміну речовин і захворювання живого організму.
В залежності від кількості мінеральних речовин в організмі людини і продуктах харчування їх поділяють на макро- та мікроелементи. Так, якщо масова частка елемента в організмі перевищує 10-2%, то його слід вважати макроелементом . Частка мікроелементів в організмі становить 10-3 – 10-5%. Якщо вміст елемента нижче ніж 10-5%, його вважають ультрамікроелементом.
Серед s-елементів до макроелементів відносять атоми Калію, Натрію, Кальцію, Магнію. Серед s-елементів до мікроелементів відносять атоми Стронцію, Літію, Барію та ін..
Атоми Літію зменшують вміст холестерину в крові, знижують артеріальний тиск. Недостатня кількість атомів Літію сприяє розвитку психозів, шизофренії. Солі Літію викликають деяке збільшення хронічної коронарної недостатності, при церозі і первинному ракові печінки.
Натрій – це важливий міжклітинний і внутрішньоклітинний елемент, атоми якого приймають участь у створенні необхідної стабільності крові, вони регулюють кров’яний тиск, водний обмін, активізують травні ферменти, регулюють діяльність нервових і м’язових тканин. Потреба людини – 4 – 6 г Натрію на добу, що відповідає 10 – 15 г кухонної солі. Харчові продукти раціону не забезпечують потребу людини в атомах Натрію, тому їжу підсолюють. Найбільше атомів Натрію міститься (мг/100 г) в житньому хлібі – 701, в сирах – 606, в яйцях – 143, в молоці – 51. Надлишок атомів Натрію перевантажує нирки, серце, підвищує кров’яний тиск, тому не слід вживати його більше 4 г на добу.
Калій – іони виявляють сечогінні властивості. Атоми Калію регулють кислотно-лужну рівновагу в крові. Вони приймають участь в системі нервових імпульсів, активізують роботу деяких ферментів. Вважається, що атоми Калію мають захисні властивості проти небажаної дії надлишку атомів Натрію і нормалізують тиск крові.
Атоми Калію – підвищують тонус м’язів серця, регулюють виділення води з організму, збуджують органи кровообігу. Добова потреба людини – 2 – 3 г атомів Калію. Багато атомів Калію міститься (мг/100 г) в сушених абрикосах (курага), – 1780, в квасолі – 1144, в картоплі – 429, в м’ясі воловому – 338, в яблуках – 248.
Атоми Кальцію утворюють структурну основу костного скелету, впливають на проникність клітинних мембран, стискують стінки ссудин, приймають участь в процесах згортання крові. Вони впливають на нервово-м’язову збудженість, кислотно-основну рівновагу, функцію ендокринних залоз, активізують ряд ферментів, сприяють протизапальній дії. Добова потреба дорослої людини становить 800 мг атомів Кальцію. Найбільше атомів Кальцію містять (мг/100 г) кисломолочні сири – 140, молоко – 118, крупи вівсяні – 65.
Атоми Магнію є активними каталізаторами ферментативних процесів, приймають участь у вуглеводному обміні, побудові кісток та зубів, регулюють нормальну збудливість нервової системи. В організмі вони тісно пов’язані з обміном атомів Кальцію і Фосфору. Частина атомів Магнію міститься в кістках, а друга – у вигляді йонів усередині клітин. Добова потреба людини – 400 мг. Надлишок атомів Магнію знижує засвоюваність атомів Кальцію. Оптимальним між атомами Кальцію і Магнію є співвідношення 1:0,5. Джерелом атомів Магнію для людини є хліб та круп’яні вироби. Значну кількість атомів Магнію містять горіхи та овочі.
Серед р-елементів до макроелементів відносять атоми Карбону, Нітрогену, Фосфору, Хлору, Оксигену, Сульфуру. Серед р-елементів до мікроелементів відносять атоми Кремнію, Йоду, Брому, Фтору, Алюмінію, Селену.
Атоми Карбону входять до складу усіх тканин і клітин у формі білків, жирів, вуглеводів, вітамінів, гормонів.
Атоми Нітрогену – складова частина амінокислот, білків, вітамінів, гормонів.
Атоми Фосфору відіграє значну роль в обміні речовин, бере участь у побудові кісткової тканини, зубів, входить до складу нуклеїнових кислот, коферментів, фосфоліпідів, які є основними компонентами клітинних мембран. Добова потреба становить приблизно 1200 мг фосфору. Основним джерелом Фосфору є молоко та хліб. Атоми Фосфору містить сир голландський – 544 мг/100 г, квасоля - 541мг/100 г, крупа вівсяна – 360 мг/100 г, печінка волова – 342 мг/100 г. Багато Фосфору міститься в рибі, м’ясі, квасолі, горосі. Треба мати на увазі, що надлишок атомів Фосфору в організмі призводить до втрати кістками атомів Кальцію, а надлишок атомів Кальцію – призводить до сечокам’яної хвороби. Оптимальним між атомом Кальцію і атомом Фосфору є співвідношення 1:1,5.
Атоми Алюмінію впливають на ферментативні процеси, розвиток тканин, на обмін атомів Фосфору.
Оксиген належить до числа найважливіших елементів, становить основу живих систем. Окиснення оксигеном поживних речовин – вуглеводів, білків, жирів є основою джерела енергії, необхідної для роботи органів і тканин живих організмів.
Сульфур життєво необхідний макроелемент, входить до складу багатьох біологічних молекул – білків, амінокислот, гормонів, вітамінів. Людині на добу потрібно 1 г атомів Сульфуру, що задовольняється білоквмісними харчовими продуктами (м’ясо, риба, яйця).
Атоми Селену в комплексі з якою - небудь кислотою входять до складу активних центрів декількох ферментів, які можуть захищати клітини від руйнівної дії органічних пероксидів та Н2О2.
Галогени у вигляді різних сполук входять до складу тканин людини і тварини. Атоми Хлору та Йоду є незамінними елементами, вони є постійними складовими частинами тканин.
Хлор – макроелемент, разом з атомами Натрію забезпечує утворення хлоридної кислоти соку шлунку, регулює тиск крові. Добова потреба людини – 2 г, але з сіллю його надходить 6 – 9 г, що шкодить організму. Тому в багатьох випадках рекомендують використовувати кухонну сіль в обмеженій кількості. Порівняно багато атомів Хлору міститься (мг/100 г) в сирах – 880, в яйцях – 106, в молоці – 106, в м’ясі воловому - 76.
Флуор– це мікроелемент, необхідний для формування зубів. Брак атомів Фтору викликає їх карієс, а надлишок – плямистість емалі і дистрофію. Людина отримує на добу з водою 1 – 1,5 мг атомів Флуору, з їжею – 0,23 – 0,35 мг Там, де вміст атомів Фтору в воді становить 0,7 і менше мг/дм3, – поширюється хвороба зубів – так званий карієс. Вивчаючи хімічний склад здорових та уражених зубів, вчені помітили, що при карієсі майже наполовину менше атомів Флуору в зубах. Людина отримує на добу з водою 1 – 1,5 мг атомів Флуору, з їжею – 0,23 – 0,35 мг.
Атоми Йоду– беруть участь в утворенні гормону щитовидної залози. При їх нестачі розвивається зобна хвороба. Добова потреба людини – 100 – 260 мкг. Атоми Йоду містяться в рослинних і тваринних продуктах морських районів. На кількість атомів Йоду в продуктах впливає їх вміст у грунті території, з якої збирався урожай. У випадку продуктів, бідних на атоми Йоду, щоб попередити захворювання на зоб, застосовують йодовану сіль.
Земна поверхня містить 3.10-3 процентів атомів Брому. А на поверхні в грунтах його трохи менше – 2.10-4 процентів. У повітрі атомів Брому більше порівняно з іншими мікроелементами. Рослини мають здатність вбирати атоми Брому із зовнішнього середовища, тому концентрація цього мікроелемента в наземних рослинах на півпорядка вища, ніж у грунтах, а в морських водоростях майже на півтора порядка більше, ніж у морській воді. В організм людини атоми Брому надходять переважно з харчовими продуктами тваринного походження, які містять його більше, ніж продукти рослинного походження.
Організм дорослої людини потребує цього елемента 2,0 – 3,0 мг на добу.
При різних патологічних станах організму, коли порушується нормальне співвідношення між процесами збудження та гальмування в корі мозку, атоми Брому нормалізують діяльність кори і нервової системи в цілому.
Плюмбум, Станум – ультрамікроелементи. В продукти харчування ці елементи потрапляють з різних джерел, наприклад, атоми Плюмбуму – від посуду, припоїв, обладнання, газів автотранспорту; атоми Стануму – від полуди металевих банок. Атоми Плюмбуму і Стануму містяться в деяких продуктах переважно тваринного походження в кількості: Атоми Плюмбуму – 0,05 – 0,1 мг/кг, атоми Стануму – в тих же продуктах в кількості 0,003 - 0,006 мг/кг. У таких пропорціях вони не шкодять організму людини.
Серед d-елементів до мікроелементів відносять атоми Феруму, Кобальту, Купруму, Хрому, Цинку, Молібдену, Мангану, Ніколю.
Атоми Хрома входять до складу рослинних і тваринних організмів. Атоми Молібдена входять до складу різних ферментів. Атоми Манган входять до складу неорганічних сполук організму. Атоми Ферума містяться у тканинах рослин і тварин. Атоми Кобальта входять до складу вітаміну В12. Купрум – необхідний мікроелемент живих організмів.
Дата добавления: 2018-09-20; просмотров: 293; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
