Перелік тем контрольної роботи
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ЕКОНОМІКИ І ТОРГІВЛІ
ІМЕНІ МИХАЙЛА ТУГАН-БАРАНОВСЬКОГО
КАФЕДРА ХІМІЇ
Ю.А. Горяйнова, Л.В. Дуленко, Л.Ф. Пікула
ХАРЧОВА ХІМІЯ
(1 частина)
Методичні рекомендації щодо самостіного вивчення курсу і
виконання контрольних робіт
для студентів заочної форми навчання
факультету ресторанно-готельного бізнесу
напряму підготовки 6.051701 – «Харчові технології та інженерія»
Донецьк - 2011
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ЕКОНОМІКИ І ТОРГІВЛІ
ІМЕНІ МИХАЙЛА ТУГАН-БАРАНОВСЬКОГО
КАФЕДРА ХІМІЇ
Ю.А. Горяйнова, Л.В. Дуленко, Л.Ф. Пікула
ХАРЧОВА ХІМІЯ
(1 частина)
Методичні рекомендації щодо самостіного вивчення курсу і
виконання контрольних робіт
для студентів заочної форми навчання
факультету ресторанно-готельного бізнесу
напряму підготовки 6.051701 – «Харчові технології та інженерія»
ЗАТВЕРДЖЕНО
на засіданні кафедри хімії
Протокол № 21 від 14.06.11 р.
СХВАЛЕНО
навчально-методичною
|
|
|
радою ДонНУЕТ
Протокол № від 2011 р.
Донецьк - 2011
ББК 24я73
Г71
УДК 542/543 (076.5)
Рецензенти:
канд.хім.наук, доцент кафедри хімії ДонНУЕТ А.В. Іщенко
докт.хім.наук, завідувач кафедри аналітичної хімії ДонНУ А.С. Алємасова
Горяйнова Ю.А.
Г71 Харчова хімія. 1 частина [Текст]:метод. реком. до самостоят. вивчення курсу і виконання контр. робіт для студентів заоч. форми навчання фак. ресторанно-готельного бізнесу напр. підготовки 6.051701 – «Харчові технології та інженерія»:/ Ю.А. Горяйнова, Л.В. Дуленко, Л.Ф. Пікула; М-во освіти і науки, молоді та спорту України, Донец. нац. ун-т економіки і торгівлі ім. М. Туган-Барановського; Каф. хімії. – Донецьк: [ДонНУЕТ], 2011. - 88с.
Методичні рекомендації містять загальні вказівки щодо виконання контрольної роботи з харчової хімії (1 частина), перелік тем, вибір завдань та порядок виконання контрольної роботи, а також основні теоретичні положення та приклади розв’язання типових задач, список літератури.
|
|
|
ББК 24я73
© Колектив авторів, 2011
© Донецький національний університет
економіки і торгівлі
імені Михайла Туган-Барановського, 2011
В С Т У П
Методичні рекомендації для самостійного вивчення курсу та виконання контрольних робіт підготовлені у відповідності з робочою програмою курсу «Харчова хімія» та призначені для студентів заочної форми навчання факультету ресторанно-готельного бізнесу напряму підготовки 6.051701 – «Харчові технології та інженерія».
Харчова хімія – це один з розділів хімічної науки. Це наука, яка вивчає хімічний склад харчових систем (а саме – сировини, напівпродуктів, готових харчових продуктів), його зміни в процесі технологічного процесу під впливом різних факторів (фізичних, хімічних, біохімічних тощо). Харчова хімія вивчає взаємозв’язок структури і властивостей харчових речовин.
|
|
|
Курс «Харчова хімія» (1 частина) розглядає питання загальної, неорганічної та аналітичної хімії, складається з чотирьох змістових модулів:
1. Основні поняття та закони хімії. Хімія елементів.
2. Розчини.
3. Якісний аналіз харчових продуктів.
4. Кількісний аналіз харчових продуктів.
Вивчаючи цю дисципліну, студент повинен навчитися користуватися навчальною, довідковою, спеціальною та періодичною літературою.
Мета даних методичних рекомендацій полягає у наданні методичної допомоги студентам заочної форми навчання в процесі самостійного вивчення курсу “Харчова хімія” і виконання ними контрольної роботи.
Порядок виконання контрольної роботи
Після засвоєння теоретичного матеріалу студент повинен приступити до виконання контрольної роботи, а потім пройти за результатами її виконання усну співбесіду з викладачем.
Вирішування задач і відповіді на запитання у контрольній роботі необхідно обгрунтовувати з використанням основних теоретичних положень. При вирішенні числових задач необхідно наводити весь хід рішення і математичного перетворення.
|
|
|
Контрольна робота виконується студентом в окремому учнівському зошиті. Вона повинна бути акуратно оформлена. Номера і умови задач студент повинен переписати у тому порядку, який вказаний в контрольній роботі відповідно до умов пошуку індивідуального варіанта.
В кінці роботи наводиться перелік літератури, якою студент користувався, а саме: наводяться прізвища авторів, потім вказується найменування підручника, видавництво, рік видання, кількість сторінок. Робота підписується студентом і ставиться дата її виконання.
Перелік тем контрольної роботи
1. Основні поняття та закони хімії.
2. Будова атома. Мінеральні речовини. Макро- та мікроелементи.
3. Хімічна кінетика та хімічна рівновага.
4. Рідкі розчини. Способи виразу концентрації розчинів. Розчини електролітів та гідроліз солей.
5. Окисно-відновні реакції.
6. Комплексні сполуки.
7. Якісний аналіз катіонів та аніонів харчових продуктів.
8. Основи гравіметричного (вагового) аналізу.
9. Методи виділення, відгонки та осадження.
10. Методи кислотно-основного титрування.
11. Методи окисно-відновного титрування.
12. Метод комплексонометричного титрування.
Вибір запитань контрольної роботи
Вибір запитань контрольної роботи визначається за першими п’ятьма літерами прізвища студента, першими чотирма літерами його імені і першими трьома літерами по батькові (таблиця 1).
Таблиця 1
Номера питань контрольної роботи
| Літери абетки | Перші п’ять літер прізвища | Перші чотири літери імені | Перші три літе ри по батькові | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
| А | Н | 1 | 16 | 31 | 46 | 61 | 76 | 91 | 106 | 121 | 136 | 151 | 166 |
| Б | О | 2 | 17 | 32 | 47 | 62 | 77 | 92 | 107 | 122 | 137 | 152 | 167 |
| В | П | 3 | 18 | 33 | 48 | 63 | 78 | 93 | 108 | 123 | 138 | 153 | 168 |
| Г | Р | 4 | 19 | 34 | 49 | 64 | 79 | 94 | 109 | 124 | 139 | 154 | 169 |
| Д | С | 5 | 20 | 35 | 50 | 65 | 80 | 95 | 110 | 125 | 140 | 155 | 170 |
| Е | Т | 6 | 21 | 36 | 51 | 66 | 81 | 96 | 111 | 126 | 141 | 156 | 171 |
| Є | У | 7 | 22 | 37 | 52 | 67 | 82 | 97 | 112 | 127 | 142 | 157 | 172 |
| Ж | Ф | 8 | 23 | 38 | 53 | 68 | 83 | 98 | 113 | 128 | 143 | 158 | 173 |
| З | Х | 9 | 24 | 39 | 54 | 69 | 84 | 99 | 114 | 129 | 144 | 159 | 174 |
| И | Ц | 10 | 25 | 40 | 55 | 70 | 85 | 100 | 115 | 130 | 145 | 160 | 175 |
| І, Ї | Ч | 11 | 26 | 41 | 56 | 71 | 86 | 101 | 116 | 131 | 146 | 161 | 176 |
| Й | Ш, Щ | 12 | 27 | 42 | 57 | 72 | 87 | 102 | 117 | 132 | 147 | 162 | 177 |
| К | Ь | 13 | 28 | 43 | 58 | 73 | 88 | 103 | 118 | 133 | 148 | 163 | 178 |
| Л | Ю | 14 | 29 | 44 | 59 | 74 | 89 | 104 | 119 | 134 | 149 | 164 | 179 |
| М | Я | 15 | 30 | 45 | 60 | 75 | 90 | 105 | 120 | 135 | 150 | 165 | 180 |
Виходячи з перших п’яти літер прізвища підбирають відповідні літерам номери запитань колонок цифр №,№ 1, 2, 3, 4, 5 таблиці 1. Потім з колонок №,№ 6, 7, 8, 9 за першими чотирма літерами імені підбирають ще чотири запитання. Останні три запитання контрольної роботи беруть з колонок №,№ 10, 11, 12, виходячи з перших трьох літер по батькові.
Наприклад:
П а р а м онова І р и н а С е р гіївна
3, 16, 34, 46, 75, 86, 94, 115, 121 140, 156, 169
Якщо прізвище містить менше, ніж п’ять літер, то відповідні запитання слід підбирати за першими літерами імені.
Якщо ім’я містить менше, ніж чотири літери, то відповідні запитання слід підбирати за першими літерами по батькові.
ЗМІСТОВИЙ МОДУЛЬ 1.
ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ.
ХІМІЯ ЕЛЕМЕНТІВ
Тема 1. Основні поняття та закони хімії.
Усі речовини навколишнього світу поділяються на прості та складні. Вони побудовані з хімічних елементів, які в свою чергу складаються з атомів.
Хімічний елемент – сукупність атомів з однаковим позитивним зарядом ядра.
Прості речовини – речовини, що складаються з атомів одного елемента або з атомів одного виду. Наприклад: Cl2, О2, О3, Zn та інші.
Складні речовини – речовини, що складаються з атомів різних елементів. Наприклад: НClО3, МnО2 та інші.
Атом– найменша хімічно неділима частинка хімічного елемента і простої речовини, що зберігає всі його хімічні властивості.
При хімічному сполученні атомів утворюються молекули.
Молекула – хімічна комбінація декількох атомів.
Молекула– найменша хімічно ділима частинка речовини, що зберігає всі її хімічні властивості.
Іон – атом (або молекула), що набули електричний заряд у результаті віддачі або приєднання електронів.
Аl – 3ē = Аl3+ (катіон Алюмінію)
Cl + ē = Cl– (аніон Хлору)
Ступінь окиснення - формальний заряд на атомі в молекулі в припущенні, що всі зв'язки в ній іонного типу.
Молекула характеризується якісним і кількісним складом, хімічною будовою і масою. На письмі молекулу можна зобразити за допомогою молекулярної та структурної формул.
Молекулярна формула – хімічна формула, що вказує дійсну кількість атомів кожного сорту в молекулі. Наприклад, формула С2Н6О показує, що наведена молекула складається з двох атомів Карбону, шести атомів Гідрогену і одного атома Оксигену.
Структурна формула – молекулярна формула, що враховує взаємне розташування атомів у молекулі і їхню валентність.
В таких формулах за допомогою рисочок позначають одинарний хімічний зв’язок між атомами.
Наприклад, молекула С2Н6О може мати таку структурну формулу:
Н Н Ця будова відповідає речовині –
| | етиловий спирт з певними властивостями.
 Н–С–С–О–Н
Н–С–С–О–Н

Н Н
Наведеній молекулярній формулі С2Н6О може відповідати і інша структурна формула, яка показує, що існують інші варіанти сполучення атомів між собою (зі збереженням тих же валентностей атомів):

 Н Н Це означає, що існує інша речовина,
Н Н Це означає, що існує інша речовина,
диметиловий етер, з таким же складом,

 Н–С–О–С–Н як і етиловий спирт, але з іншою просторовою
Н–С–О–С–Н як і етиловий спирт, але з іншою просторовою
будовою і з іншими властивостями.
Н Н
Емпірична (найпростіша) формула – хімічна формула, що вказує типи атомів у молекулі і їх кількісне співвідношення.
Так, речовина глюкоза має молекулярну формулу С6Н12О6, але їй відповідає емпірична формула СН2О, яка показує, що в цій сполуці елементи Карбон, Гідроген і Оксиген знаходяться в співвідношенні 1:2:1.
Хімічне рівняння – відображення реакції у вигляді рівняння, в якому в обох частинах знаходиться однакова кількість атомів кожного елемента. Якщо в рівнянні присутні іони, то суми зарядів у лівій і правій частинах однакові.
Атоми, молекули, іони дуже маленькі частинки, їх абсолютними масами незручно користуватися, тому вводять поняття відносних мас. Маси атомів і молекул вимірюють відносно атомної одиниці маси.
Атомна одиниця маси (а.о.м.)– 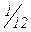 частина маси атома Карбону 12С, що дорівнює 1,66×10-24 г.
частина маси атома Карбону 12С, що дорівнює 1,66×10-24 г.
1 а.о.м. = 1,66×10-24 г.
Атомна маса – середня маса атомів елемента нормального ізотопного складу, що виражається в а.о.м. Більш повне визначення формулюється так:
Відносна атомна маса елемента або просто атомна маса елемента А r (Х) – це відношення середньої маси атомів природної суміші ізотопів певного елемента до 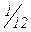 частини маси атома Карбону 12С.
частини маси атома Карбону 12С.
Відносна атомна маса показує, у скільки разів маса атома даного елемента більше 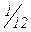 маси атома Карбону. Відносна атомна маса – це безрозмірна величина. Аr(Н) =1,01 тому, що маса атома Гідрогену приблизно дорівнює масі
маси атома Карбону. Відносна атомна маса – це безрозмірна величина. Аr(Н) =1,01 тому, що маса атома Гідрогену приблизно дорівнює масі 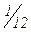 частини атома Карбону. Аr(Fe) = 55,85. Це означає, що атом Феруму майже у 56 разів важче за
частини атома Карбону. Аr(Fe) = 55,85. Це означає, що атом Феруму майже у 56 разів важче за 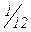 частину атома Карбону і у 56 разів важче атома Гідрогену.
частину атома Карбону і у 56 разів важче атома Гідрогену.
Формульна маса – маса сукупності атомів у хімічній формулі, виражена в а.о.м. Якщо хімічна формула – молекулярна, то формульна маса збігається з відносною молекулярною масою.
Відносна молекулярна маса – маса молекули речовини, що виражена в а.о.м.
Відносна молекулярна масаМr(AxBy) – це відношення маси молекули АxBy до 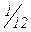 частини маси атома Карбону 12С.
частини маси атома Карбону 12С.
Відносна молекулярна маса складається з відносних мас атомів, що входять до складу молекули.
Мr(AxBy) = Ar(A) × x + Ar(B) × y
Наприклад, відносна молекулярна маса фосфатної кислоти дорівнює:
Mr(Н3 РO4) =Ar(Н) × 3+ Ar(Р)+ Ar(О) × 4 =3+31+16 × 4 = 98.
Це означає, що молекула фосфатної кислоти у 98 раз важче, ніж 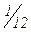 частина атома Карбону.
частина атома Карбону.
Зверніть увагу на те, що молекулярна маса подвійних солей або кристалогідратів складається з молекулярних мас їх складових, як в прикладі із сіллю Мора. Маси усіх елементів такої складної сполуки складаються, а не перемножуються. Не треба крапки в цих формулах вважати знаком множення. Молекулярна маса солі Мора:
Mr(( N Н4)2 SO 4 · FeSO 4 ·5 H 2 0)=Mr(( N Н4)2 SO 4 )+ M ( FeSO 4 )+ M ( H 2 0)·5=
=14·2+8+32+16·4+56+32+16·4+18·5=374
У практичній діяльності оперують не окремими атомами і молекулами, а значно більшими кількостями речовини. Тому було введено поняття “кількість речовини”.
Кількість речовини(n або ν) – фізичне поняття, що пов’язане з певним числом структурних одиниць речовини, виражається в молях (моль).
Моль – це така кількість речовини, яка містить стільки ж структурних одиниць (молекул, атомів, іонів, електронів тощо), скільки атомів міститься в 0,012 кг ізотопа Карбону 12С.
В 0,012 кг Карбону міститься 6,02×1023 атомів 12С. 1 моль будь-якої речовини містить таку ж кількість структурних одиниць. Це число називають числом Авогадро і позначають NА
NА = 6,02 × 1023 моль-1 .
Наприклад, 1 моль води містить 6,02×1023 молекул Н2О,
2 моль іонів РO43- – 12,04×1023 іонів РO43-,
0,5 моль заліза – 3,01×1023 атомів Fe.
Молярна маса речовини(М) – маса одного моль речовини, що виражена в грамах. Чисельні значення молярної М (г/моль) і молекулярної Мr мас збігаються.
Молярна маса речовини Х дорівнює відношенню маси речовини до кількості речовини
М(Х) = 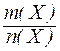
Відповідно, кількість моль речовини можна розрахувати за формулою:
n(Х) = 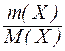
Еквівалент– це така формальна частинка (реальна або умовна частина атома, молекули, іона, наприклад, 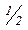 Zn, 1Cl,
Zn, 1Cl, 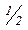 Cl2,
Cl2, 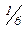 Ca3(PO4)2, ⅓Al3+), що рівноцінна за своєю хімічною дією одному атому Гідрогену в даній реакції, одному іону Гідрогену (Н+) в кислотно-основній реакції, одному електрону (е) в окисно-відновній реакції.
Ca3(PO4)2, ⅓Al3+), що рівноцінна за своєю хімічною дією одному атому Гідрогену в даній реакції, одному іону Гідрогену (Н+) в кислотно-основній реакції, одному електрону (е) в окисно-відновній реакції.
Усі названі частинки еквівалентні (рівноцінні) тому що усі вони, як і атом Гідрогену, в реакціях можуть прийняти або віддати тільки один електрон.
Еквівалент елемента Х має символ 1/z Х, де z- валентність або ступінь окиснення даного елемента в якійсь сполуці (або заряд його іона).
Визначимо, наприклад, еквівалент цинку та алюмінію. Так при взаємодії з хлоридною кислотою 1 атом Цинку витискує 2 атома Гідрогену; 2 атома Алюмінію витискують 6 атомів Н.
Zn + 2 НСl → ZnСl2 + Н2
2 AI + 6 НСl → 2 AIСl3 + 3Н2
Зрозуміло, що одному атому Гідрогена (Н) відповідає половина атома Цинку та третя частина атома Алюмінію. В сульфатній кислоті сульфат-аніон з’єднується з двома атомами Гідрогену, тоді одному атому Гідрогену (Н) відповідає половина іона SO42-.
Тому еквівалент Цинку позначають – 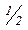 Zn ,
Zn ,
еквівалент Алюмінію – ⅓ Al,
еквівалент сульфат-іона – 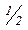 SO42- тощо.
SO42- тощо.
Еквівалент речовини характеризується еквівалентною масою (в ранніх виданнях еквівалентна маса позначається літерою Е). Оскільки еквівалентом Цинку є половина атома Цинку, то його еквівалентна маса – половина маси атома Цинку. Цю величину також можна вважати безрозмірною величиною, як і атомну масу.
У системі СI основною одиницею кількості речовини є моль. Моль відноситься до будь-яких видів елементарних частинок, з яких побудована речовина. Оскільки еквівалент є формальною частинкою, то одиницею його кількості також є моль.
n(1/z Х) - кількість молів еквівалентів.
Наприклад, n( 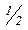 Zn ) = 0,1 моль, n( ⅓ Al ) = 0,05 моль
Zn ) = 0,1 моль, n( ⅓ Al ) = 0,05 моль
Еквівалентна кількість речовини (чисельно збігається з еквівалентом, але на відміну від цієї безрозмірної величини вимірюється в молях) – це така кількість речовини, яка з'єднується з 1 молем атомів Гідрогену (або заміщає таку ж їх кількість) в хімічних реакціях.
Наприклад, з 1 молем Н взаємодіє 0,5 моль атомів Zn , ⅓моля атомів Al, 0,5 моль іонів SO42-. Це і є еквівалентна кількість Цинку, Алюмінію, сульфат-іонів.
1 моль еквівалентів речовини характеризується молярною масою еквівалента речовини.
Молярна маса еквівалента речовини М(1/zХ) - маса одного моль еквівалентів речовини Х, що виражається у грамах.
Для будь-якого елемента:
М(1/z Х) = 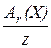 [ г/моль],
[ г/моль],
де Аr – атомна маса елемента Х,
z – валентність елемента або ступінь окиснення його в
якійсь сполуці (або заряд його іона).
Таким чином, кількість еквівалентів якоїсь речовини вимірюється в молях, а молярна маса еквівалента речовин – у г/моль.
Так, наприклад, маса молю еквівалента Цинку дорівнює 32,68 г, тобто
М( 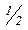 Zn) =
Zn) = 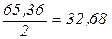 г/моль,
г/моль,
маса молю еквіваленту Алюмінію – 9 г, тобто
М( ⅓ AI) = 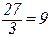 г/моль тощо.
г/моль тощо.
Аналогічно тому, як знаходять кількість моль речовини через масу і молярну масу речовини, можна знайти кількість моль еквівалента речовини як відношення всієї маси речовини до маси одного еквівалента:
n(1/zХ) = 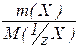 і М( 1/z Х) =
і М( 1/z Х) = 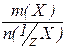 .
.
Якщо елемент виявляє різну валентність, то молярна маса його еквівалента є непостійною величиною.
Молярна маса еквівалента складної речовини теж може мати різні значення і залежить від реакції, в якій бере участь ця речовина.
Молярна маса еквівалента кислоти М(1/z НхAn ) дорівнює молярній масі кислоти, що поділена на її основність у даній реакції, тобто на кількість атомів водню (z), що прореагували у даній реакції.
М(1/z НхAn) = 
Для реакції H2SO4 + Са(ОН)2 = CaSO4 + 2H2O
М(1/z H2SO4) = 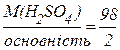 = 49 г/моль, z =2.
= 49 г/моль, z =2.
Молярна маса еквівалента гідроксиду (основи) M(1/z Me(OH)х) дорівнює молярній масі гідроксиду, що поділена на його кислотність (z), тобто на кількість груп ОН, які прореагували у даній реакції.
M(1/zMe(OH)х)= 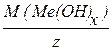 ,
,
Наприклад, для наведеної вище реакції
М(1/z 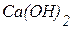 ) =
) = 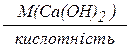 =
= 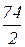 = 37 г/моль, z =2.
= 37 г/моль, z =2.
А для реакції HCl + Ca(OH)2 = Ca(OH)Cl + H2
кислотність лугу Ca(OH)2 - 1 тому, що тут кислоти взято недостатньо і прореагувала тільки одна група ОН, з реакції також видно, що один іон Н+ є еквівалентним одній молекулі Ca(OH)2, це означає:
М(1/z 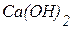 ) =
) = 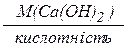 =
= 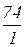 =74 г/моль, z =1.
=74 г/моль, z =1.
Молярна маса еквівалента солі М(1/z MenAnm)  дорівнює молярній масі солі, що поділена на добуток числа іонів (металу або аніона) та їх заряд за модулем.
дорівнює молярній масі солі, що поділена на добуток числа іонів (металу або аніона) та їх заряд за модулем.
М(1/z MenАnm) = 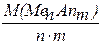 , де z = n×m
, де z = n×m
М(1/zCr2(SO4)3) = 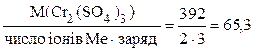 г/моль, z = 6.
г/моль, z = 6.
Молярна маса еквівалента оксиду М(1/z MenOm) дорівнює молярній масі оксиду, що поділена на подвоєне число атомів Оксигену в даній сполуці, наприклад:
М(1/z MenOm) = 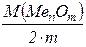 , де z = 2. m
, де z = 2. m
М(1/z S О 2 ) = 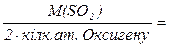
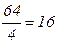 г/моль, z =2.
г/моль, z =2.
Молярну масу еквівалента будь-якої складної речовини можна також розрахувати як суму молярних мас еквівалентів складових частин цієї речовини.
Наприклад, молярну масу еквівалента оксиду можна розрахувати як суму молярних мас еквівалентів елементів, що входять до складу даного оксиду:
М(1/ z SО 2 )=М(1/ zS )+M(1/ z O)= 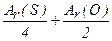 = 8 +8 =16 г/моль.
= 8 +8 =16 г/моль.
Основні закони хімії
До основних законів хімії відносяться: закон збереження маси речовини, закон сталості складу речовини, закон кратних відносин газів, закон Авогадро, закон еквівалентів, газові закони.
Закон збереження маси – маса речовин, що вступили в реакцію, дорівнює масі продуктів реакції.
Закон збереження маси речовин є слідством з закону збереження маси та енергії при деяких спрощеннях.
Цей закон є основою при написанні хімічних рівнянь. З нього витікає, що кількість атомів кожного елемента до реакції (зліва в рівнянні) повинна дорівнювати кількості атомів після протікання реакції (зправа), що і виконується при правильному підборі коефіцієнтів в рівнянні.
Закон сталості складу - якісний і кількісний склад сполуки з молекулярною будовою не залежить від способу її добування.
Зверніть увагу, що у випадку речовин з атомною та іонною будовою закон не виконується. Речовини, для яких закон виконується, називають дальтонідами, а для яких не виконується - бертолідами.
Закон кратних відношень – якщо два елементи утворюють між собою кілька сполук з молекулярною будовою, то маси одного з елементів, що приходяться на однакову масу другого елементу, відносяться між собою, як невеликі цілі числа.
Закон еквівалентів – маси речовин, що беруть участь у реакції, відносяться між собою як молярні маси їх еквівалентів.
Для реакції А + 2В = АВ2
mA : mB : mAB 2 = М(1/ zA ) : M (1/ zB ) : М(1/ zAB 2 )
Застосування закону еквівалентів значно спрощує розрахунки, дозволяє навіть не записувати рівняння хімічних реакцій. Це пояснюється тим, що записаний в іншій формі закон еквівалентів показує, що кількість еквівалентів речовин, на відміну від числа молів усіх речовин, що беруть участь у реакції, однакова. Тобто:
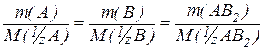
n(1/ z А) = n(1/ z В) = n(1/ z АВ2).
Це означає, що коли в реакцію вступає два моль еквівалентів речовини А, то прореагує і два моль еквівалентів речовини В. А якщо ми говоримо про кількість речовини, то необхідно враховувати коефіцієнти перед формулами в рівнянні. Тобто з 2 молями речовини А буде реагувати 4 молі речовини В.
Щоб вільно оперувати законом еквівалентів, необхідно навчитися знаходити молярні маси еквівалентів елементів у сполуках, молярні маси еквівалентів іонів та складних речовин.
Закон Авогадро – в однакових об’ємах різних газів за одними умовами (Р, Т) знаходиться однакове число молекул.
З закону Авогадро можна зробити деякі висновки (слідства).
1. Молярний об’єм різних газів за однакових умов – величина стала. За нормальних умов (н.у.) [Т = 273 0К, Р = 101325 Па]
VM = 22,4 дм3/моль.
2. Відносна густина одного газу (Х) до іншого (наприклад, А) дорівнює відношенню їхніх молярних мас:
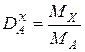 .
.
Звичайно порівнюють густину невідомої речовини з густиною водню або повітря, тоді:
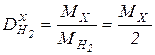 та
та 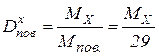 .
.
Якщо знати відносну густину невідомого газу за воднем або за повітрям, можна визначити молярну масу досліджуваного газу (Х) як:
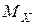 =
= 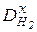 ·2 (г/моль) або
·2 (г/моль) або 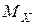 =
= 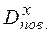 ·29 (г/моль).
·29 (г/моль).
3. Об’єми газів, що беруть участь у реакціях, відносяться між собою як невеликі цілі числа ( закон об'ємних відносин);
4. Мольні та об'ємні частки для суміші газів однакові N i = хi.
Мольна (об'ємна, масова) частка – відношення кількості молей (об'єму, маси) однієї речовини до суми кількості молей (об'ємів, мас) усіх речовин суміші:
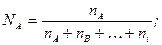 хА
хА 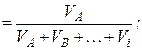
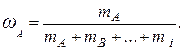
мольна частка об'ємна частка масова частка
Сума часток усіх компонентів суміші дорівнює одиниці:
w А + w В +…+ w i = 1.
Закон Авогадро та слідства з нього виконуються тільки для ідеальних газів – газів, у яких відсутні міжмолекулярні взаємодії та молекули не мають власного об'єму.
Дата добавления: 2018-09-20; просмотров: 199; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
