Визначення кислотності суміші.
Визначення кислотності суміші проводять до початку досліду і після одержання сульфату амонію.
Відбирають з нейтралізатора 5 см3 суміші за допомогою піпетки, частину суміші виливають у попередньо зважений бюкс. Після чого бюкс зважують знову. На початку досліду беруть для аналізу наважки 2-3 см3, після досліду - 7-10 см3. Наважки змивають з бюкса невеликою кількістю води в конічну колбу. Пробу додатково розбавляють водою і титрують 0,5 м розчином NаОН у присутності індикатора до переходу від рожевого фарбування до жовтогарячого.
Зміст сірчаної кислоти в суміші визначають по формулі:
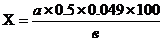 , (9.4)
, (9.4)
де: Х - зміст сірчаної кислоти в суміші, % ;
а - кількість луги, що пішла на титрування:
0,049 - кількість кислоти в м, що відповідає 1 см3 1 м розчину луга;
в - наважка, г.
Вимоги до звіту
У звіті необхідно відобразити:
1. Умови, необхідні для одержання сульфату амонію.
2. Схему установки і короткий опис проведеної роботи.
3. Зведену таблицю отриманих результатів і їхню обробку.
4. Розрахунок виходу сульфату амонію по аміаку чи по кислоті.
5. Висновки по проведеній роботі.
6. Матеріальні баланси нейтралізатора і поглинальної слянки (2)
Техніка безпеки
1. При проведенні роботи дотримуватись правил техніки безпеки при роботі з кислотами та лугами.
2. Роботу проводити під витяжною шафою. Обов’язково при ввімкненій вентиляції
|
|
|
Література
1.Мухленов И.П. Практикум по общей химической технологи. – М.: Высшая школа,1979.-421с.
2. Мухленов И.П. Общая химическая технология. – М.;высшая школа,1984,-254с.
3. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
ЛАБОРАТОРНА РОБОТА № 10
ЗАСТОСУВАННЯ ВОДИ В ХІМІЧНІЙ ТЕХНОЛОГІЇ
Мета роботи: дослідження природних вод Черкаського регіону на придатність в хімічній технології
1. Теоретичні основи
У різних виробництвах хімічної промисловості вода використовується надзвичайно широко. Вона застосовується як універсальний розчинник для великого числа твердих, рідких і газоподібних речовин. Велике її значення і як хімічної сировини у виробництвах водню, сірчаної й азотної кислот, їдкого натру, вапна, у різних реакціях гідратації і гідролізу. Крім технологічних цілей, у великих розмірах вода використовується як теплоносій і холодоагент. За допомогою води здійснюється, наприклад, тепловідвід із зони реакції в екзотермічних процесах. Водяна пара і нагріта (чи перегріта) вода застосовуються для підведення тепла в ендотермічних процесах, для нагрівання взаємодіючих речовин для прискорення багатьох процесів.
|
|
|
Теплообмін між реагуючими масами і водою здійснюється в теплообмінниках, холодильниках і нагрівачах різних конструкцій. Тепло в них передається воді через стінку від рідких чи газоподібних реагентів, рідше, при безпосередньому зіткненні води з реагентами. На великих комбінатах витрата води виміряється мільйонами кубометрів у добу. Частина води (головним чином теплотехнічна) після охолодження та очищення знову повертається в те ж виробництво (оборотна вода).
Оскільки вода є гарним розчинником, то природні води, звичайно, містять різноманітні домішки. До води, застосованої для технологічних і для теплотехнічних цілей, висувають тверді вимоги у відношенні вмісту в ній розчинених речовин, механічних домішок, мікроорганізмів і т.п..
Природні води поділяються на три види, що сильно розрізняються по вмісту домішок:
1. Атмосферна вода - дощова і снігова - містить розчинені двоокис вуглецю, кисень, іноді окисли азоту, сірки, органічні домішки і пил.
2. Поверхневі води - річкові, озерні, морські - крім домішок, що містяться в атмосферній воді, мають у своєму складі бікарбонати кальцію, магнію, натрію, калію, а також сульфати і хлориди. Найбільш багата солями морська вода. Вода, що містить менш 1 г солей у 1 кг, називається прісною; більш 1 г - солоною.
|
|
|
3. Підземні води - ключові, криничні, артезіанські - утворюються в результаті нагромадження в підземних резервуарах атмосферної води, що попадає в них при проходженні через водопроникні шари ґрунту; при цьому відбувається ряд хімічних реакцій з мінеральними й органічними речовинами ґрунту і гірських порід. Підземні води, насичені різними солями (розсоли), можуть служити сировиною для одержання тих чи інших хімічних продуктів. Так, з розсолу хлориду натрію можна одержати соду, їдкий натр, хлор.
У воді для охолоджуючого устаткування лімітується вміст солей (Са, Mg), заліза.
Вода для паросилового господарства характеризується мінімальним вмістом солей, а також лугів, мастил , нафти, кремнієвої кислоти.
Для технічних цілей вимоги до води визначаються специфікою технологічного процесу.
Використанню води у виробництві передує відповідна підготовка, що залежить від наявності в ній домішок і вимог виробництва. Вода для виробничих процесів вода не повинна містити шкідливих для реакції речовин, кородувати апаратуру й утворювати в апаратах і трубах шлам. Домішки звичайно містяться у воді у вигляді розчинів, колоїдних чи механічних суспензій.
|
|
|
До основних операцій водопідготовки відносяться очищення від зважених домішок і пом'якшення, а в деяких випадках - нейтралізація, знесолення, дегазація, знезаражування.
Від механічних домішок вода звільняється відстоюванням чи фільтруванням через шар піску чи гравію. Освітлення води, чи коагуляцію колоїдних домішок, роблять добавкою коагулянтів Al2(SO4)3, FeSО4, NaA1О2 чи флокулянтів (прискорювачі утворення пластівців) - колоїдної кремнієвої кислоти, природних і синтетичних полімерів. Коагулююча дія одного з розповсюджених коагулянтів Al2(SO4)3 основана на утворенні гідроокису алюмінію за рахунок взаємодії з бікарбонатами, що знаходяться у воді, цю очищається:
Al2(SO4)3+ 3 Са(НСО3)2 → З CaSО4 + 2 АІ(ОН)3 + 6 СО2
Одним, з основних факторів, що визначають якість води, є її жорсткість, що обумовлюється вмістом розчинених у ній солей магнію і кальцію. Жорсткість води підрозділяється на тимчасову, постійну і загальну.
Тимчасова (карбонатна) жорсткість характеризується вмістом у воді розчинених бікарбонатів Са(НСО3)2 і Mg(HCО3)2, що при кип'ятінні переходять у середні чи основні і випадають в осад:
Са(НСО3)2 → СаСО3 + Н2О + СО2
2Mg(HCО3)2 → MgCO2 • Mg(OH)2 +3СО2 + Н2О
Постійна жорсткість створюється нітратами, хлоридами, сульфатами магнію і кальцію, що не випадають в осад при кип'ятінні.
Загальна жорсткість - сума тимчасової і постійної жорсткістю. Природна вода класифікується по жорсткості, що визначається вмістом іонів Са2+ і Mg2+ (мг-екв) у 1 дм3 води:
Дуже м'яка 0-1,5
М'яка 1,5-3
Помірно тверда …3-6
Тверда …6-10
Дуже тверда…………………….. 10
Пом'якшенням води називають повне чи часткове видалення солей кальцію і магнію. Грубе пом'якшення води (приблизно до 0,3 мг-екв/дм3) роблять додаванням вапна, їдкого натру чи соди (вапняно-содовий метод):
Са(НСО3)2 + Са(ОН)2 → 2 СаСО3 + 2 Н2О
Mg(HCО3)2 + 2 Са(ОН)2 → 2 СаСО3 + Mg(OH)2 + Н2О
CaSО4 + Na2CО3 → СаСО3 + Na2SО4
MgSО4 + Na2CО3 → MgCО3 + Na2SО4 і т.п..
Розчинений у воді двоокис вуглецю реагує з гашеним вапном:
Са(ОН)2+С02 → СаСО3 + Н2О
Природна вода з невеликою жорсткістю після грубого пом'якшення найбільше ефективно може бути пом'якшена і також знесолена методом іонного обміну. Сутність цього методу полягає в тім, що деякі тверді важкорозчинні мінеральні й органічні речовини здатні витягати з розчинів одні чи катіони аніони в обмін на інші, що присутні в них. Для поглинання з води іонів Са2+, Mg2+, Fe2+ застосовують катіоніти - сульфовугілля чи високомолекулярні смоли, що містять активні групи з іонами Н+, Na+ чи NH4+.
Процеси катіонного обміну можуть бути представлені наступними чином:
2 (Кат)Н + Са(НСО3)2 → (Кат)2Са + 2СО2 + 2 Н2О
2 (Kam)Na + CaSО4 → (Кат)2Са + Na2SО4
2 (Kam)Na + Mg(HCО3)2 → (Kam)2Mg + 2 NaHCО3
а також
(Kam)H + NaCl → (Kam)Na + HCl і т.п..
Для повного знесолення (деіонізації) води після катіонітового фільтра її пропускають через аніонітовий:
2 (Ан)ОН + H2SО4 -> (Aн)2SО4 + 2 Н2О
Катіоніт і аніоніт регенерують, обробляючи їхніми розчинами лугів, чи кислот хлористого натрію, наприклад
(Кат)2Са + 2 NaCl → 2 (Kam)Na + CaCl2
I (Kam)2Ca + 2 HCl ->→ 2 (Kam)H + CaCl2
(Kam)2Mg + H2SО4 → 2 (Kam)H + MgSО4
(Ah)CI + NaOH → (Ah)OH + NaCl
Змішуючи зерна катіоніту й аніоніту, можна робити одночасний витяг катіонів і аніонів з води. В якості аніонітів використовуються смоли, отримані в результаті взаємодії амінів з формальдегідом чи поліетиленполіамінів з зпіхлоргідрином.
Знезаражування води проводиться хлором чи хлорним вапном, рідше - озоном.
Дегазація - звільнення води від розчинених у ній кисню і двоокису вуглецю, кородуючих котельну сталь; СОг поглинається Са(ОН)2, для зв'язування кисню застосовують залізну стружку.
2. Хімічні реактиви, прилади та посуд
Реактиви:
· титрований розчин трилона Б 0,01 н;
· аміачно-буферний розчин рН = 10;
· індикатор хромтемносиній.
· вода дистильована,
· амоній роданистой 0,1 н розчин;
· кислота азотна 25 % розчин;
· галуни залізо-амонійні, насичений розчин;
· срібло азотно-кисле 0,1 н розчин;
· сульфосаліцилова кислота, 10 %-й розчин.
· аміак, розведений 2:3
· кислота сірчана (густина 1,84 г/см3);
· аміак водний, 25 %-й розчин, розведений 1:5;
· трилон Б, 5 %-й розчин;
· диетилдитіокарбомат натрію, 0,25 %-й розчин;
· ортофосфатна кислота 17%;
· дифенілкарбазид 0,25% р – н.
Прилади та посуд:
· ФЕК;
· Бюретка об`єм 25 мл - 2 шт;
· Піпетки об`єм 10 мл - 2 шт;
об`єм 5 мл - 2 шт;
об`єм 2 мл - 2 шт;
об`єм 1 мл - 2 шт;
· Колби мірні об`єм 50 мл - 10 шт;
Допоміжні матеріали
· Папір фільтрувальна;
· Індикаторний папір;
3. Послідовність виконання роботи
3.1 Визначення твердості води
Метод заснований на титруванні води динатрієвою сіллю етилендіамінтетра - оцтової кислоти (трилон Б) в присутності кислотного індикатора хромтемносинього.
Розчинні в воді солі твердості (Са, Mg) при рН = 10 утворюють з трилоном Б міцні безколірні комплексні сполуки. Кінцева точка титрування відповідає зникненню в розчина вільних іонів Са2+, Mg2+ і при цьому червоний колір переходить в синій.
В конічну колбу місткістю 250 мл відбирають 100 мл води взятої для аналізу. Потім добавляють 0,5 мл аміачно-буферного розчину (рН = 10) і 7 - 8 капель індикатору, після чого повільно титрують при інтенсивному перемішуванні 0,01н розчином трилону Б до переходу кольору із винно-червоного в синій.
Жорсткість води виражається в мг - екв/л іонів Ca2+ і Mg2+ в 1 л води. Жорсткість води, взятої для аналізу, визначають за формулою:
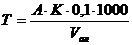 , (10.1)
, (10.1)
де А - об'єм розчину трилону Б, який використали на титрування, мл;
К - поправочний коефіцієнт;
Vал - об'єм проби води, взятої для аналізу, мл;
0,1 – нормальність трилону Б.
3.2 Визначення хлоридів
Визначення С1-іонів по методу Фольгарда основане на застосуванні методу зворотного титрування. Хлорид-іон спочатку осаджують розчином азотно - кислого срібла, який беруть з надлишком. Потім відтитровують прореагувавший з хлоридом, надлишок азотно - кислого срібла стандартним розчином амонію роданистого в присутності залізо - амоншних галунів в якості індикатора. За різницею результатів двох титрувань визначаємо об'єм розчину азотно - кислого срібла, який використали на осадження хлорид-іонів.
В колбу місткістю 250 мл відбирають піпеткою 20 мл дослідної води, потім добавляють 2 мл розчину азотної кислоти, 5 мл розчину азотнокислого срібла, 1 - 2 мл розчину залізо-амонійних галунів і титрують розчином роданистого амонію до появи червоно-бурого кольору.
Вміст хлоридів в % визначають за формулою:
 мг/дм3; (10.2)
мг/дм3; (10.2)
де А - об'єм 0,1н розчину азотно - кислого срібла взятого на титрування, мл;
В - об'єм 0,1н розчину роданистого амонію, який використали на титрування надлишку азотно - кислого срібла, мл;
0,00335 - кількість хлорид-іонів, які відповідають 1 мл 0,1н розчину азотно -кислого срібла.
Vал - аліквота, см3;
3.3 Визначення масової концентрації двовалентного і тривалентного заліза
Метод оснований на тім, що сульфосаліцилова кислота утворить із солями заліза забарвлені з'єднання. У слабкокислому середовищі сульфосаліцилова кислота реагує тільки з тривалентним залізом (червоне забарвлення), а в слабколужному середовищі - із залізом тривалентним і двовалентним (жовте забарвлення).
В мірну колбу місткістю 50 см3 поміщають 1 - 30 см3 досліджуваної води. Масова концентрація заліза в цьому об'ємі повинна бути в межах від 0,005 до 0,050 мг. Потім приливають у колбу 10 см3 розчину сульфосаліцилової кислоти, 10 см3 розчину аміаку, розбавляють водою до мітки і перемішують. Вимірюють оптичну густину забарвлених розчинів на фотоелектроколориметрі в кюветі з робочою довжиною 30 мм на тлі «холостого» досліду, використовуючи синій світлофільтр. По оптичній густині знаходять масову концентрацію заліза на градуювальному графіку.
Загальну масову концентрацію заліза (Feзаг.) у міліграмах на кубічний дециметр води розраховують за формулою:
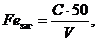 (10.3)
(10.3)
де С - концентрація (по графіку), мг/дм3 ;
V - об'єм аналізованої проби, см3.
3.4 Визначення масової концентрації міді
Метод заснований на тому, що диетилдитіокарбонат натрію утворить з міддю в аміачних розчинах комплекс, забарвлений у жовтий колір при малому вмісті міді. Інтенсивність забарвлення пропорційна концентрації міді в аналізованій воді. Вплив інших іонів, що заважають, усувається зв'язуванням їх у комплекс трилоном Б.
У мірну колбу місткістю 50 см поміщають таку кількість досліджуваної води, щоб в ній містилося 0,01-0,08 мг міді. Значення рН повинне бути в межах від 6,5 до 8,0. Потім доливають у колбу 5 см розчину трилону Б, 0,5 см розчину аміаку, 5 см3 розчину диетилдитіокарбонату натрію, розбавляють водою до мітки і перемішують.
Вимірюють оптичну густину забарвлених розчинів на фотоелектрон-колориметрі в кюветі з робочою довжиною 20 мм на тлі «холостого» досліду, використовуючи синій світлофільтр (№4). По оптичній густині знаходять масову концентрацію міді на градуювальному графіку.
Масову концентрацію міді (Сu2+.) у міліграмах на кубічний дециметр води розраховують за формулою:
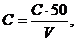 (10.4)
(10.4)
де С - концентрація (по графіку), мг/дм3 ;
V - об'єм аналізованої проби, см3.
3.5 Визначення масової концентрації хрому
Визначення шестивалентного хрому: пробу, після фільтрації, взяти в залежності від пропонуємої кількості шестивалентного хрому від 5 до 20 см3 і внести в мірну колбу місткістю 50 см3. Розбавити дистильованою водою до 30 см3. Довести рН розчину до 4-5, додаючи краплями розчин фосфорної кислоти або розчин їдкого натрію, в залежності від рН взятої для аналізу проби.
Виміряти рН розчину універсальним індикаторним папером. Обробити 2 см3 розчину дифенілкарбазиду. Перемішати, довести до мітки дистильованою водою. Дати постояти 15 хвилин і виміряти оптичну густину.
Внести пробу в кювету з товщиною поглинаючого шару 50 мм. На нефелометрі-колориметрі при зеленому світлофільтрі №6 при довжині хвилі 540 ± 5 нм виміряти оптичну густину.
Знайти по градуювальному графіку масову концентрацію хрому (загального і шестивалентного) в пробі.
Розрахунок масової концентрації загального хрому в 1 дм3 проводиться за формулою:
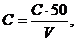 мг/дм3; (10.5)
мг/дм3; (10.5)
де С – за графіком, мг/дм3 ;
V - аліквота, см3.
Вимоги до звіту
1. Звіт повинен мати теоретичні відомості, послідовність виконання роботи.
2. Зроблені всі досліди і виміри вказані в методичних вказівках, виконані необхідні розрахунки.
3. В кінці роботи необхідно зробити висновок про виконану роботу.
Техніка безпеки
1. Дотримуватись правил безпеки при використанні електричних приладів
2. Чітко дотримуватись ходу роботи згідно з методичними вказівками
Контрольні запитання
1. Класифікація природних вод.
2. Методи очищення води від механічних домішок.
3. Яка різниця між тимчасовою та загальною жорсткістю.
4. Які процеси проходять на катоді та аноді.
5. Формула для визначення жорсткості.
Література
1. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
2. Мухленов И.П. Общая химическая технология. – М.;высшая школа,1984,-254с.
ЛАБОРАТОРНА РОБОТА № 11
Дата добавления: 2018-08-06; просмотров: 209; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
