Хімічні реактиви, прилади, посуд
Реактиви:
· Твердий реагент (за вибором викладача)
· Дистильована вода
Прилади та посуд:
· Пікнометри ……………………………………………….2 шт
· Термостат-шафа…………………………………………..1 шт
· Воронка……………………………………………………3 шт
· Аналітичні ваги ВЛР-200………………………………...1 шт
· Піпетка V=5 мл……………………………………………2 шт
· Стакан мірний V=250 мл…………………………………2 шт
· Прилад-воронка…………………………………………..1 шт
· Штатив…………………………………………………....1 шт
· Зажим………………………………..................................1 шт
Опис лабораторної установки
Для виконання першої частини лабораторної роботи ,тобто для визначення істинної густини, використовується пікнометр з пробкою V=25мл. На рисунку 4.1 показана лабораторна установка для визначення насипної (об’ємної) густини.
Вона складається з перевернутого урізаного конусу (1), який закінчується трубкою (2) із зажимом (3) на кінці. Воронка закріплена за допомогою штатива (4) на певній висоті .Під воронкою розміщений мірний стакан (5)
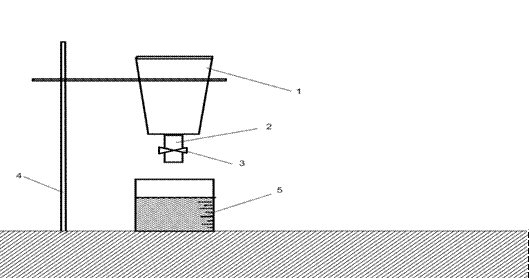
1 – воронка-конус; 2 – трубка; 3 – зажим; 4 – штатив;
5 – мірний стакан-приймач.
Рисунок 4.1 - Прилад для визначення насипної (об’ємної густини).
Послідовність виконання роботи
Для визначення істинної густини твердого матеріалу старанно помитий і висушений пікнометр V = 25 мл заповнюють пікнометричною рідиною до мітки (дист. вода, толуол, етиловий спирт і ін.) і термостатують при t=20±2оС протягом 30 хвилин. Потім ще раз перевіряють рівень рідини в пікнометрі, (вона не повинна бути вище чи нижче від мітки ) закривають пробкою і зважують на аналітичних вагах. Виливають рідину з пікнометра висушують і зважують з пробкою також на аналітичних вагах.
|
|
|
Після зважування ,за допомогою воронки ,в пікнометр засипають зразок твердого реагенту в такій кількості, щоб дно пікнометра було покрито шаром товщиною 1-2 зерна реагенту. Закривають пікнометр пробкою і зважують, визначаючи наважку зразка. Потім наважку заливають пікнометричною рідиною(до половини широкої частини пікнометра) в відкритому вигляді ставлять в термостат при 80-90 оС і витримують в цих умовах 30 – 60 хв слідкуючи ,щоб зразок був покритий рідиною. За цей час повітря, яке було в порах матеріалу витісняється і пори заповнюються рідиною.
Пікнометр виймають з термостата, охолоджують, доливають рідиною до мітки, закривають пробкою і термостатують 30 хвилин при t=20±2оС. Не виймаючи пікнометра із термостата, доводять рівень рідини в ньому до мітки, старанно витирають рідину вище мітки і по стінках пікнометра, закривають пробкою і знову зважують на аналітичних вагах. Істинну густину твердого зразку вираховують за формулою 4.1 (див. методичні вказівки 1розділ).
|
|
|
Для визначення насипної (об’ємної) густини використовують лабораторну установку (рисунок 4.1).
В воронку-конус (1), при закритому зажимі (3), засипають в два рази більшу по об’єму, (по відношенню до об’єму мірного стакану-приймача (5)), кількість твердого реагенту.
Відкривають зажим (3) і заповнюють стакан-приймач (5) з деяким надлишком. Закривають зажим, а надлишок зрізають деревяною або металевою лінійкою, тримаючи її під нахилом і притискаючи до країв стакану-приймача (5). Зважують стакан-приймач з матеріалом і пустий. Насипну (об’ємну) густину визначають за формулою 4.2.
Визначення проводять 3 рази і беруть середне значення.
Насипну (об’ємну) густину в ущільненому стані визначають таким чином: матеріал який насипають в стакан-приймач (5) ущільнюють, постукуючи стакан об тверду поверхню до постійного об’єму, зважують і визначають густину за формулою 4.2. Дослід проводять 3 рази і беруть середнє значення.
Опрацювання результатів
У ході роботи по визначенні істинної густини зразку визначають:
1. Масу пустого пікнометра, г
2. Масу пікнометра з водою, г
3. Масу твердого зразку, г
4. Масу пікнометра із зразком та пікнометричною рідиною, г
|
|
|
Істинну густину визначають за формулою (4.1).
У ході роботи по визначенню насипної (об’ємної) густини визначають:
1. Масу стакана-приймача, г
2. Обєм стакана-приймача, см3
3. Масу стакана-приймача з зразком, г
Насипну густину визначають за формулою (4.2).
Вимоги до звіту
1. Звіт повинен мати теоретичні відомості, опис лабораторної установки, послідовність виконання роботи.
2. Зроблені всі досліди і виміри вказані в методичних вказівках, виконані необхідні розрахунки.
3. В кінці роботи необхідно зробити висновок про виконану роботу.
Техніка безпеки
1. Дотримуватись правил безпеки при використанні електричних приладів
2. Чітко дотримуватись ходу роботи згідно з методичними вказівками
Контрольні запитання
1. Характеристика твердих сипучих матеріалів
2. Визначення істинної густини
3. Формула для визначення істинної густини
4. Визначення насипної (об`ємної) густини
5. Формула для визначення насипної густини
6. Поняття ущільненого стану твердої сипучої речовини.
Література
1. Мухленов И.П. Практикум по общей химической технологи. – М.; Высшая школа,1979.-421с.
2. Мухленов И.П. Общая химическая технология. – М.;высшая школа,1984,-254с.
|
|
|
3. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
ЛАБОРАТОРНА РОБОТА №5
ОДЕРЖАННЯ НАФТОПРОДУКТІВ ПРЯМОЮ ПЕРЕГОНКОЮ НАФТИ
Мета роботи: одержання бензинової фракції при прямій перегонці нафти.
1. Теоретичні основи
Пряма перегонка нафти базується на різній температурі кипіння окремих фракцій. Нафта, в основному, складається з вуглецю (83-87%; та водню (12-14%), які входять до складу суміші вуглеводнів. Вуглеводнева частина нафти складається з парафінових, нафтенових ι ароматичних вуглеводнів.
При перегонці нафти утворюються дистилати таких речовин:
| Дистилати | Температура відбирання, °С | Вихід від маси нафти, % |
| 1. Бензин | до 170 | 14,5 |
| 2. Лігроїн | 160-200 | 7,5 |
| 3. Керосин | 200-300 | 18,0 |
| 4. Газойль | 300-350 | 5,0 |
| 5. Мазут-залишок | 55,0 |
Кожна фракція, в свою чергу, може бути перегнана в більш вузькі інтервали температур з одержанням різних сортів дистилатів.
Залишок перегонки - мазут - також можна піддати фракціонуванню.
Бензин, одержаний методом прямої перегонки, складається, в основному, з парафінових і нафтенових вуглеводнів.
2. Хімічні реактиви, прилади та посуд
Реактиви:
· сірчана кислота H2SO4, концентрована - 10 мл;
· нафта - 50 мл.
Прилади та посуд:
· електрична плита;
· технічні ваги;
· термометр лабораторний;
· колба кругла для перегонки;
· холодильник прямий;
· колба конічна;
· колба для аналізу;
· піпетка;
· насадка.
3. Опис лабораторної установки
Лабораторна установка (рисунок 5.1) складається з круглої колби 2 для підігріву нафти. Ця колба з'єднана з колбою-приймачем 4, прямим холодильником 3. В холодильнику, за рахунок охолодження водою нафтопродукти конденсуються і скапують в колбу-приймач 4.
Нагрівання відбувається на електричній плиті 1. Температура перегонки контролюється термометром 5, вставленим в насадку 6.

1 - електрична плита; 2 - колба-кип'ятильник; 3 - прямий холодильник; 4 - колба-приймач, 5 - термометр; 6 - насадка.
Рисунок 5.1 - Установка для прямої перегонки нафти
4. Послідовність виконання роботи
У колбу 2 заливають 50 г нафти, до вихідного штуцера насадки приєднують холодильник 3. У верхній отвір насадки вставляють технічний термометр 5. Вихідний штуцер холодильника направляють у колбу-приймач дистилату 4. До холодильника підключають холодну воду з водогону за допомогою гумових трубок для охолодження. Вмикають електричну плиту 1 в мережу і слідкують за підвищенням температури на термометрі 5.
Коли температура досягне позначки 150°С, починається процес відгонки. Відмічають момент падіння першої краплини за годинником і продовжують відгонку до досягнення температури 170°С. Нагрівання повільне.
Після відгонки в дистилат додають 3-4 краплі концентрованої сірчаної кислоти. В осад випадають краплі домішок (кислий гудрон).
Суміші дають відстоятися, після чого піпеткою знімають верхній шар очищеного бензину, який зважують на технічних вагах (пусту колбу попередньо зважують).
Після зважування вираховують вихід бензину.
5. Опрацювання результатів
Результатом проведеної роботи є одержання бензинової фракції нафти, розрахунок її масової і процентної частки від вихідної маси. Під час роботи виконують такі завдання:
· вимірюють кількість заданого продукту (нафти) - г, мл;
· кількість вихідного продукту (бензину) - г, мл;
· масу пустої колби - г;
· масу колби з бензином - г;
· температуру першої краплі -°С;
· кінцеву температуру -0 С;
· час перегонки - хв.
За одержаними результатами знаходять масову і процентну частку бензинової фракції.
6. Вимоги до звіту
1. Звіт повинен мати короткі, але вичерпні теоретичні відомості, опис лабораторної установки та хід виконання роботи.
2. Звіт також повинен містити результати проведених необхідних замірів і розрахунків.
3. У кінці повинен бути висновок про виконану роботу.
7. Техніка безпеки
1. У даній роботі використовують і одержують легкозаймисті речовини, тому потрібно слідкувати, щоб поруч не було відкритого вогню.
2. Дотримуватися правил безпеки при ввімкненій і вимкненій електричній плиті.
3. Обережно поводитися з концентрованою сірчаною кислотою.
4. Роботу необхідно виконувати при працюючій витяжній вентиляції.
5. Робоче місце тримати в чистоті, не захаращуючи його сторонніми предметами.
6. Лабораторний пристрій повинен бути закритий азбестовим полотном.
8. Контрольні питання
1. Склад і властивості нафти.
2. Продукти її переробки.
3. Основні методи переробки нафти.
4. Первинна переробка нафти (пряма перегонка).
5. Вихід основних фракцій в інтервалі температур.
9. Література
1. Мухленов И.П. Общая химическая технология. - М: Высшая школа, 1984. - 256 с.
2. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
.
ЛАБОРАТОРНА РОБОТА №6
ТЕХНІЧНИЙ АНАЛІЗ НАФТОПРОДУКТІВ
Мета роботи: практичне ознайомлення в лабораторних умовах з методами визначення густини та в'язкості нафтопродуктів.
1. Теоретичні основи
Важливими величинами, які визначають характеристику і якість різних нафтопродуктів, є:
· густина, у певній мірі, вказує на склад мастила;
· в'язкість-внутрішнє тертя, яке виникає між шарами мастила при русі;
· температура застигання - це температура, при якій мастило втрачає тягучість;
· стабільність або стійкість - незмінні властивості мастила в робочих умовах;
· мастильна здатність - це здатність прилипати до поверхні змащувального матеріалу;
· температура спалаху - температура, при якій пари мастила в суміші з повітрям спалахують.
Густиною тіла називають відношення його маси до об'єму. Густина вимірюється в г/см3; кг/дм3; т/м3. Відносною густиною називається відношення маси тіла до маси води в тому ж об'ємі при температурі 4°С, а в окремих випадках при температурі води, яка дорівнює температурі тіла. Густина твердої речовини залежить від її складу, а розчинів - від концентрації. Густину вимірюють для визначення маси тіла за її об'ємом.
При температурі 4°С маса 1 см3 дорівнює 1 г. В такому випадку числове значення відносної густини збігається з її числовим значенням.
При визначенні густини за допомогою ареометра, пікнометра або вагів Мора-Вестфаля фактично знаходять відносну питому вагу. Для одержання значення густини знайдену величину потрібно помножити на відповідну поправку. В технічних розрахунках умовно прийнято одержану питому вагу називати густиною.
З підвищенням температури густина зменшується, і навпаки. Внаслідок залежності густини від температури при позначенні густини вказують і температуру, при якій вона визначається. Звичайно, для рідини вибирають температуру 20°С, тому і густину позначають р20. Коли густину рідини за умовами досліду визначають не при 20°С, а при іншій температурі, її позначають р' і потім перераховують до нормального р20 за формулою:
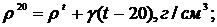 (6.1)
(6.1)
де ρt - густина рідини при температурі досліду;
γ - середня температурна похибка (е в таблиці);
t - температура досліду, °С.
Визначення густини пікнометром
Пікнометром називається невелика скляна посудина з кільцевою позначкою на шийці, це різновид вимірювальних колб. Сухий виважений пікнометр наповнюють рідиною і зважують, за різницею знаходять масу рідини. Масу води знаходять так само. При вимірюванні густини температура рідини і води повинна бути однаковою. Для дотримання температури рідини і води використовують термостат (водяну баню).
Для знаходження густини пікнометром необхідно знати його водяне число (маса води в його об'ємі при 20° С).
Водяне число пікнометра Μ визначають як різницю між масою пікнометра з водою М2 і масою пустого пікнометра М1.
M = M2(20) – M1, г. (6.2)
При визначенні густини дослідного матеріалу робимо все, як при визначенні водяного числа. Густина, одержана таким чином, є "видимою" густиною при зважуванні в повітрі. Дійсна маса - це маса в пустоті. Тому при точних вимірах роблять поправку на загублену масу в повітрі. Похибку визначають за формулою
rдійсн. = (0,99823 – 0,0012)r1 + 0,0012 = 0,99703r1+ 0,0012, (6.3)
де rдійсн., r1 - відповідно дійсна і видима густина;
0,99823 - густина води при 20° С;
0,0012 - густина повітря в умовах досліду; (середня величина).
rдійсн.= М3 – Μ1 / Μ · 0,99703 + 0,012, (6.4)
де Мз - маса пікнометра з нафтопродуктом;
Μ1 - маса пустого пікнометра;
Μ - водяне число пікнометра.
Визначення в 'язкості
У будь-якій рідині під дієто зовнішніх сил відбувається переміщення молекул між собою. Тертя, яке при цьому виникає, тобто внутрішній опір переміщенню, називається внутрішнім тертям або в'язкістю.
В'язкість зменшується з підвищенням температури і зростає при її зниженні. Зміна в'язкості під дією температури характеризується індексом в'язкості. Чим менша залежність в'язкості від температури, тим вищий індекс. В'язкість є динамічною, кінематичною та відносною (умовною).
Умовна в'язкість виражається в градусах Енглера. Числом градусів Енглера називається відношення часу витоку 200 мл досліджуваної рідини з віскозиметра Енглера при температурі заданого досліду до часу витоку 200 мл дистильованої води при 20°С.
Умовна в'язкість позначається Е. В'язкість нафтопродуктів визначається, звичайно, при температурах 60°С та 100°С, не дуже в'язкі мастила можна визначати при 20°С.
Кінематичну в'язкість можна визначити скляним віскозиметром типу ВПЖ-2. Визначення в'язкості за допомогою капілярного віскозиметра грунтується на визначенні часу витоку через капіляр певного об'єму рідини із вимірного резервуара.
В'язкість обчислюється за формулою:
V = q/9,807 Τ Κ, (6.5)
де Κ - постійна віскозиметра , вказана в його паспорті, мм2 / с2;
Τ - час витоку рідини , величина якої визначається під час досліду, с;
q - прискорення вільного падіння в місці виміру, м/с2;
V - кінематична в'язкість, мм2 / с.
Внутрішній діаметр капіляра d = 0,56 мм.
2. Хімічні реактиви, прилади та посуд
Реактиви:
· спирт -100 мл;
· петройлерний ефір – 100 мл;
· хромова суміш – 100 мл;
· бензол – 100 мл;
· бензин -100 мл;
· соляр – 100 мл;
· дистильована вода - 1000 мл.
Прилади та посуд:
· пікнометр V = 5 мл - 2 шт.;
· віскозиметр ВПЖ-2 - 2 шт.;
· аналітичні ваги;
· термостат (водяна баня);
· секундомір;
· вимірні колби - 2 шт.;
· хімічні стакани - 2 шт.;
· піпетка V = 5 мл - 2 шт.
3. Опис лабораторної установки
Пікнометр - прилад, необхідний для визначення густини нафтопродуктів. Це невелика скляна посудина, типу вимірювальної колби, з кільцевою позначкою на шийці та притертою пробкою (рисунок 6.1),

Рисунок 6.1 – Пікнометр
Віскозиметр скляний капілярний типу ВПЖ-2 - це U - подібна трубка, в коліно 1 якої впаяно капіляр 4. Визначення в'язкості грунтується на визначенні часу витоку через капіляр певного об'єму досліджуваної рідини з вимірного резервуара.
4. Послідовність виконання роботи.
Визначення густини
Спочатку знаходять водяне число пікнометра. Для визначення його пікнометр старанно миють, сушать і зважують на аналітичних вагах з точністю до 0,0002 г. Потім заповнюють його дистильованою водою трохи вище позначки і поміщають в термостат, в якому видержують при температурі 20° С протягом 20-30 хв. Коли рівень рідини в шийці пікнометра перестане змінюватися, надлишок забирають за допомогою фільтрувального паперу. Пікнометр старанно витирають і зважують з точністю до 0,0002 г.
Водяне число пікнометра Μ визначається як різниця між його масою з водою Мг і масою пустого пікнометра Мі (формула (6.2))
Щоб визначити густину досліджуваної рідини, її наливають в чистий сухий посуд, закривають пробкою і витримують у термостаті при 20°С протягом 20 хв. Потім за допомогою піпетки продукт переносять в чистий, сухий і зважений пікнометр. Встановлюють рівень рідини і зважують на аналітичних вагах з точністю до 0,0002 г. При точних визначеннях роблять поправку на загублену масу (формули (6.3 - 6.4)).
Визначення в'язкості
Визначення в'язкості рідини виконується віскозиметром, старанно промитим і висушеним. Спочатку він промивається бензином, потім ефіром, водою і заливається на 5-6 годин хромовою сумішшю. Після чого його промивають дистильованою водою і сушать до постійної маси.
Для знаходження часу витоку досліджуваної рідини на відвідну трубку 6 готового до роботи віскозиметра одягають гумову трубку (рисунок 6.2). Потім коліно 5 закривають пробкою, перевертають віскозиметр і опускають коліно 1 в посудин}' з досліджуваною рідиною. Засмоктують її за допомогою груші (до позначки М2 резервуара 3), слідкуючи за тим, щоб рідина була без бульок повітря. В той момент, коли рівень рідини досягне позначки М2 резервуара 3, віскозиметр виймають із посудини і швидко повертають в нормальне положення. Знімають з зовнішнього кінця коліна 1 надлишок рідини і одягають гумову трубку.
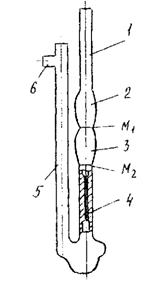
1,5 - коліно; 2,3 - резервуар; 4 - капіляр; 6 - відвідна трубка; М1, М2 - верхня і нижня позначки.
Рисунок 6.2 - Віскозиметр
Віскозиметр встановлюють в термостат (водяну баню) так, щоб резервуар 2 був нижче рівня рідини в термостаті. Не менше ніж на 15 хвилин при заданій температурі засмоктують рідину в коліно 1 приблизно до 1/3 висоти резервуара 2. З'єднують коліно 1 з атмосферою і визначають час спуску меніска рідини від позначки М, до позначки М2 за допомогою секундоміра.
За отриманими результатами та формулою (6.2) визначають в'язкість. Виконують декілька замірів і визначають середній час.
5. Опрацювання результатів
У результаті проведеної роботи одержують навики до практичного визначення густини та в'язкості рідин - нафтопродуктів та коксування вугілля.
Ознайомлюються з роботою пікнометра та віскозиметра, виконують відповідні заміри та розрахунки, а саме:
· зважують пустий пікнометр, г;
· зважують пікнометр з водою, г;
· зважують пікнометр з рідиною, г;
· затягують у віскозиметр рідину;
· за секундоміром визначають час витоку рідини з віскозиметра, с.
Дослід повторюють тричі.
6. Вимоги до звіту
1. Звіт повинен мати короткі, але вичерпні теоретичні відомості, опис лабораторного обладнання та хід роботи.
2. Необхідно зробити всі виміри, вказані в методичних вказівках, і виконати необхідні розрахунки.
3. Робота має закінчуватися висновком про виконану роботу.
7. Техніка безпеки
1. Роботи виконувати при ввімкненій витяжній вентиляції.
2. Залишки рідин зливати в спеціальні склянки для зливу, а не в каналізацію.
3. Не куштувати на смак досліджувану рідину.
4. В роботі використовується легкозаймиста речовина, тому треба слідкувати, щоб поруч не було відкритого вогню.
5. Теплу воду для термостата брати в лаборанта, а не нагрівати поруч з легкозаймистими речовинами.
6. Здати лаборанту робоче місце після роботи.
8. Контрольні питання
1. Які величини характеризують властивість і якість нафтопродуктів?
2. Визначення густини. Одиниці її вимірювання.
3. Визначення в'язкості. Одиниці її вимірювання..
4. Прилади для вимірювання густини і в'язкості.
9. Література
1. Мухленов И.П. Практикум по общей химической технологии. - М.: Вьісшая школа, 1979. - 421 с.
2. Мухленов И.П. Общая химическая технология. - М.: Вьісшая школа, 1984. - 256 с.
3. Кутепов О.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для вузов. - 2-е изд. испр. и доп. - М.: Вьісшая школа, 1990. - 520 с.
4. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
ЛАБОРАТОРНА РОБОТА №7
ДОСЛІДЖЕННЯ КОРОЗІЇ МЕТАЛІВ
Мета роботи: знаходження швидкості корозії металів за водневою деполяризацією.
1. Теоретичні основи
Корозією металів називають самовільне руйнування металічних матеріалів внаслідок хімічної або електрохімічної взаємодії їх з навколишнім середовищем. Під металами тут і далі розуміють прості метали та їх сплави, а також металеві вироби і конструкції. Середовищем, в якому відбувається корозія металів, звичайно бувають різні рідини і гази.
Корозійний процес протікає на границі двох фаз "метал - навколишнє середовище", в тому числі це - гетерогенний процес взаємодії рідкого або газоподібного середовища (або їх окислювальних компонентів) з металом.
Корозія металів має місце, в більшій чи меншій мірі, всюди, де йде обробка металів або експлуатуються металеві вироби і конструкції.
Першопричиною корозії металів є термодинамічна їх нестійкість у різних середовищах при даних зовнішніх умовах.
За умовами протікання корозії, які досить різноманітні, розрізняють декілька їх видів.
Рідинна корозія - це корозія металів у рідкому середовищі: в неелектроліті (бром, розплавлена сірка, органічний розчинник, рідке паливо) і в електроліті (кислотна, лужна, сольова, морська, річкова і корозія в розплавлених солях і лугах.).
В залежності від умов взаємодії середовища з металом розрізняють рідинну корозію металу при повному, неповному і змінному зануренні; корозію по ватерлінії (біля межі між зануреною і незануреною частиною в корозійне середовище металу); корозію в неперемішуваному (спокійному) і перемішуваному (рухливому) корозійному середовищі.
За характером корозійного руйнування розрізняють такі види корозії: суцільну або загальну та місцеву корозії, що охоплюють всю поверхню металу., яка знаходиться під дією даного корозійного середовища.
Суцільні плівки продуктів корозії, що утворюються на поверхні металів, не припиняють їх взаємодії з окислювачем тому, що метал або окислювач, або і метал і окислювач можуть розчинятися в плівці одночасно з їх іонізацією і переміщенням тих іонів, що при цьому утворюються, і електронів в кристалічній решітці продукту реакції
Ме = Меn+ + ne; (7.1)
О +2е = О2-. (7.2)
Швидкість корозійного процесу може бути виражена в загальному вигляді за допомогою рівняння:
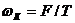 , (7.3)
, (7.3)
де 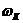 - швидкість корозії;
- швидкість корозії;
F – рухаюча сила процесу;
Т – гальмування процесу.
Швидкість корозії - це корозія на одиницю часу, тобто кількість і водню, виділеного з 1 см2 поверхні за хвилину.
Хімічний та електрохімічний механізм розчинення металів в електролітах, самовільний перехід металів в окислений (іонний) стан при взаємодії з іншими речовинами може протікати за двома різними механізмами: 1 - хімічний, 2 - електрохімічний.
Хімічний механізм у вигляді хімічної реакції, що відбувається на одній і тій же ділянці поверхні, в одну стадію, і не залежить від потенціалу металу, без участі вільних електронів, коли метал, віддаючи окислювачу валентні електрони, вступає з ним в хімічну сполуку або утворює іони, може мати місце в електролітах: розчинення заліза, хрому та їх сплавів в 0,1 н Н2SO4
Ме + nН2О = Меn+ + nОН- + n/2H2 (7.4)
розчинення алюмінію в 5% СН3 СООН
4А1 + 3О2 + 12Н+ = 4Аl3+ + 6Н2О (7.5)
тощо.
Електрохімічний механізм у вигляді електрохімічної реакції, що протікає з участю вільних електронів, при якій іонізація атомів металу і відновлення окислювального компонента кородуючого середовища відбуваються не в одному акті і їх швидкості залежать від величини електродного потенціалу металу, має місце в більшості випадків корозії металів, в електролітах і є, таким чином, переважаючим.
Самовільне протікання електрохімічного процесу можливе, якщо:
(Va)об. = (Vме)об.  (Vk)об., (7.6)
(Vk)об., (7.6)
де (Vме)об. – оборотний потенціал металу.
Для електрохімічного розчинення металу необхідна наявність в електроліті окислювача-деполяризатора, зворотний окислювально–відновлювальний потенціал якого позитивніший за зворотний потенціал металу – в даних умовах.
Згідно з рівнянням (7.4), протікання процесу корозії металу з водневою поляризацією можливе, якщо:
(Vме)об.  = (Vн2)об., (7.7)
= (Vн2)об., (7.7)
де (Vн2)об. = RT/F.2,303 lg(aН+/Pн2 1/2) - оборотний потенціал водневого електрода.
Ме(т) + nН2О(р) = Ме(ОН)n (т) + n/2Н2 (г) (7.8)
Кінетику корозії металів з водневою або кисневою деполяризацією можна досліджувати безперервно, за допомогою об'ємних показників, використовуючи для цього об'ємні методи. Для знаходження швидкості корозії металів за водневою деполяризацією та за об'ємом виділеного водню використовується прилад, в якому заповнення бюреток на початку досліду і при їх періодичному перезарядженні в процесі дослідження відбувається в результаті затягування кородуючого розчину за допомогою воднострумінного насоса (перистальтичного насоса, груші).
З водневою деполяризацією кородують метали, що стикаються з розчинами кислот. Наприклад, сталеві залізничні цистерни, в яких перевозять кислоти, металеві баки і різні апарати на хімічних заводах.
Показники корозії металів
Для кількісного виразу середньої (за час 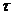 ) швидкості корозії металів існують такі показники корозії: глибинний Кп, показник зміни товщини утворюваної на металі плівки продуктів корозії Кh, негативний показник зміни маси Кm, об'ємний показник Коб, механічний показник, зокрема показник міцності К
) швидкості корозії металів існують такі показники корозії: глибинний Кп, показник зміни товщини утворюваної на металі плівки продуктів корозії Кh, негативний показник зміни маси Кm, об'ємний показник Коб, механічний показник, зокрема показник міцності К 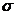 , показник зміни електричного опору Kr тощо .
, показник зміни електричного опору Kr тощо .
К-m = 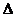 m/S
m/S 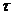 , г/м2год, (7.9)
, г/м2год, (7.9)
де 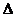 m – зменшення маси металу за час дослідження після видалення продуктів корозії, г;
m – зменшення маси металу за час дослідження після видалення продуктів корозії, г;
S – поверхня металу, мм.
Кп = К- m 8,76/рме,мм/рік, (7.10)
де рме – густина металу, г / м3.
Ко6 = DV / S 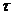 , см3 / (см2 год), (7.11)
, см3 / (см2 год), (7.11)
де DV - об'єм поглинутого або виділеного газу, зведений до нормальних умов (t = 0 °С і Р = 1 атм), см3.
Хімічні реактиви та посуд
Реактиви:
· кислота сірчана Н2SO4, 0,1 н розчин;
· кислота соляна НС1, 0,1 н розчин;
· вода дистильована;
· зразки металу.
Прилади та посуд:
· стакани хімічні V = 250 см3 - 4 шт.;
· бюретки з краном V = 50 см3 - 2 шт.;
· лійка - 2 шт.;
· штатив - 2 шт.;
· ваги технічні;
· лінійка;
· насос;
· кришки - 2 шт.
Опис лабораторної установки
Лабораторна установка для визначення кінетики корозії з водневою деполяризацією (рисунок 7.1) складається з двох бюреток 1, опущених в стакани 2. Бюретки мають крани 3, в нижній отвір вставляється лійка 4 з закріпленим зразком 5. Бюретки закріплені на штативах 6, з'єднані трубкою 7 за допомогою трійника 8 і насоса 9. Стакани закриті кришками 10.

1 – бюретка; 2 – стакан; 3 – кран; 4 – лійка; 5 – зразок; 6 – штатив;
7 – трубка; 8 – трійник; 9 – насос; 10 – кришка.
Рисунок 7.1 - Лабораторна установка для визначення кінетики корозії з водневою деполяризацію.
4. Послідовність виконання роботи
1. Зразки, видані лаборантом, зачищають наждаком та зважують на технічних вагах, вимірюють розміри та вираховують площу.
2. Закріплюють зразки на лійках 4 і в бюретках 1.
3. Закріплюють бюретки на одному рівні на штативі 6, опускають в стакани 2.
4. В стакани 2 заливають 0,1 н розчин сірчаної кислоти - в один, і 0,1н розчин соляної кислоти - в другий і закривають кришкою 10.
5. Відкривають крани на бюретках 1 і заповнюють їх розчином кислот до верхньої поділки за допомогою насоса 9, закривають крани 3.
6. Виконують заміри зміни об'єму рідини в бюретці 1 через задані проміжки часу 5, 10, 20 хв в залежності від швидкості виділення водню.
Виділення об'єму водню пропорційне звільненому від розчину, кислоти об'єму бюретки.
7. Відкривають крани 3, звільняють бюретки 1 від розчину кислоти (вона зливається самопливом у стакан 2).
8. Піднімають бюретки 1 з розчину кислоти, змінюють стакани на стакани з водою, опускають лійки із зразками 5 для промивання у воду.
9. Промитий зразок 5 металу виймають з лійки 4, просушують фільтром і зважують на технічних вагах.
10. Дослід повторюють із зразком іншого металу
Опрацювання результатів
1. Виконують розрахунки за формулами (7.9), (7.10), (7.11).
2.За зміною об'ємів, які займає водень, після 10 замірів будують графік для двох зразків з координатними осями: корозія - час, швидкість корозії - час.
3.Дані досліду кожного зразка заносять у таблицю 7.1
| № зразка, середовище | Час досліду, хв | Негативний показник корозії К-m,г/(м2год) | Об’ємний показник корозії Коб, см3/(см2год) | Об’єм Н2 від початку досліду, см3 | Швидкість корозії, см3/(см2хв) |
| 1 0.1н HCl | |||||
| 2 0,1н H2SO4 | |||||
| 3 0.1н HCl | |||||
| і т.ін |
6.Вимоги до звіту
Звіт повинен мати короткі, але вичерпні теоретичні відомості, опис лабораторної установки, хід виконання роботи, всі результати вимірів і необхідні розрахунки. Мають бути зроблені всі досліди, побудовані графіки, які вказані в методичних вказівках. У кінці звіту повинен бути висновок про виконану роботу.
7. Техніка безпеки
1. Обережно поводитися з кислотами, які використовуються в лабораторній роботі.
2. Після досліду кислоти злити в посуд, підписаний "для зливу кислот".
3. Тримати робоче місце в чистоті, не захаращуючи його сторонніми предметами.
8. Контрольні питання
1. Що називають корозією?
2. Умови її протікання.
3. Види корозії за умовами, характером руйнування.
4. Швидкість корозії.
5. Хімічний та електрохімічний механізм розчинення металів у електролітах.
6. Воднева деполяризація.
7. Показники корозії металів.
8. Методи боротьби з корозією.
9. Література
1. Жук Н.П. Курс теории коррозии металлов. - М.: Металлургия, 1976. - 472 с.
2. Углич Г. Коррозия металлов. - М.: Металлургия, 1986. - 308 с.
3. Вольфкович С.И. Практикум по химической технологии. - МГУ, 1968.- 376 с.
4. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
ЛАБОРАТОРНА РОБОТА 8
Дата добавления: 2018-08-06; просмотров: 448; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
