ВИВЧЕННЯ МОДЕЛІ ПРОТОЧНОГО ТРУБЧАСТОГО РЕАКТОРА
МІНІСТЕРСТВО НАУКИ ТА ОСВІТИ УКРАЇНИ
ЧЕРКАСЬКИЙ ДЕРЖАВНИЙ ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
МЕТОДИЧНІ ВКАЗІВКИ
до виконання лабораторних робіт з курсу
"ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ"
для студентів напряму підготовки 6.051301 «Хімічна технологія»
всіх форм навчання
Затверджено
на засіданні кафедри ХТНР
Протокол № 6 від 16.02. 2010 р.
Черкаси 2010
Методичні вказівки до виконання лабораторних робіт з курсу "Загальна хімічна технологія" для студентів всіх форм навчання напрямку підготовки 6.051301 „Хімічна технологія”/ Укл. Галенко М.В., Семененко Т.І., Столяренко Г.С. - Черкаси: ЧДТУ, 2010. - 76 с.
Укладачі: Столяренко Г.С, д.т.н., професор
Галенко М.В.
Семененко Т.І.
Рецензент Солодовник Т.В., к.х.н.
ПРОГРАМА НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
Основна мета курсу – вивчення загальних, найбільш важливих принципових основ виробничих процесів. В програму курсу входить розглядання на конкретних прикладах порядку дослідження хіміко-технологічних процесів, підхід до визначення оптимальних фізико-хімічних умов виробництва.
Раціональний вибір хімічних апаратів, складання технологічних схем хімічних процесів та оцінка їх основних матеріальних та енергетичних пошуків, зв'язок хімічної технології з охороною навколишнього середовища. Використання нових технологій в області промислового синтезу.
|
|
|
3 вивченням загальної хімічної технології студенти повинні:
· отримати знання і навики в теоретичних питаннях хімічної технології;
· зрозуміти суть фізико-хімічних процесів, які відбуваються в апаратах технологічної схеми;
· навчитися робити економiчну оцінку сировинної бази та продуктів хімічних виробництв;
· знаходити перспективи розвитку галузі в світлі науково - технологічного процесу з використанням прийомів
· маркетінгу.
Для студентів денної форми навчання вивчення дисципліни передбачено у V, VI семестрі з виконанням розрахунково – графічної роботи, практичних робіт і складання заліків та іспитів.
Для студентів заочної форми навчання вивчення дисципліни передбачено у VII семестрі з виконанням контрольної роботи, практичних занять, складання заліку і іспиту.
Далі наведено розподіл годин для студентів денної та заочної форми навчання і структуру модулів і залікового кредиту.
Таблиця 1.1 – Розподіл годин з дисципліни за формами і видами навчання
| Форма навчання | Курс | Семестр | Кредити ECTS | Аудиторні заняття (год.) | Самостійна робота (год.) | КР, РГР, КП, семестр | Заліки (семестр) | Іспит (семестр) | Всього годин в семестрі
| |||||
| Всього | Лекції | Практич. заняття | Лабор. заняття | |||||||||||
| Денна | 3 | 5 | 3,75 | 90 | 36 | 18 | 36 | 45 | 5 | 5 | 5 | 135 | ||
| 6 | 4,75 | 119 | 34 | 34 | 51 | 52 | 6 | 6 | 6 | 171 | ||||
| Заочна | 4 | 7 | 8,5 | 60 | 20 | 20 | 20 | 246 | 7 | 7 | 7 | 306 | ||
Таблиця 1.2 – Структура модулів дисципліни
| Форма навчання | Курс | Семестр | Номер модуля | Назва модуля | кількість годин | Навчальні тижні | Номери тем модуля, відповідно робочої програми | Разом кількість годин за семестр |
| Денна |
3 | 6 | 1 | Хімічні процеси та реактри | 67 | 1-9 | 1-8 |
135 |
| 2 | Гетерогенні процеси та теплові режими реакто-рів. Загальні принципи розробки ХТС | 68 | 10-18 | 9-14 | ||||
| 7 | 3 | Технології виробництва кислот, мінеральних солей, добрив | 85 | 1-12 | 15-17 |
171 | ||
| 4 | Технології органічного синтезу | 86 | 13-17 | 18,19 |
Таблиця 1.3 - Структура залікового кредиту навчальної дисципліни
„Загальна хімічна технологія”, 6 і 7 семестри
| Семестр | Кредитний модуль | Загальний обсяг, годин | Аудиторних занять, годин | Самостійна робота, годин | Контрольний захід |
| VI | Модуль 1 | 67 | 45 | 22 | ВК; ЛМ; ІКР ПМК |
| Модуль 2 | 68 | 45 | 23 | ЛМ; ІКР; ТК; ПМК | |
| VII | Модуль 3 | 85 | 59 | 26 | ВК; ТК; ЛМ; ПКР; ПМК |
| Модуль 4 | 86 | 60 | 26 | ТК; ЛМ; ПКР; ПМК | |
| Разом: | 306 | 209 | 97 |
|
|
|
Примітка: ВК – вхідний контроль; ТК – тестовий контроль; ЛМ – лабораторний модуль; ІКР – індивідуальна контрольна робота: ПКР – поточна контрольна робота; ПМК – підсумковий модульний контроль
Таблиця 1.4 – Назви тем лабораторних робіт, їх зміст та об`єм
| № п/п | Назва тем лабораторних занять | ОБ`ЄМ В ГОДИНАХ |
| Хімічні процеси та реактри | ||
| 1 | Техніка безпеки при роботі в хімічній лабораторії | 2 |
| 2 | Визначення залежності швидкості хімічних реакцій від різних умов. | 6 |
| 3 | Вивчення моделі проточного трубчастого реактора. | 5 |
| 4 | Вивчення моделі реактору ідеального змішування | 5 |
| Разом | 18 | |
| Гетерогенні процеси та теплові режими реакторів. Загальні принципи розробки ХТС | ||
| 4 | Визначення фізичних характеристик твердих сипучих хімічних реагентів | 6 |
| 5 | Одержання нафтопродуктів прямою перегонкою нафти | 6 |
| 6 | Технічний аналіз нафтопродуктів | 6 |
| Разом | 18 | |
| Всього годин за VI семестр: | 36 | |
| Технології виробництва кислот, мінеральних солей, добрив | ||
| 7 | Дослідження корозії металів | 6 |
| 8 | Отримання їдкого натрію (NaOH) і хлору електрохімічним методом | 6 |
| 9 | Одержання сульфату амонію. | 6 |
| 10 | Застосування води в хімічній технології | 7 |
| Разом | 25 | |
| Технології органічного синтезу | ||
| 11 | Одержання полісульфідних каучуків або тіоколів | 7 |
| 12 | Одержаним і дослідження конденсаційних смол | 7 |
| 13 | Електролітичне нікелювання і мідніння | 6 |
| 14 | Очищення хімічних реагентів (реактивів) методом прямої перегонки | 6 |
| Разом | 26 | |
| Всього годин за VII семестр: | 51 | |
| Разом годин: | 87 |
|
|
|
ЛАБОРАТОРНА РОБОТА №1
ВИЗНАЧЕННЯ ЗАЛЕЖНОСТІ ШВИДКОСТІ ХІМІЧНИХ
РЕАКЦІЙ ВІД РІЗНИХ УМОВ
Мета роботи: практичне визначення залежності швидкості хімічних реакцій від різних умов.
1. Теоретичні основи
Швидкість технологічних процесів - це результуюча величина швидкостей прямої, зворотної та сторонньої реакцій, а також конвекції і дифузії вихідних речовин у зону реакції і продуктів реакції з цієї зони.
Якщо швидкість реакції менша за швидкість дифузійних процесів, підвід реагуючих речовин і відвід продуктів, то процес протікає в кінетичній області і для його прискорення слід підвищувати температуру, концентрацію реагуючих речовин із можливим використанням каталізаторів. В кінетичній області протікає більшість позитивних процесів. Якщо швидкість реакції набагато більша за дифузійні процеси, то загальна швидкість визначається дифузією, оскільки процес відбувається у дифузійній області. Такий процес прискорюється перш за все перемішуванням реагуючих речовин та регулюванням тиску. Використання каталізаторів не прискорює дифузію.
Основні рівняння швидкості хімічного процесу:
1. Для гомогенних процесів швидкість процесу визначається підвищенням концентрації продуктів реакції Сп за часом:
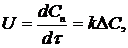 (1.1)
(1.1)
де k - константа швидкості процесу;
DС - рушійна сила, яка представлена виразом добутку діючих концентрацій вихідних речовин.
2. Для гетерогенних процесів, що проходять у дифузійній області при відомій поверхні F зіткнення фаз:
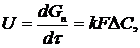 (1.2)
(1.2)
де Gп - кількість продукту, одержана за годину;
k - константа швидкості процесу, що також називається коефіцієнтом масопередачі.
3. Для гомогенних і гетерогенних процесів у кінетичній дифузійній областях швидкість процесу визначається:
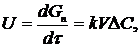 (1.3)
(1.3)
де V - реагуючий об'єм.
Константа швидкості процесу k - складна величина, яка залежить від хімічних і фізичних властивостей реагуючих речовин, швидкостей потоків, реагуючих мас, перемішування компонентів і конструкції реакційних апаратів.
Формули для розрахунків k надто різні. В більшості випадків використовують експериментальні значення, що розраховуються за дослідними даними кінетичних рівнянь:
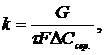 (1.4)
(1.4)
де DСсер - середня логарифмічна рушійна сила процесу.
Залежність константи швидкості реакції від температури виражається рівнянням Арреніуса:
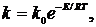 (1.5)
(1.5)
де kо - передекспоненціальна постійна величина рівняння Арреніуса;
Ε - енергія активації;
R - універсальна газова постійна;
Τ - термодинамічна температура.
Для газових реакцій з урахуванням впливу температури і тиску рівняння швидкості процесу має вигляд:
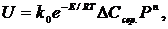 (1.6)
(1.6)
де DCсер. - середня рушійна сила процесу під атмосферним тиском;
Ρ - безрозмірний тиск в реакторі;
n - порядок реакції.
Середню рушійну силу процесу можна знайти за рівнянням:
 (1.7)
(1.7)
Каталізатори збільшують швидкість хімічних реакцій, не впливають на стехіометричне співвідношення реагуючих речовин. Суть прискореної дії каталізаторів грунтується на протіканні реакції за потрібним механізмом з участю каталізаторів.
Наприклад, синтез може відбуватися без каталізатора за рівнянням реакції:
А + В = АВ;
- з енергією активації Е. У присутності каталізатора відбуваються дві послідовні реакції:
А + [К] = А [К]
В + А [К] = АВ + [К];
- з меншим значенням енергії активації Ε1 і E2.
2. Хімічні реактиви, прилади та посуд
Реактиви:
· сірчана кислота H2SO4, розбавлена 1:5 і 1:10;
· соляна кислота НС1, розбавлена 1:1 і 1:3;
· оцтова кислота CH3COOH, розбавлена 1:5;
· цинк у гранулах і у вигляді пластинок;
· перекис водню Н2О2, 3% розчин;
· двоокис марганцю MgO2, порошок;
· уротропін або формалін.
Прилади:
· прилад для визначення залежності швидкості реакції від різних умов.
3. Опис лабораторної установки
Прилад дає можливість виявити вплив на швидкість хімічної реакції таких факторів:
- природи реагуючих речовин;
- концентрації реагуючих речовин;
- температури;
- поверхні зіткнення реагуючих речовин (ступеня подрібнення твердого реагенту);
- каталізатора;
- інгібітора.
Прилад, зображений на рисунку 1.1, складається з таких частин: дерев'яної панелі-підставки, двох демонстраційних пробірок, двох манометричних трубок, двох скляних трубок з пробками, двох гумових трубок, які з'єднують між собою прямі й зігнуті манометричні трубки. На дерев'яній панелі-підставці закріплені дві пробірки місткістю 50 мл, заткнуті гумовими пробками з отворами, в які вставлені скляні трубки. Вільні кінці цих трубок з'єднані за допомогою гумових трубок з манометричними. Між манометричними трубками на панелі розміщена шкала з позначками для спостерігання за рівнем рідини в трубках.

1 - дерев'яна панель-підставка; 2 – демонстраційні пробірки;
3 – манометричні трубки; 4 - скляні трубки з пробками;
5 - гумові трубки.
Рисунок 1.1 - Прилад для визначення залежності швидкості хімічних реакцій від різних умов
4. Послідовність виконання роботи
4.1. Вплив температури на швидкість реакції.
В одну пробірку наливають 10 мл розчину сірчаної кислоти кімнатної температури, а в другу - такий же об'єм кислоти, яка нагріта до 50° С. Кислота в обох випадках розбавлена (1 ;5).
Опускають одночасно в дві пробірки одну-дві гранули цинку. За різницею рівнів забарвленої рідини в манометричних трубках роблять висновок про швидкість хімічних реакцій.
4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
У дві пробірки наливають по 10 мл розчину розбавленої сірчаної кислоти (1:5). В одну з пробірок опускають одну гранулу цинку, а в другу - пластинку. В одній з пробірок спостерігається більш швидке збільшення рівня рідини.
4.3. Вплив каталізатора на швидкість хімічної реакції,
У дві пробірки наливають по 10 мл 3%-го розчину перекису водню і опускають по гранулі цинку. В одну з пробірок вносять на кінці скальпеля двоокис марганцю. Спостерігають швидке збільшення рівня рідини в манометричній трубці з каталізатором.
Аби довести, що каталізатор в результаті реакції не змінився, зливають рідину з пробірки, в якій знаходився каталізатор, промивають дистильованою водою і наливають новий об'єм (10 мл) перекису водню. Спостерігають той же ефект.
Крім двоокису марганцю можна використовувати як каталізатор окис міді, окис заліза та двоокис кремнію.
4.4. Вплив інгібітору на швидкість хімічної реакції.
У дві пробірки наливають по 10 мл сірчаної кислоти (1:5). Одночасно опускають в них по дві-три гранули цинку. Спостерігають рух стовпців забарвленої рідини в обох манометричних трубках.
У одну з пробірок додають невелику кількість подрібненого уротропіну. Через 1-2 хв спостерігають, що рух стовпця рідини в цій манометричній трубці різко сповільнився.
Як інгібітор можна використовувати формалін (в одну пробірку додати 1 мл формаліну, а в другу - такий же об'єм дистильованої води, щоб концентрація кислот в обох пробірках була однаковою).
5. Вимоги до звіту
У звіті коротко викладають теоретичні основи залежності хімічних реакцій від різних факторів, наводять схему установки, її опис, послідовність виконання роботи. Крім того, повинні бути наведені всі вихідні дані, одержані результати їх обробки, аналіз та висновки.
6. Техніка безпеки
1. У даній роботі виділяється водень, тому треба слідкувати, щоб поруч не було відкритого вогню.
2. Опускати гранули цинку треба по стінках, щоб не розбити дно пробірки.
3. Необхідно дотримуватися обережності при роботі з кислотами.
4. Щоб уникнути викиду рідини з манометричної трубки, слід додержуватися тієї кількості реактивів, які рекомендовані в методиці виконання роботи.
5. Після закінчення роботи з приладом пробірки слід вимити. Зберігати прилад необхідно в чистому вигляді.
7. Контрольні питання
1. Залежність швидкості хімічних реакцій від температури. Рівняння Арреніуса.
2. Залежність швидкості хімічної реакції від тиску і концентрації.
3. Змінювання енергії активації в присутності каталізатора.
8. Література
1. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
2. Мухленов И.П. Общая химическая технология. - М: Высшая школа, 1984.-256 с.
3. Кутепов О.М., Бондарева Т.И., "Беренгартен М.Г. Общая химическая технология. Учебник для вузов. - 2-е изд. испр. и доп. - М: Высшая школа, 1990. - 520 с.
ЛАБОРАТОРНА РОБОТА №2
ВИВЧЕННЯ МОДЕЛІ ПРОТОЧНОГО ТРУБЧАСТОГО РЕАКТОРА
Мета роботи: вивчення характеристик проточного трубчастого реактора.
Теоретичні основи
У реакторі ідеального витіснення (РІВ) всі частинки рухаються в заданому напрямку, не змішуючись, повністю витісняючи, подібно до поршня, частинки, які знаходяться попереду потоку (поршневий рух потоку).
Часовою характеристикоюРІВ служить рівняння:
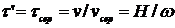 , (2.1)
, (2.1)
а також
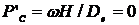 , (2.2)
, (2.2)
тому що Dе →0,
де τ' – час перебування у реакторі будь-якого елементарного об'єму;
τсер – середній час перебування;
Dе – ефективний коефіцієнт дифузії;
VC – витрати реакційної суміші;
V - реакційний об'єм.
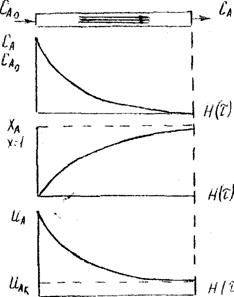 Зміни концентрації реагентів уздовж реактора в залежності від часу
Зміни концентрації реагентів уздовж реактора в залежності від часу
Зміни ступеня перетворення реагентів уздовж реактора в залежності від часу
Зміни швидкості реакції вздовж реактора в залежності від часу
Рисунок 2.1 - Епюра поршневого руху середовища
Матеріальний баланс (математична модель реактора) ідеального витіснення для стаціонарного режиму записується у вигляді рівняння:
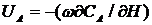 , (2.3)
, (2.3)
де са - концентрація основного вихідного компонента А, моль/л;
ω - лінійна швидкість потоку, м/с;
Н – висота (довжина) реактора, м;
UA – швидкість реакції, моль (м3/с)
З рівняння витікає умова стаціонарності процесу. Швидкість надходження речовини А дорівнює швидкості цієї речовини за хімічною реакцією.
Для розрахунку РІВ використовують рівняння, виведене на підставі матеріального балансу реактора:
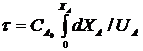 , (2.4)
, (2.4)
де τ – час перебування основного компонента А, с;
са - початкова концентрація компонента А, моль/л;
Х – ступінь перетворення.
У режимі, близькому до ідеального витіснення, працюють поточні трубчасті реактори, в яких відношення довжини реактора до його діаметра:
L /D > 10.
У реальному реакторі може відбуватися зворотне осьове і радіальне перемішування. Дифузійна модель трубчастого реактора, яка враховує осьове (поздовжнє) перемішування, має вигляд:
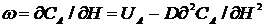 . (2.5)
. (2.5)
Відхилення режиму руху реакційної маси у реальному реакторі від ідеального реактора залежить від коефіцієнта поздовжнього перемішування D, швидкості потоку ω та довжини реактора L. Визначити це відхилення можна, порівнюючи об'єми ідеального і реального реакторів (або час перебування реакційної маси в тому чи іншому реакторі) для досягнення однакового ступеня перетворення реагентів.
У даній роботі проводиться дослідження реактора витіснення на прикладі реакцій другого порядку - омилення етилацетату лугом,
CH3COOH + NaOH ←→ CH3COONa + C2H5OH (2.6)
(за вказівкою викладача може статися заміна реагентів).
Дата добавления: 2018-08-06; просмотров: 248; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
