ОСНОВЫ ТЕРМОДИНАМИКИ , ПРАВИЛО ФАЗ.
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ
Учение о термодинамическом равновесии излагается в курсах термодинамики и во многих руководствах по физической химии. Однако ввиду важности понятий о равновесии для теоретических основ физико-химического анализа необходимо напомнить об основных положениях этого учения.
Системы, состояния, процессы
Прежде всего, следует дать определение понятию, которое в дальнейшем будет встречаться часто,— это понятие о материальной системе.
Материальной системой называется часть пространства, выделенная по тем или иным соображениям из остального пространства и заполненная веществом или веществами. Пространство, из которого выделена материальная система, называется внешней средой или просто средой.
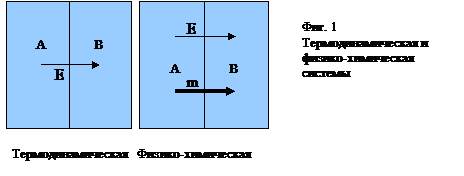
Термодинамической системой называется система, между отдельными частями которой возможен обмен энергией. Если между частями системы возможен обмен не только энергией, но и веществом, то такая система называется физико-химической (фиг.1).
В дальнейшем для упрощения указанные выше виды систем мы будем называть просто системами.
 |
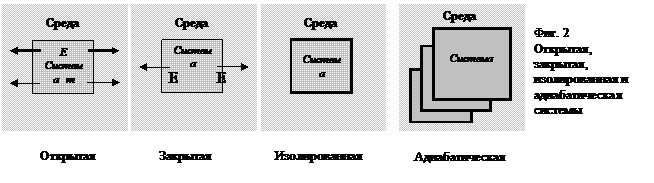
Система, которая может обмениваться с внешней средой веществом и энергией, называется открытой (фиг.2). Система, которая не может обмениваться с внешней средой веществом, называется закрытой. Система, которая не может обмениваться с внешней средой теплотой, называется адиабатической. Система, которая не может обмениваться с внешней средой ни веществом, ни энергией, называется изолированной, или замкнутой (фиг.2).
|
|
|
 |
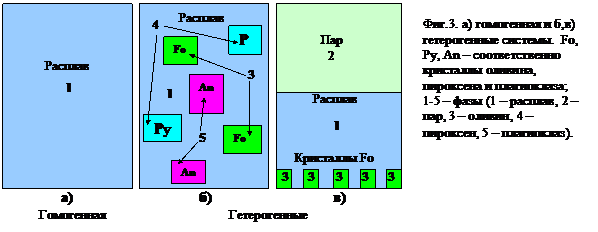
Если внутри системы есть поверхность раздела (отделяющая друг от друга части системы), на которой происходят резкие скачкообразные изменения какого-либо свойства, то такая система называется гетерогенной (фиг.3б,в). Примером гетерогенной системы может служить система вода — лед, так как в ней между водой и льдом имеют место скачкообразные изменения свойства, например удельного веса.
Термином фазаобозначается совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы некоторой поверхностью (поверхностью раздела). Фазы могут находиться в твердом, жидком или газообразном состоянии. Газы полностью смешиваются между собой независимо от состава; следовательно, в системе возможна только одна равновесная газовая фаза. Многие жидкости смешиваются в любых пропорциях с образованием одной, гомогенной, фазы, но некоторые из них обладают частичной или полной несмесимостью (например, масло и вода); такие жидкости сохраняются в виде разделенных фаз с отчетливой границей между ними. Некоторые твердые фазы имеют строго определенный состав (подобно кварцу, который существует только как относительно чистый SiO2). Химический состав других может изменяться в широких пределах: например, состав полевых шпатов типа плагиоклаза колеблется от NaAlSi3O8 до CaAl2Si2O8. Поскольку многие твердые фазы имеют определенный состав, в системе обычно присутствует несколько твердых фаз.
|
|
|
Система, внутри которой нет поверхностей раздела, называется гомогенной (фиг.3а), например раствор какого-либо вещества в сосуде, причем сосуд не считается частью системы. Однородной называется система, имеющая одинаковые экстенсивные отнесенные к единице массы, и интенсивные свойства в любых произвольно выбранных ее частях. Однородная система — гомогенная в состоянии равновесия. Любая гомогенная система представляет собой одну фазу. Гетерогенные же системы содержат не менее двух фаз.
 |
Дата добавления: 2018-08-06; просмотров: 541; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
