СОСТОЯНИЕ ФЛЮИДОВ В ЭНДОГЕННЫХ УСЛОВИЯХ
Жидкие (на основе воды) агенты, нагретые выше стандартной температуры и участвующие в минерало- и рудообразующих процессах, обычно называются гидротермальными растворами. Кроме того, в эндогенных условиях, а также на поверхности Земли в процессе вулканических извержений, в минералообразовании участвуют и газовые агенты. Термин «флюид» в традиционном понимании используется для обозначения надкритического состояния водных растворов в эндогенных процессах. Мы будем использовать этот термин в более широком понимании, т.е. для обозначения всех жидких, газовых и надкритических субстанций в эндогенных условиях за исключением магматических расплавов. Схематическую фазовую диаграмму водного флюида, являющегося основой эндогенных флюидов, можно представить в виде трех областей (фиг. 52), включающих область жидкости, газа и область переходную от жидкости к газу, ту, которая в обычном понимании называется областью «флюида».
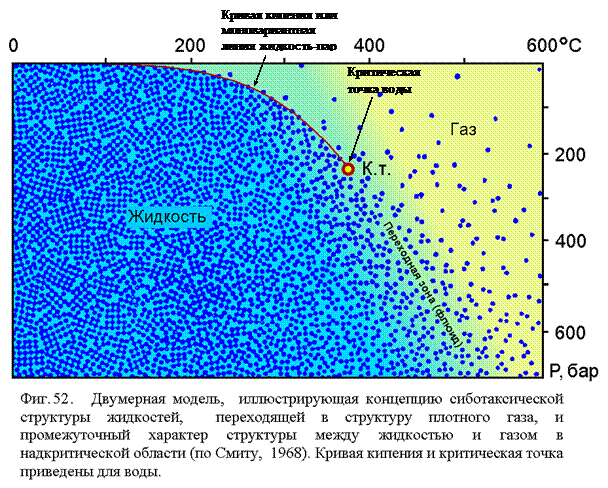 |
Можно считать установленным фактом, что физические свойства воды, резко выделяюие ее из ряда гидридов остальных элементов подгруппы кислорода, определяются специфическим взаимодействием молекул, называемым водородной связью. Другой важный факт заключается в том, что в жидкой воде хорошо выражен ближний порядок, при этом число молекул в первой координационной сфере близко таковому для льда. Можно утверждать, что в жидкой воде имеются элементы льдоподобной структуры называемой сиботаксической. По данным инфракрасной спектроскопии, считается, что водородные связи в воде сохраняются, по крайней мере, вплоть до критической точки и более в зависимости от давления. Исходя из этих данных можно считать, что на Р-Т диаграмме воды имеется область жидкости, где существует ближний порядок и вода состоит из элементов с льдоподобной структурой; область газа с одиночными молекулами воды, не связанными в какую-либо структуру и переходную область при закритических параметрах, где, по мере увеличения температуры, в жидкой воде уменьшается доля дьдоподобных кластеров и растет доля свободных молекул. Повышение давления способствует сближению молекул и связыванию их в кластерные структуры. Зависимость плотности воды от термодинамических параметров описывается рядом уравнений, причем каждое из них применимо лишь в ограниченной области Р-Т параметров (Ривкин, Александров, 1975). Изолинии плотности воды на Р-Т диаграмме приведены на фиг. 53.
Растворимость большинства твердых веществ зависит как от температуры, так и от давления. Увеличение температуры жидкой воды приводит к увеличению растворимости, также имеется положительная зависимость растворимости и от давления. Растворимость твердых веществ в газообразной воде может быть на несколько порядков ниже, чем в жидкой, однако газы могут неограниченно смешиваться с водяным паром в термодинамических условиях земной коры. Поэтому моновариантная кривая служит и границей по растворимости для твердых компонентов.
Кроме воды наиболее важными составными компонентами флюидов являются газы и твердые растворимые компоненты. Наиболее важными для эндогенных процессов являются NaCl, СО2 и некоторые другие (газы -Н2S, О2, N2, Н2, SO2, CO, углеводороды и др. , твердые растворимые компоненты – галогениды, сульфиды, сульфаты, SiO2 и т.д.).
 |
Роль флюидов в петро- и рудогенезисе чрезвычайно велика. Флюиды являются основным транспортным агентом тепла и вещества в мантии и земной коре. Основой эндогенного флюида в большинстве случаев является вода и лишь в исключительных случаях могут существовать «сухие» флюиды, состоящие из углеродсодержащих газов. Критические параметры водных флюидов чрезвычайно сильно зависят от содержания дополнительных компонентов – газов, солей, оксидов и гидрокидов. Присутствие солей и других твердых растворимых компонентов в водных растворах, как правило, повышают критические параметры флюида, а присутствие газовых компонентов обычно снижает критическую температуру при повышении критического давления. На фиг. 54 представлена схематическая диаграмма тройной системы Н2О+NaCl+CO2, где показано смещение критических точек в область более высоких температур и давлений растворов галита в воде с увеличением концентрации от 0 до 25 мас. % и снижение температуры и увеличение давления критических точек с возрастанием в системе количества СО2 (линии направленные влево-вниз). Фрагмент А этой диаграммы, показывающий растворимость СО2 в воде по данным (Takenouchi, Kennedy, 1964) и равновесное с жидкостью содержание углекислоты в газе представлен на фиг. 55.
Добавление солевых компонентов в водный флюид смещает не только критическую точку, но и саму кривую кипения, причем нонвариантные точки начала моновариантной кривой жидкость-пар находятся на линии ограничивающей область «кристаллы-пар» (фиг. 56). По мере увеличения концентрации растворов, кривые кипения смещаются вправо вплоть до достижения точки жидкого NaCl, а кривая критических точек системы Н2О+NaCl заканчивается в критической точке чистого галита.
Дата добавления: 2018-08-06; просмотров: 442; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
