Механизмы повреждающего действия электрического тока.
Электротравма может вызвать местные (знаки тока, ожоги) и общие изменения в организме. Местные реакции на электротравму. Знаки тока, ожоги возникают главным образом на местах входа и выхода тока в результате превращения электрической энергии в тепловую (тепло ДжоуляЛенца). Знаки тока появляются на коже, если температура в точке прохождения тока не превышает 120 °С, и представляют собой небольшие образования серовато-белого цвета («пергаментная» кожа), твердой консистенции, окаймленные волнообразным возвышением. В ряде случаев по окружности поврежденной ткани проступает ветвистый рисунок красного цвета, обусловленный параличом кровеносных сосудов.
При температуре в точке прохождения тока свыше 120 °С возникают ожоги: контактные - от выделения тепла при прохождении тока через ткани, оказывающие сопротивление, и термические - при воздействии пламени вольтовой дуги. Последние являются наиболее опасными.
Общие реакции организма на электротравму. При прохождении через тело электрический ток вызывает возбуждение нервных рецепторов и проводников, скелетной и гладкой мускулатуры, железистых тканей. Это приводит к возникновению тонических судорог скелетных и гладких мышц, что может сопровождаться отрывным переломом и вывихом конечностей, спазмом голосовых связок, остановкой дыхания, повышением кровяного давления, непроизвольным мочеиспусканием и дефекацией. Возбуждение нервной системы и органов внутренней секреции приводит к «выбросу» катехоламинов (адреналин, норадреналин), изменяет многие соматические и висцеральные функции организма.
|
|
|
Большое значение в механизмах поражающего эффекта электрического тока имеет его электрохимическое действие (электролиз). Преодолев сопротивление кожного покрова, электрический ток вызывает нарушение равновесия в клетках различных тканей, изменяет их биологический потенциал, приводит к поляризации клеточных мембран: на одних участках тканей - у анода - скапливаются отрицательно заряженные ионы (возникает щелочная реакция), у катода скапливаются положительно заряженные ионы (возникает кислая реакция). В результате значительным образом изменяется функциональное состояние клеток. Вследствие передвижения белковых молекул в участках кислой реакции под катодом возникает коагуляция белков (коагуляционный некроз), в участках щелочной реакции под анодом - набухание коллоидов (колликвационный некроз). Процессы электролиза в кардиомиоцитах вызывают укорочение рефрактерной фазы сердечного цикла, что приводит к нарастающей тахикардии. При несмертельной электротравме возникает судорожное сокращение мышц с временной потерей сознания, нарушением сердечной деятельности и (или) дыхания; может наступить клиническая смерть. При своевременном оказании помощи пострадавшие ощущают головокружение, головную боль, тошноту, светобоязнь; могут сохраняться нарушения функций скелетной мускулатуры.
|
|
|
Непосредственными причинами смерти при электротравме являются остановка дыхания и остановка сердца. Поражение дыхательного и сосудодвигательного центровобусловлено деполяризацией клеточных мембран и коагуляцией белков цитоплазмы.
Остановка дыхания может быть обусловлена: 1) поражением дыхательного центра; 2) спазмом позвоночных артерий, снабжающих кровью дыхательный центр; 3) спазмом дыхательной мускулатуры; 4) нарушением проходимости дыхательных путей вследствие ларингоспазма.
Остановка сердцаможет возникнуть вследствие: 1) фибрилляции желудочков; 2) спазма коронарных сосудов; 3) поражения сосудодвигательного центра; 4) повышения тонуса блуждающего нерва.
2 Причины остановки сердца при действии электрического тока- смотри в 1 вопрос
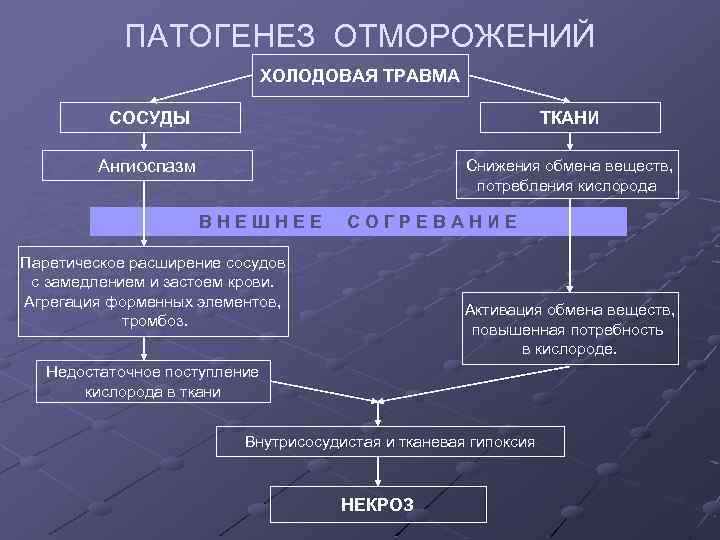
3 Холодовая болезнь. Проявления, патогенез
4 Свойства радиоктивного излучения
По своей природе все ионизирующие излучения подразделяются на электромагнитные (рентгеновские излучения и γ-лучи, сопровождающие радиоактивный распад) и корпускулярные (заряженные частицы: ядра гелия - α-лучи, электроны - β-лучи, протоны, π-мезоны, а также нейтроны, не несущие электрического заряда). Повреждающее действие различных видов ионизирующей радиации зависит от величины плотности ионизации в тканях и их проникающей способности. Чем короче путь прохождения фотонов и частиц в тканях, тем больше вызванная ими плотность ионизации и сильнее повреждающее действие. Наибольшая ионизирующая способность у α-лучей, имеющих длину пробега в биологических тканях несколько десятков микрометров, наименьшая - у γ-лучей, обладающих большой проникающей способностью. Биологические эффекты разных видов ионизирующей радиации определяются не только общим количеством поглощенной энергии, но и распределением ее в тканях. Для сравнительной количественной оценки биологического действия различных видов излучения определяют их относительную биологическую эффективность (ОБЭ). Наибольшей биологической эффективностью характеризуются α-излучения, протоны и быстрые нейтроны, ОБЭ для которых равняется 10. В качестве критерия для определения ОБЭ используются показатели смертности, степень гематологических и морфологических изменений в тканях и органах, действие на половые железы и др. В связи с этим ОБЭ не является постоянной величиной. Биологические эффекты определяются не только видом и величиной поглощенной дозы излучения, но также ее мощностью. Единицей измерения дозы является грей (Гр), а для сравнительной биологической оценки различных видов излучений используется специальная единица - бэр. Чем выше мощность дозы, тем больше биологическая активность. Повреждающее действие ионизирующей радиации при кратковременном облучении более выражено, чем при длительном облучении в одной и той же дозе. Облучение может быть однократным, дробным и длительным. При дробном (фракционированном) и длительном облучении поражение организма вызывается более высокими суммарными дозами. Тяжесть поражения ионизирующей радиацией зависит также от площади облучаемой поверхности тела (общее и местное), особенности индивидуальной реактивности, возраста, пола и функционального состояния организма перед облучением
|
|
|
|
|
|
5 Горная и высотная болезнь. Особенности развития, отличия друг от друга

6 Ожоговый шок, стадии, особенности развития
Ожоговый шок- патологический процесс, развивающийся при обширных термических повреждениях кожи и глубжележащих тканей, он продолжается в зависимости от площади и глубины поражения, своевременности и адекватности лечения до 72 ч.
Специфические черты ожогового шока, отличающие его от травматического, следующие:
• отсутствие кровопотери;
• выраженная плазмопотеря;
• гемолиз;
• своеобразие нарушения функций поч
В развитии ожогового шока следует выделять два основных патогенетических механизма :
• Чрезмерная афферентная (болевая) импульсация приводит к изменению функций ЦНС, характеризующемуся сначала возбуждением, а затем торможением коры и подкоркового слоя, раздражением центра симпатической нервной системы, усилением деятельности эндокринных желёз. Последнее в свою очередь вызывает увеличение поступления в кровь АКТГ, антидиуретического гормона гипофиза, катехоламинов, кортикостероидов и других гормонов. Это приводит к спазму периферических сосудов при сохранении тонуса сосудов жизненно важных органов, происходит перераспределение крови, уменьшается ОЦК.
• Вследствие термического поражения кожи и подлежащих тканей под действием медиаторов воспаления возникают как местные, так и тяжёлые общие расстройства: выраженная плазмопотеря, нарушение микроциркуляции, массивный гемолиз, изменение водно-электролитного баланса и кислотно-основного равновесия, нарушение функций почек.
Ведущий патогенетический фактор ожогового шока - плазмопотеря.Потеря плазмы во многом связана с повышением проницаемости стенок капилляров вследствие накопления в ожоговой ткани вазоактивных веществ (гистамина и серотонина). Через капилляры пропотевает большое количество плазмы, происходит отёк тканей поражённой области, ещё больше уменьшается ОЦК. Проницаемость сосудов нарушается сразу после ожога, но клинически выраженного значения достигает спустя 6-8 ч, когда становится явным снижение ОЦК.
Развивающаяся гиповолемия становится причиной гемодинамических расстройств, обусловливающих дальнейшее нарушение микроциркуляциив почках, печени, поджелудочной железе. Этому же способствуют развивающиеся гемоконцентрация и реологические расстройства. Микроциркуляторные нарушения вызывают вторичный некроз в зоне термического воздействия, образование острых эрозий и язв в желудочно-кишечном тракте, ранние пневмонии, нарушение функций печени, почек, сердца и т.д.
Развитие гемолиза - одна из причин повышения содержания калия в плазме крови, что из-за повреждения клеточных мембран приводит к перемещению натрия внутрь клеток. В результате развивается внутриклеточный отёк.
Изменения водно-электролитного и кислотно-основного баланса.В первые часы после ожога объём внеклеточной жидкости уменьшается на 15-20% и более за счёт интенсивного испарения с поверхности ожога, через здоровую кожу, с дыханием и рвотными массами.Циркуляцию воды и электролитов нормализуют альдостерон и антидиуретический гормон. Повышение их содержания приводит к увеличению реабсорбции воды и натрия в почечных канальцах. Постепенно развивается метаболический ацидоз.Нарушение функций почек. Причиной олигурии становится сокращение почечного кровотока из-за спазма сосудов почек, уменьшения ОЦК, нарушения реологических свойств крови, а также действия продуктов гемолиза и эндотоксинов.

7 Действие повышенного барометрического давления
Болезнетворному действию повышенного атмосферного давления (гипербарии) подвергаются при погружении под воду при водолазных и кессонных работах. При быстром переходе из среды с нормальным атмосферным давлением в среду с повышенным давлением (компрессии) может возникнуть вдавление барабанной перепонки, что при непроходимости евстахиевой трубы становится причиной резкой боли в ушах, сжатие кишечных газов, повышенное кровенаполнение внутренних органов. При очень быстром (резком) погружении на большую глубину может произойти разрыв кровеносных сосудов и легочных альвеол.
Основной же болезнетворный эффект гипербарии в период компрессии связан с повышенным растворением газов в жидких средах организма (сатурацией). Существует прямая зависимость между объемом растворенного газа в крови и тканях организма и его парциальным давлением во вдыхаемом воздухе. При погружении в воду через каждые 10,3 м давление увеличивается на 1 атм, соответственно повышается и количество растворенного азота. Особенно активно насыщаются азотом органы, богатые жирами (жировая ткань растворяет в 5 раз больше азота, чем кровь). В связи с большим содержанием липидов в первую очередь поражается нервная система, легкое возбуждение («глубинный восторг») быстро сменяется наркотическим, а затем и токсическим эффектом - ослаблением концентрации внимания, головными болями, головокружением, нарушением нервно-мышечной координации, возможной потерей сознания. Для предупреждения этих осложнений в водолазных работах целесообразно использовать кислородногелиевые смеси, поскольку гелий хуже (чем азот) растворяется в нервной ткани и является индифферентным для организма.
При переходе из области повышенного барометрического давления в область нормального атмосферного давления (декомпрессия) развиваются основные симптомы кессонной (декомпрессионной) болезни, обусловленные снижением растворимости газов (десатурацией). Высвобождающийся в избытке из тканей азот не успевает диффундировать из крови через легкие наружу и образует газовые пузырьки. Если диаметр пузырьков превышает просвет капилляров (свыше 8 мкм), возникает газовая эмболия, обусловливающая основные проявления декомпрессионной болезни - мышечно-суставные и загрудинные боли, нарушение зрения, кожный зуд, вегетососудистые и мозговые нарушения, поражения периферических нервов.
8 Ожоговая болезнь, особенности развития
Ожоговая болезнь - разносторонние функциональные нарушения внутренних органов и систем целостного организма, обусловленные обширными (более 10-15% поверхности тела) и глубокими ожогами. В развитии ожоговой болезни выделяют четыре периода:
1) ожоговый шок (СМОТРИ В ВОПРОС 6)
2) общую токсемию - результат аутоинтоксикации продуктами распада тканей, образующимися на месте ожога (денатурированный белок, биологически активные амины, полипептиды и др.), и выработки специфических ожоговых аутоантител. Кроме того, в коже животных и человека обнаружен ожоговый аутоантиген, отсутствующий у здоровых людей и в тканях с другим характером повреждения
3) септикотоксемию (присоединение инфекции)
4) реконвалесценцию (восстановление).
9 Опишите 1 стадию лучевой болезни
Первая стадия – 100-200 рад
Для нее характерны такие признаки облучения радиацией:слабость,тошнота,рвота,сонливость,головная боль,горечь или сухость во рту.
Если доза облучения превысила 10 Гр, к перечисленным добавляются следующие симптомы:диарея,лихорадка,артериальная гипотония,обморок.
На фоне всего этого возникает:кожная эритема (аномальное покраснение) с синюшным отливом,реактивный лейкоцитоз (избыток белых кровяных клеток), сменяющийся через день-два лимфопенией и лейкопенией (понижение количества лимфоцитов и лейкоцитов соответственно).
10 Токи высокой частоты, их специфическое действие
Частота переменного тока. Считается, что патогенным эффектом (возникновение фибрилляции желудочков) обладает переменный ток частотой 40-60 Гц. Переменные токи частотой 1 000 000 Гц и выше не опасны, но при высоком напряжении (токи Тесла, д'Арсонваля, диатермические токи) они оказывают тепловое действие и применяются с лечебной целью.
11 Простудные болезни, патогенез
Входными воротами инфекции чаще всего служат верхние дыхательные пути, реже конъюнктива глаз и пищеварительный тракт. Все возбудители ОРВИ эпителиотропны. Вирусы адсорбируются (фиксируются) на эпителиальных клетках, проникают в их цитоплазму, где подвергаются ферментативной дезинтеграции. Последующая репродукция возбудителя приводит к дистрофическим изменениям клеток и воспалительной реакции слизистой оболочки в месте входных ворот. Каждое заболевание из группы ОРВИ имеет отличительные черты в соответствии с тропностью тех или иных вирусов к определённым отделам дыхательной системы. Вирусы гриппа, РСВ и аденовирусы могут поражать эпителий как верхних, так и нижних дыхательных путей с развитием бронхита, бронхиолита и синдрома обструкции дыхательных путей, при риновирусной инфекции преимущественно
поражается эпителий носовой полости, а при парагриппе - гортани. Кроме того, аденовирусы обладают тропностью к лимфоидной ткани и эпителиальным клеткам слизистой оболочки конъюнктивы.Через повреждённые эпителиальные барьеры возбудители ОРВИ проникают в кровоток. Выраженность и продолжительность фазы вирусемии зависит от степени дистрофических изменений эпителия, распространённости процесса, состояния местного и гуморального иммунитета, преморбидного фона и возраста ребёнка, а также от особенностей возбудителя. Продукты распада клеток, поступающие наряду с вирусами в кровь, оказывают токсическое и токсико-аллергическое действия. Токсическое действие в основном направлено на ЦНС и сердечно-сосудистую систему. Из-за нарушений микроциркуляции возникают гемодинамические расстройства в различных органах и системах. При наличии предшествующей сенсибилизации возможно развитие аллергических и аутоаллергических реакций.Поражение эпителия дыхательных путей приводит к нарушению его барьерной функции и способствует присоединению бактериальной флоры с развитием осложнений.
12 Механизмы действия ультрафиолетовых лучей
Диапазон УФ-излучения делят на три области: область А (длинноволновая) - 400-320 нм; область В (средневолновая) - 320-280 нм; область С (коротковолновая) - 280-200 нм.
Область А называется также флуоресцентной (по способности вызывать свечение некоторых веществ, например в люминесцентных лампах), или загарной в связи с пигментообразующим эффектом: под влиянием УФ-излучения из аминокислоты тирозина образуется меланин, который является защитным средством организма от избыточного УФ-излучения.
Область В (при непродолжительном действии УФ-излучения в небольших дозах) характеризуется сильным общестимулирующим эффектом. Механизм общестимулирующего фотохимического действия УФ-излучения связан со способностью его возбуждать атомы, повышать их реакционную способность. В целом это приводит к повышению активности химических реакций в клетках, что оказывает стимулирующее действие на обменные и трофические процессы. В конечном счете усиливаются рост и регенерация тканей, повышается сопротивляемость организма к действию инфекционных и токсических агентов, улучшается физическая и умственная работоспособность. УФизлучение в диапазоне 315-265 нм области В обладает витаминообразующим антирахитическим действием: под его влиянием из 7,8-дегидрохолестерина синтезируется витамин D3 (холекальциферол).
Область С обладает выраженным бактерицидным действием, максимум которого приходится на длину волны 254 нм. Одноразовое избыточное УФ-облучение незагоревшей кожи вызывает ее фотохимический ожог, сопровождающийся развитием эритемы и волдырной реакции на коже, повышением температуры тела, головной болью, общим болезненным состоянием. Может возникнуть поражение конъюнктивы глаз (фотоофтальмия), проявляющееся ее покраснением и отечностью, ощущением жжения и «песка» в глазах, слезотечением, резко выраженной светобоязнью. Явления фотоофтальмии могут наблюдаться как от прямого солнечного света, так и от рассеянного и отраженного (от снега, песка в пустыне), а также при работе с искусственными источниками УФ-излучения, например при электросварке.
Патогенный эффект одноразового избыточного УФ-облучения (фотохимический ожог) связан с активацией свободнорадикального (перекисного) окисления липидов, приводящей к повреждению мембран, распаду белковых молекул, гибели клеток в целом (см. главу 3). Избыточное УФ-излучение может провоцировать обострение некоторых хронических заболеваний (ревматизм, язвенная болезнь желудка, туберкулез и др.). При интенсивном УФ-облучении вследствие повышенного образования меланина и деструкции белков возрастает потребность организма в незаменимых аминокислотах, витаминах, солях кальция и др. Избыточное УФ-облучение в диапазоне волн длиной 280-200 нм (область С) может привести к инактивации холекальциферола - к превращению его в индифферентные (супрастерины) и даже вредные (токсистерин) вещества, что необходимо учитывать при профилактических УФоблучениях. Длительное чрезмерное УФ-облучение может способствовать образованию перекисных соединений и эпоксидных веществ, обладающих мутагенным эффектом, и индуцировать возникновение базально-клеточного и чешуйчато-клеточного рака кожи, особенно у людей со светлой кожей. Действие УФ-излучения усиливается так называемыми фотосенсибилизаторами. К ним относятся краски (метиленовый голубой, бенгальская роза), холестерин и порфирины, а также контактные фотосенсибилизаторы (духи, лосьоны, губная помада, кремы и другие косметические средства). Известны случаи повышенной чувствительности к УФ излучению - фотоаллергия. Так, например, у лиц с высоким содержанием порфиринов в крови вследствие нарушения превращений гемоглобина (например, при гематопорфирии) даже после кратковременного пребывания на солнце могут возникнуть ожоги и состояние тяжелой интоксикации токсическими продуктами облученных порфиринов. Особо высокой чувствительностью к УФ излучению обладают больные пигментной ксеродермой. Возникающие в результате действия УФ-облучения ожоги на открытых участках кожи у этих пациентов в 50% случаев переходят в карциному. Общее действие УФ-излучения совместно с тепловым действием солнечных лучей (инфракрасные лучи, прогревающие более глубокие ткани) проявляется в форме так называемого солнечного удара. Действие УФ-излучения на нервную систему опосредуется через облученные в капиллярах кожи белки крови и холестерин. Возникает возбуждение вегетативных центров гипоталамуса и подкорковых узлов, повышение температуры тела, повышение и далее падение кровяного давления, сонливость, коллапс и смерть от паралича дыхательного центра.
13 Механизм действия канцерогенов
На I стадии (стадия инициации) под влиянием канцерогенных факторов из одной нормальной исходной клетки в результате стойкого необратимого нарушения генетического материала образуется одна трансформированная клетка. Этот процесс называется опухолевой трансформацией. Канцерогены взаимодействуют с локусами ДНК, содержащими гены, которые регулируют пролиферацию (протоонкогены и антионкогены). Происходит экспрессия протоонкогенов, преобразующихся в онкогены, и инактивация антионкогенов. Вследствие этого клетка становится иммортализованной и потенциально способной к неограниченному делению, но для этого требуется ряд дополнительных условий.
На II стадии (стадия промоции, или активации) происходит активация транформированной клетки под влиянием промотора и последующее превращение ее в активную, пролиферирующую опухолевую клетку. Промоторы - это вещества, которые не являются канцерогенами, не повреждают ДНК, но их воздействие стимулирует пролиферацию уже имеющихся трансформированных клеток. Главное в промоции - стимуляция клеточного деления, вследствие чего создается критическая масса инициированных клеток. К промоторам относятся фенол, скипидар, карболовый эфир и др. Присутствие промотора, однако, необязательно для индукции опухоли. Он необходим только в случае действия так называемого неполного канцерогена или полного канцерогена, но используемого в таких низких дозах, которые обычно не вызывают опухоли. Полный канцероген, действующий на ткани в достаточно высокой дозе, обладает как инициирующим, так и промоцирующим действием. Неполными канцерогенами считаются те вещества, у которых бластомогенные свойства проявляются только после действия промоцирующего агента. В отличие от инициирующих агентов эффект промоторов может быть обратим, особенно на ранних стадиях формирования опухоли. В течение промоции инициированная клетка приобретает фенотипические свойства трансформированной клетки в результате изменений генной экспрессии (эпигенетический механизм). Однако для индукции опухоли необходимо длительное и непрерывное воздействие промотора. Следовательно, промоторы могут представлять такую же опасность для индукции опухолей, как и полные канцерогены. Так, например, промотор н-додекан может усиливать канцерогенность бенз(а)пирена в 1000 раз. Фаза промоции в отличие от стадии инициации обратима, по крайней мере на раннем этапе неопластического процесса.
Основные положения канцерогенеза можно обобщить следующим образом:
1) для индукции опухоли недостаточно воздействия одного инициатора (канцерогена) или одного промотора;
2) действия инициатора и промотора не перекрываются во времени;
3) вероятность возникновения опухоли увеличивается в том случае, если промотор действует после инициатора, а не наоборот;
4) интервал между воздействием инициатора и промотора не влияет на возникновение опухоли; 5) индукция опухоли зависит лишь от дозы инициатора.
На III стадии (стадия прогрессии опухоли)идет естественный отбор сильнейших клонов - клональная селекция. В возникновении опухолевого процесса важное значение имеет возрастная и половая реактивность. С возрастом скорость репарации ДНК снижается и одновременно увеличивается частота мутаций и хромосомных аберраций, особенно при наличии сопутствующих заболеваний и состояний, таких, как хронический стресс, атеросклероз, гипертоническая болезнь, сахарный диабет. Опухоли чаще развиваются в возрасте старше 50 лет, что объясняется увеличением продолжительности действия (суммирование во времени) внешних онкогенных факторов и снижением противоопухолевой резистентности организма. Кроме того, полагают, что в процессе старения возникают гормональные нарушения, способствующие канцерогенезу, причем это связано, по всей видимости, не с недостатком самих гормонов, а со снижением чувствительности центрального (гипоталамо-гипофизарного) звена к действию соответствующего периферического гормона по механизму отрицательной обратной связи. Поэтому не только введение гормонов с лечебной целью, но и нарушение гормонального гомеостаза, вызванное изменениями в функционировании нейроэндокринной системы, способствует развитию рака. Так, повышение концентрации фолликулостимулирующего гормона в крови с возрастом приводит к увеличению частоты возникновения опухолей яичников. Относительное преобладание эстрогенов над прогестероном в период предменопаузы способствует развитию рака молочной железы и эндометрия.
14 Изменения дыхания и кровообращения при электрической травме –смотри в 1 вопрос
15 Хроническая лучевая болезнь, периоды развития и их характеристика
Хроническая лучевая болезнь возникает при длительном облучении организма в малых, но превышающих допустимые дозах. Выделяют два основных варианта болезни:
1) обусловленной внешним облучением (общим или местным);
2) обусловленной внутренним облучением (в результате поступления в организм радиоактивных нуклидов).
Заболевание отличается постепенным развитием и длительным волнообразным течением, сроки возникновения и характер изменений при этом определяются интенсивностью и суммарной дозой облучения. Начальный период заболевания характеризуется развитием нестойкой лейкопении, признаками астенизации, вегетативнососудистой неустойчивостью и др. Развернутому периоду заболевания свойственна недостаточность физиологической регенерации наиболее радиочувствительных тканей в сочетании с функциональными изменениями в деятельности нервной и сердечно-сосудистой систем. Период восстановления характеризуется сглаживанием деструктивных и отчетливым преобладанием репаративных процессов в наиболее радиочувствительных тканях. По тяжести хроническую лучевую болезнь, обусловленную внешним общим облучением, подразделяют на три группы: легкой (I), средней (II) и тяжелой (III) степени. Хроническая лучевая болезнь I степени (легкая) характеризуется нерезко выраженными нервно-регуляторными нарушениями в деятельности различных органов и систем, умеренной нестойкой лейкопенией и тромбоцитопенией.
При хронической лучевой болезни II степени (средней) тяжести присоединяются функциональные нарушения нервной, сердечнососудистой и пищеварительной систем. Прогрессируют лейкопения и лимфоцитопения, количество тромбоцитов уменьшено; в костном мозгу - явления гипоплазии кроветворения.
При хронической лучевой болезни III степени (тяжелой) развивается анемия, наблюдаются явления выраженной гипоплазии кроветворения, атрофические процессы в слизистой желудочнокишечного тракта, присоединяются инфекционно-септические осложнения, геморрагический синдром и нарушения кровообращения. Крайне тяжелые формы встречаются редко, при этом у больных развиваются поносы и кахексия. Клиническую картину хронической лучевой болезни, обусловленной внутренним облучением, формирует поражение одного или нескольких критических органов, в которых депонируются поступившие в организм радиоактивные нуклиды.
Отдаленные последствия действия радиации могут развиться как после общего, так и местного облучения организма спустя ряд лет и носят неопухолевый или опухолевый характер. К неопухолевым формам в первую очередь относят сокращение продолжительности жизни, гипопластические состояния в кроветворной ткани, слизистых оболочках органов пищеварения, дыхательных путей, в коже и других органах; склеротические процессы (цирроз печени, нефросклероз, атеросклероз, лучевые катаракты и др.), а также дисгормональные состояния (ожирение, гипофизарная кахексия, несахарное мочеизнурение). Одной из частых форм отдаленных последствий лучевых поражений является развитие опухолей в критических органах при облучении инкорпорированными излучателями (α- и β-излучение), а также радиационные лейкозы.
16 Механизм токсического действия кислорода при повышении барометрического давления- смотри в 7 вопрос
17 Объясните механизм местного и общего действия электрического тока на организм- смотри 1 вопрос
18 Опишите эректильную стадию травматического шока- смотри в 6 вопрос
19 Определение шока, виды
Шок - остро развивающийся синдром, характеризующийся резким уменьшением капиллярного (обменного, нутритивного) кровотока в различных органах, недостаточным снабжением кислородом, неадекватным удалением из ткани продуктов обмена и проявляющийся тяжелыми нарушениями функций организма.
По этиологии различают следующие виды шока: 1) геморрагический; 2) травматический; 3) дегидратационный; 4) ожоговый; 5) кардиогенный; 6) септический; 7) анафилактический.
20 Патогенез горной болезни
Патогенез горной болезни
I стадия (компенсации или приспособления).Высота 1000-4000 м.
гипоксемия
↓
раздражение хеморецепторов сосудов каротидного синуса и дуги аорты
↓
рефлекторная стимуляция дыхательного и сосудодвигательного центров
↓
одышка (увеличение частоты и глубины дыхания), тахикардия, повышение АД
Вследствие рефлекторного «выброса» из селезенки и из других органов-депо
Повышается количество эритроцитов в периферической крови
Прогрессирующий дефицит кислорода вместе с повышением рН крови вызывает нарушения со стороны ЦНС (головокружение, нарушение поведенческих реакций, потеря сознания, кома). На высоте 4000-5000 м наблюдаются признаки растормаживания и возбуждения корковых клеток (отмечается раздражительность, обнажаются скрытые черты характера, меняется почерк, теряется навык писания). В результате нарастающей гипоксии в почках включается выработка эритропоэтина, что приводит к активации процессов эритропоэза в костном мозге и увеличению числа ретикулоцитов и эритроцитов в периферической крови.
II стадия (декомпенсации, собственно болезнь).Высота 5000 м и более
гипервентиляция легких и снижение образования СО2 в тканях
(вследствие гипоксии тканей окисление углеводов и жиров не завершается образованием углекислоты и воды)
гипокапния и газовый алкалоз
снижается возбудимость дыхательного центра и других центров ЦНС
эйфория и возбуждение сменяются дыхание урежается, может торможение
угнетением и депрессией, появиться дыхание типа дифференцированных
развиваются усталость, Чейна-Стокса и Биота рефлексов, исчезновение и других рефлексов ,сонливость, малоподвижность положительных пищевыхАлкалоз может привести к возникновению судорог вследствие гипокальциемии. Опасным осложнением горной болезни являются системные отеки (особенно часто отек легких).Прогрессирующие гипокапния и алкалоз на высоте свыше 6000-8000 м могут вызвать смерть от паралича дыхательного центра.
21 Стадии шока ))))
22 Кишечная форма лучевой болезни, особенности
Кишечная форма острой лучевой болезни возникает при облучении лабораторных животных в дозах 10-20 Гр, вызывающих смерть на 3-5-е сутки после облучения. При вскрытии животных всегда констатируют гибель основной массы кишечного эпителия, оголение ворсин, их уплощение и деструкцию. У человека при облучении в дозах 10-20 Гр смерть чаще наступает на 7-10-е сутки. Основными признаками болезни являются тошнота, рвота, кровавый понос, повышение температуры тела, могут наблюдаться полная паралитическая непроходимость кишечника и вздутие живота. Развиваются геморрагия и глубокая лейкопения с полным отсутствием лимфоцитов в периферической крови, а также картина сепсиса.
Причиной смерти при кишечной форме острой лучевой болезни являются дегидратация организма, сопровождающаяся потерей электролитов и белка, развитие необратимого шока, связанного с действием токсических веществ микробного и тканевого происхождения.
23 Холодовой наркоз –смотри в 1 разделе
24 Стадия компенсации при горной болезни
Первая стадия (компенсация) развивается на высоте от 1000 до 4000 м над уровнем моря. В результате раздражения гипоксемической кровью хеморецепторов каротидного синуса и дуги аорты, происходит рефлекторная стимуляция дыхательного и сердечно-сосудистого (сосудодвигательного) центров. Возникает одышка, тахикардия, повышение АД, увеличивается количество эритроцитов в периферической крови (вследствие рефлекторного выброса их из депо — синусов печени, селезёнки, костного мозга). На высоте от 4000 до 5000 м возникают признаки ослабления процессов внутреннего торможения, и усиливаются процессы возбуждения клеток коры больших полушарий. Человек становится раздражительным, проявляются скрытые черты характера, меняется почерк, теряются навыки письма. В результате развития гипоксии в организме (особенно в почках) сначала происходит выброс крови из депо, а затем увеличивается образование эритропоэтина, что приводит к активизации эритропоэза в костном мозге и увеличению числа эритроцитов в периферической крови.
25 Симптомы повышенного барометрического давления смотри в 7 вопрос
26 Острая лучевая болезнь
Типичную форму острой лучевой болезни по тяжести поражения, определяемой поглощенной дозой излучения, подразделяют на четыре группы: I - легкой степени (1-2 Гр); II - средней степени (2-4 Гр); III - тяжелой степени (4-6 Гр); IV - крайне тяжелой степени (свыше 6 Гр). В ее течении выделяют четыре фазы: 1) первичной острой реакции; 2) мнимого клинического благополучия (скрытая фаза); 3) разгара болезни; 4) восстановления.
Фаза первичной острой реакции организма человека развивается в зависимости от дозы в первые минуты или часы после облучения. Возникают некоторое возбуждение, головная боль, общая слабость. Затем наступают диспепсические расстройства (тошнота, рвота, потеря аппетита), со стороны крови - кратковременный нейтрофильный лейкоцитоз со сдвигом влево, абсолютная лимфоцитопения. Клинические проявления болезни являются следствием как прямого повреждающего действия ионизирующей радиации, так и косвенного (через нарушения нейрогуморальной регуляции). Наблюдаются повышенная возбудимость нервной системы, лабильность вегетативных функций - колебания артериального давления, ритма сердца и т.д. Активация гипофиз-адреналовой системы приводит к усиленной секреции гормонов коры надпочечников, что в данной ситуации может иметь приспособительное значение. При дозах 8- 10 Гр наблюдается развитие шокоподобного состояния с падением артериального давления, кратковременной потерей сознания, повышением температуры тела, развитием поноса. Продолжительность фазы первичной острой реакции 1-3 дня. Фаза мнимого клинического благополучия характеризуется включением защитнокомпенсаторных реакций. В связи с этим самочувствие больных становится удовлетворительным, проходят клинически видимые признаки болезни. Длительность скрытой фазы зависит от дозы облучения и колеблется от 10-15 дней до 4-5 недель. При сравнительно небольших дозах (до 1 Гр) начальные легкие функциональные реакции не переходят в развернутую клиническую картину и заболевание ограничивается затухающими явлениями начальных реакций. При очень тяжелых формах поражения скрытая фаза вообще отсутствует. Однако в это время нарастает поражение системы крови: в периферической крови прогрессирует лимфоцитопения на фоне лейкопении, снижается содержание ретикулоцитов и тромбоцитов. В костном мозгу развивается опустошение (аплазия). Могут наблюдаться атрофия гонад, подавление ранних стадий сперматогенеза, атрофические изменения в тонком кишечнике и коже. Неврологическая симптоматика постепенно сглаживается. Фаза разгара болезни характеризуется тем, что самочувствие больных вновь резко ухудшается, нарастает слабость, повышается температура тела, появляются кровоточивость и кровоизлияния в кожу, слизистые оболочки, желудочно-кишечный тракт, мозг, сердце и легкие. В результате нарушения обмена веществ и диспепсических расстройств (потеря аппетита и поносы) резко снижается масса тела. На первый план выходит поражение системы крови. Развиваются глубокая лейкопения, тромбоцитопения, выраженная анемия; увеличивается СОЭ; в костном мозгу - картина опустошения с начальными признаками регенерации. Наблюдаются гипопротеинемия, гипоальбуминемия, повышение содержания остаточного азота и снижение уровня хлоридов. Угнетается иммунитет, в результате чего развиваются инфекционные осложнения, аутоинфекция и аутоинтоксикация. Продолжительность фазы выраженных клинических проявлений от нескольких дней до 2- 3 недель. При облучении в дозе свыше 2,5 Гр без проведения лечебных мероприятий возможен смертельный исход. Фаза восстановления характеризуется постепенной нормализацией нарушенных функций, общее состояние больных заметно улучшается. Снижается до нормы температура тела, исчезают геморрагические и диспепсические проявления, со 2-5-го месяца нормализуется функция потовых и сальных желез, возобновляется рост волос. Постепенно происходит восстановление показателей крови и обмена веществ. Период восстановления охватывает 3-6 месяцев, в тяжелых случаях лучевого поражения может затягиваться на 1-3 года, при этом возможен переход болезни в хроническую форму.
27 Костно-мозговая форма лучевой болезни, особенности крови

28 Гипербарическая гипоксия
Гипербарическая оксигенация - вдыхание кислорода под повышенным давлением. Использование гипербарической оксигенации в медицинской практике (для повышения кислородной емкости крови) основано на увеличении растворимой фракции кислорода в крови. Избыток кислорода в тканях (гипероксия) при вдыхании его под давлением 303,9 кПа (3 атм) оказывает благоприятный эффект, активируя процессы тканевого дыхания и дезинтоксикации. Повышение давления вдыхаемого кислорода до 810,4-1013 кПа (8-10 атм) вызывает явления тяжелой интоксикации вследствие активации свободнорадикального окисления, образования свободных радикалов и перекисных соединений
29 Механизм развития нормобарической гипоксии
Нормобарическая формаэкзогенной гипоксии может развиться при пребывании в шахтах, глубоких колодцах, подводных лодках, водолазных костюмах, у оперируемых пациентов при неисправности наркозно-дыхательной аппаратуры, при смоге и загазованности воздуха в мегаполисах, когда имеется недостаточное количество О2 во вдыхаемом воздухе при нормальном общем атмосферном давлении.Для гипобарической и нормобарической форм экзогенной гипоксии характерно падение парциального давления кислорода в альвеолах, в связи с чем замедляется процесс оксигенации гемоглобина в легких, снижаются процент оксигемоглобина и напряжение кислорода в крови, т.е. возникает состояние гипоксемии.Вместе с тем повышается содержание в крови восстановленного гемоглобина, что сопровождается развитием цианоза.Уменьшается разница между уровнями напряжения кислорода в крови и тканях, и скорость поступления его в ткани замедляется. Наиболее низкое напряжение кислорода, при котором еще может осуществляться тканевое дыхание, называется критическим.Для артериальной крови критическое напряжение кислорода соответствует 27-33 мм рт.ст., для венозной - 19 мм рт.ст. Наряду с гипоксемией развивается гипокапнияиз-за компенсаторной гипервентиляции альвеол. Это ведет к сдвигу кривой диссоциации оксигемоглобина влево вследствие повышения прочности связи между гемоглобином и кислородом, что еще в большей степени затрудняет поступление кислорода в ткани. Развивается респираторный (газовый) алкалоз,который в дальнейшем может сменитьсядекомпенсированным метаболическим ацидозомиз-за накопления в тканях недоокисленных продуктов. Другим неблагоприятным следствием гипокапнии является ухудшение кровоснабжения сердца и мозгавследствие сужения артериол сердца и мозга (из-за этого возможны обмороки).
Существует особый случай нормобарической формы экзогенной гипоксии (нахождение в замкнутом пространстве с нарушенной вентиляцией), когда пониженное содержание кислорода в воздухе может сочетаться с повышением в воздухе парциального давления СО2. В таких случаях возможно одновременное развитие гипоксемии и гиперкапнии. Умеренная гиперкапния оказывает благоприятное влияние на кровоснабжение сердца и мозга, повышает возбудимость дыхательного центра, но значительное накопление СО2 в крови сопровождается газовым ацидозом, сдвигом кривой диссоциации оксигемоглобина вправо вследствие снижения сродства гемоглобина к кислороду, что дополнительно затрудняет процесс оксигенации крови в легких и усугубляет гипоксемию и гипоксию тканей.
Иммунопатологические состояния
1 Врожденные иммунодефициты
Первичные иммунодефициты достаточно редки. Они обусловлены дефектами в отдельном гене или целых кластерах генов, ответственных за синтез белковых молекул иммунной системы
Виды: КРАТКО !
1. Дефициты системы фагоцитов в основном касаются нарушений фагоцитарной функции нейтрофильных гранулоцитов.
2. Дефициты системы комплемента описаны практически для всех компонентов комплемента человека (C1q, C1r, C1s, C2-C9, пропердина) и подразделяются на дефициты ранних компонентов классического пути активации комплемента и дефициты поздних компонентов комплемента.
3. Дефициты антител. Диагноз дефицита гуморального звена иммунитета ставится на основании определения уменьшения в сыворотке содержания IgG, IgA, IgM, сопоставления лабораторных и клинических данных, включая анализ частых, особенно инфекционных заболеваний.
4. Т-дефициты проявляются количественной и функциональной недостаточностью Тлимфоцитов.
5. Комплексные иммунодефициты. К данной группе иммунодефицитов относятся синдром тяжелой комбинированной иммунной недостаточности и синдром ВискоттаОлдрича.
2 Клеточный тип аллергической реакции
Эта форма реактивности сформировалась на поздних этапах эволюции на основе иммунологических реакций и воспаления. Она направлена на распознавание и ограничение действия аллергена. IV тип иммунного повреждения лежит в основе многих аллергических и инфекционных заболеваний, аутоиммунных болезней, отторжения трансплантата, контактного дерматита (контактная аллергия), противоопухолевого иммунитета.
Патогенез реакций гиперчувствительности IV типа имеет следующие особенности:
Стадия иммунных реакций. Поступающий в организм антиген чаще всего контактирует с макрофагом, обрабатывается им, а затем в переработанном виде передается T-хелпера, имеющим на своей поверхности рецепторы для антигена. Они распознают антиген, а затем с помощью интерлейкинов запускают пролиферацию эффекторных Т-клеток воспаления с фенотипами CD4+ и CD8+, а также клеток памяти, позволяющих сформировать быстрый иммунный ответ при повторном попадании антигена в организм. После одновременного связывания Т-клетки с антигеном и молекулами главного комплекса гистосовместимости (HLA) и последующего «двойного распознавания» антигена и продуктов HLA начинается пролиферация лимфоцитов и их трансформация в бласты.
Стадия биохимических реакций. Антигенная стимуляция и бласттрансформация лимфоцитов сопровождаются образованием и выделением медиаторов - цитокинов (лимфокинов и монокинов), большинство из которых являются гликопротеинами. Медиаторы действуют на клетки-мишени (макрофаги и нейтрофилы, лимфоциты, фибробласты, стволовые клетки костного мозга, опухолевые клетки, остеокласты и др.), несущие на своей поверхности медиаторные рецепторы. Биологический эффект медиаторов разнообразен (табл. 8-4). Они изменяют клеточную подвижность, активируют клетки, участвующие в воспалении, способствуют пролиферации и созреванию клеток, регулируют кооперацию иммунокомпетентных клеток.
В зависимости от оказываемого эффекта медиаторы делятся на две большие группы: 1) факторы, подавляющие функциональную активность клеток (макрофагальный хемоаттрактантный белок, TNF-β); 2) факторы, усиливающие функциональную активность клеток (фактор переноса; макрофагальный воспалительный белок; митогенный и хемотаксические факторы).
Стадия клинических проявлений зависит от природы этиологического фактора и той ткани, где «разыгрывается» патологический процесс. Это могут быть процессы, протекающие в коже, суставах, внутренних органах. В воспалительном инфильтрате преобладают мононуклеарные клетки (лимфоциты, моноциты/ макрофаги). Нарушение микроциркуляции в очаге повреждения объясняется повышением проницаемости сосудов под влиянием медиаторов (кинины, гидролитические ферменты), а также активацией свертывающей системы крови и усилением образования фибрина. Отсутствие значительного отека, так характерного для иммунных поражений при аллергических реакциях немедленного типа, связано с весьма ограниченной ролью гистамина в ГЗТ.
При гиперчувствительности IV типа иммунное повреждение развивается в результате: 1) прямого цитотоксического действия CD4+ и CD8+ Т-лимфоцитов на клетки-мишени (TNF-β и комплемент не принимают участия в этом процессе); 2) цитотоксического действия TNF-β (так как действие последнего неспецифично, повреждаться могут не только те клетки, которые вызвали его образование, но и интактные клетки в зоне его образования); 3) выделения в процессе фагоцитоза лизосомальных ферментов, повреждающих тканевые структуры (эти ферменты выделяют в первую очередь макрофаги).
3 Стадии аллергических реакции при ГЗТ- смотри в 2 вопрос
4 Атопические болезни, особенности гуморальных антител
К группе классических атопических болезней относят круглогодичный атопический ринит, поллиноз, атопическую форму бронхиальной астмы и атопический дерматит. Тесно связаны с этой группой заболеваний определенные острые аллергические реакции на лекарства и пищу.
Важнейшим признаком атопии является наследственная предрасположенность. Если атопией страдает один родитель, патология передается детям в 50%, если оба - в 75%.
Атопия сопровождается определенными иммунными нарушениями.
1. Повышенная способность иммунной системы отвечать образованием IgE на слабые антигенные стимулы, на которые люди, не страдающие атопией, либо совсем не отвечают, либо образуют АТ других классов иммунных глобулинов. В крови при атопии резко увеличена концентрация общего и специфического IgE.
2. Отмечаются нарушения функции лимфоцитов в виде снижения количества CD3+, CD8+, пролиферативного ответа на Аг и ФГА, супрессорной активности НК, кожных реакций на контактные аллергены, на внутрикожное введение туберкулина, кандидина, продукции ИЛ-2. Одновременно происходит увеличение содержания CD4+ клеток, гиперреактивности В-лимфоцитов на Аг и
В-митогены, связывание гистамина В-лимфоцитами в периоде обострения болезни.
3. Ингибируется хемотаксис моноцитов и нейтрофилов, что снижает эффективность фагоцитоза, тормозит моноцит-лимфоцитарную кооперацию и антителозависимую моноцит-опосредованную цитотоксичность.
Кроме перечисленных иммунных нарушений, атопия характеризуется включением ряда неспецифических патогенетических механизмов:
1. Нарушение равновесия симпатической и парасимпатической иннервации систем организма
При всех трех классических атопических заболеваниях увеличена холинергическая α-адренореактивность со снижением β-2-адренер- гической реактивности.
2. Отмечается повышенная способность тучных клеток и базофилов освобождать медиаторы как спонтанно, так и в ответ на неиммунные стимулы.
3. Атопические заболевания сопровождаются различной степенью эозинофилии и инфильтрацией слизистых и секретов дыхательных путей и желудочно-кишечного тракта.
5 Варианты формирования аутоантигенности
Аутоиммунные реакции могут быть результатом формирования новых Аг-детерминант в составе носителя Аг или повреждения существующих аутоантигенных детерминант.
· Толерантность к аутоантигенам может быть нарушена при самом незначительном их повреждении (например, изменении нормальной структуры Аг клеточных мембран при вирусных инфекциях).
· Отмена толерантности к собственным Аг может развиться при взаимодействии с Аг, эпитопы которого близки по структуре к нормальным эпитопам аутоантигена (напр., перекрестная реактивность между белками клеточной стенки стрептококка и тканевыми Аг сердца приводит к развитию ревматоидного эндокардита и патологии клапанов)
· Если чужеродные Аг-детерминанты связываются с клетками организма, толерантность нарушается. Иммунный ответ на такие Аг приводит к разрушению собственных клеток (напр., индуцированные ЛС гемолитической анемии).
· Острая травма тканей может привести к освобождению Аг, обычно изолированных от иммунной системы гистогематическим барьером. В таких обстоятельствах аутоантигены распознаются как чужеродные. Один из примеров – симпатическая офтальмия – первичное повреждение глаза, вызывающие несостоятельность офтальмогематического барьера. Контакт клеток иммунной системы с тканевыми Аг глаза с последующим развитием иммунного ответа может вызывать полную потерю глаза, даже если провоцирующие повреждения уже разрешились
· Аутоиммунная реакция может быть результатом поликлональной активации В-клеток митогенами (напр., бактериальными ЛПС) или секреции лимфокинов Т-клетками, стимулированные митогеном
· Аутоиммунная реакция может возникнуть вседствии расстройств регуляции иммунной системы. Формы нарушения регуляции – дифицит или функциональная недостаточность супрессорных клеток, атипичная экспрессия молекул МНС II на клетках, не экспрессирующих эти Аг в нормальных условиях (напр., тиреоциты при аутоиммунном тиреоидите)
6 Патогенез аутоиммунных заболеваний
Патогенез аутоиммунных расстройств можно разделить на два этапа: индуктивный и эффекторный.
Индуктивный этап тесно связан со срывом иммунологической аутотолерантности. Толерантность к собственным антигенам организма является естественным состоянием, при котором деструктивная активность иммунной системы направлена только на внешние антигены. Процессы старения организма с иммунологической точки зрения обусловлены медленной отменой такой толерантности. Имеется несколько механизмов, контролирующих поддержание долгосрочной аутотолерантности: клональная делеция, клональная анергия и иммуносупрессия, опосредованная Т-клетками.
Клональная делеция является формой центральной толерантности, которая формируется в ходе негативной селекции путем апоптоза Т-лимфоцитов (в тимусе) и В-лимфоцитов (в костном мозгу), имеющих высокоспецифические антигенраспознающие рецепторы к аутоантигенам.
Клональная анергия - также форма центральной толерантности, которая характерна, главным образом, для В-клеток, имеющих BCR к растворенным аутоантигенам в низких концентрациях. При клональной анергии клетки не погибают, а становятся функционально неактивными.
Однако некоторые Т- и В-лимфоциты нередко избегают негативной селекции и при наличии дополнительных условий могут активироваться. Этому могут способствовать проникновение патогенов с перекрестными антигенами или поликлональными активаторами, сдвиг цитокинового профиля в сторону Тхелпера, затяжной воспалительный процесс с поступлением в кровь и ткани множества медиаторов, которые могут модифицировать аутоантигены в очаге и др. Для сохранения толерантности периферические аутореактивные Т-лимфоциты должны быть подвержены апоптозу или стать анергичными под супрессивным влиянием цитокинов профиля Тh2. Если не происходит включение механизмов периферической толерантности, т.е. иммуносупрессии, опосредуемой Т-клетками, начинается развитие аутоиммунных расстройств. В значительной степени аутоиммунная патология (как и опухолевая прогрессия) - это дефицитность апоптоза. Описана летальная наследственная болезнь с дефектом гена, кодирующего Fas - одного из специализированных рецепторов для индукции апоптоза, которая проявляется лимфопролиферативным синдромом с системными симптомами, типичными для аутоиммунных заболеваний. Существенная роль в патогенезе многих форм аутоиммунной патологии отводится медленным вирусным и прионовым инфекциям, которые, вероятно, могут модифицировать процессы апоптоза и экспрессии важнейших регуляторных молекул. В последнее время исследуется роль Тхелпера в развитии аутоиммунных болезней.
Одним из центральных аспектов патогенеза аутоиммунных болезней является наличие каких-либо молекулярных аномалий. Например, при ревматоидном артрите и ряде других патологий обнаружен дефект гликозилирования Fc-фрагмента собственных антител класса IgG, когда отмечается дефицит сиаловой кислоты и галактозы. Аномальные молекулы IgG образуют между собой конгломераты с сильными иммуногенными свойствами, которые индуцируют аутоиммунный ответ. Наличие молекулярных аномалий генов, ответственных за синтез цитокинов профиля Тh2, приводит к тому, что начавшийся аутоиммунный ответ не заканчивается восстановлением аутотолерантности.
Аутоиммунные болезни нередко развиваются в так называемых иммунологически привилегированных органах (мозг, хрусталик глаза, коллоид щитовидной железы, семенники); к таким патологиям относятся рассеянный склероз, симпатическая офтальмия, аутоиммунный тиреоидит Хасимото, иммунологическое бесплодие. Когда аутоантигены из этих органов оказываются в несвойственных местах (например, при травме тканевых барьеров) и имеются какие-либо дополнительные условия усиления их иммуногенности (дефицит Тп2-цитокинов, присутствие адъювантов и т.д.), включается аутоиммунный процесс.
Эффекторный этап любого аутоиммунного процесса протекает по одному или чаще нескольким (II, III, IV или V) типам гиперчувствительности по P.G.H. Gell и P.R.A. Coombs: II тип: аутоиммунная гемолитическая анемия, пернициозная анемия, вульгарная пузырчатка, хроническая идиопатическая крапивница, тяжелая миастения, аутоиммунный тиреоидит и др.; III тип: системная красная волчанка, системные васкулиты и др.; IV тип: ревматоидный артрит, рассеянный склероз и др.; V тип: иммуноопосредованный сахарный диабет I типа, болезнь Грейвса и др.
7 1 тип аллергических реакций (объемный вопрос )
Аллергические реакции, формирующиеся по I типу иммунного повреждения, называют атопическими (реагиновыми, анафилактическими). Их развитие характеризуется следующими особенностями:
Стадия иммунных реакций. В норме человеческий организм толерантен к аллергенам окружающей среды. У лиц с наличием определенных молекулярных аномалий иммунной системы (в частности, при наличии очень высокой экспрессии специфических рецепторов (FceRI) на тучных клетках и базофилах крови, что определяется геном на 11-й хромосоме) при избыточном поступлении ряда веществ в организм развивается активный иммунный ответ - (сенсибилизация) к аллергенам. Этот вариант ответа является Тh2- зависимым, регулируется интерлейкином (IL) 4, IL-13, другими цитокинами и заканчивается образованием плазматических клеток, синтезирующих IgE и IgG4 (рис. 8-1). В ходе сенсибилизации происходит взаимодействие следующих клеток: дендритных (обеспечивают эндоцитоз аллергена, его процессинг и презентацию в комплексе с HLA II), Т-лимфоцитов-хелперов 2-го типа (вырабатывают цитокины соответствующего профиля, которые нужны для регуляции) и В-лимфоцитов (они сами могут выступать в качестве антигенпредставляющих, но главное - они дифференцируются в плазматические клеткиантителопродуценты и В-клетки памяти) (рис. 8-2). В-клетки памяти при повторном поступлении в организм причинно-значимого аллергена обеспечивают экспрессный (в течение 10-20 мин) ответ на него, что соответствует следующим стадиям патологического процесса. Течение сенсибилизации регулируется не только цитокинами профиля Тh2, но и соответствующими костимулирующими молекулами (CTLA-4, CD3OL, CD4OL, OX40 и др.). Второй тип рецепторов IgE - низкоспецифический FceRII (CD23) - экспрессируется на В-лимфоцитах, эозинофилах, макрофагах и тромбоцитах, обеспечивает проявления IgE-опосредованной цитотоксичности по отношению к паразитам, регуляцию синтеза IgE и ряд других функций.IgE значительно отличаются по своим свойствам от других антител. Прежде всего, они обладают цитотропностью (цитофильностью), что определяет трудность их обнаружения, так как они не участвуют в серологических реакциях. Считается, что присущее IgE свойство прикрепляться к клеткам и фиксироваться в тканях связано с приобретенными в филогенезе дополнительными 110 аминокислотами на Fс-фрагменте молекулы. Концентрация IgE в сыворотке крови потому и низка, что синтезируемые в региональных лимфоузлах молекулы IgE в меньшей степени попадают в кровоток, так как в основном фиксируются в окружающих тканях. Разрушение или инактивация этого участка Fсфрагмента нагреванием (до 56 °С) приводит к потере цитотропных свойств этих антител, т.е. они термолабильны. Фиксация антител клетками происходит при помощи рецептора, встроенного в мембрану клеток. Самой высокой способностью связывать IgE-антитела обладают рецепторы для IgE, найденные на тучных клетках и базофилах крови, поэтому эти клетки получили название клетки-мишени I порядка. На одном базофиле может фиксироваться от 3000 до 300 000 молекул IgE. Рецептор для IgE обнаружен также на макрофагах, моноцитах, эозинофилах, тромбоцитах и лимфоцитах, однако их связывающая способность ниже. Эти клетки получили название клетки-мишени II порядка. Связывание IgE на клетках - зависимый от времени процесс. Оптимальная сенсибилизация может наступить через 24-48 ч. Итак, первичное попадание аллергена в организм через кооперацию дендритных клеток, Т- и В-лимфоцитов запускает сложные механизмы синтеза IgE, фиксирующихся на клетках-мишенях. Повторный контакт организма с этим аллергеном приводит к образованию комплекса АГ+АТ, связанного с поверхностью клеткимишени посредством молекул IgE. При этом условием, достаточным для активации и дегрануляции клетокмишеней, является связывание аллергена по крайней мере с двумя соседними молекулами IgE. Начинается II стадия аллергической реакции. II.
Стадия биохимических реакций. В этой стадии основную роль играют тучные клетки и базофилы крови, т.е. клетки-мишени I порядка. Тучные клетки (тканевые базофилы) - это клетки соединительной ткани. Они обнаруживаются преимущественно в коже, дыхательных путях, по ходу кровеносных сосудов и нервных волокон. Тучные клетки имеют большие размеры (10-30 мкм) и содержат гранулы диаметром 0,2-0,5 мкм, окруженные перигранулярной мембраной. Гранулы тучных клеток и базофилов крови содержат медиаторы: гистамин, гепарин, фактор хемотаксиса эозинофилов (ФХЭ), фактор хемотаксиса нейтрофилов (ФХН).Образование комплекса АГА+Т, фиксированного на поверхности тучной клетки (или базофила крови), приводит к стягиванию белков-рецепторов для IgE, клетка активируется и секретирует медиаторы. Максимальная активация клетки достигается связыванием нескольких сотен и даже тысяч рецепторов. В результате присоединения аллергена рецепторы приобретают энзиматическую активность и запускается каскад биохимических реакций. Активируются мембраносвязанные ферменты - фосфолипаза С и аденилатциклаза, катализирующие реакции с образованием соответственно инозитол-1,4,5-трифосфата, 1,2- диацижлицерина и цАМФ. Инозитол-1,4,5-трифосфат и цАМФ обеспечивают фосфорилирование и активацию Са2 +-связывающего белка кальмодулина, мобилизующего Са2 + из эндоплазматического ретикулума клеток в цитоплазму, в присутствии которого при участии цАМФ и 1,2-диацилглицерина активируется протеинкиназа С. Протеинкиназа С осуществляет фосфорилирование и активацию ряда других внутриклеточных ферментов, в частности Са2 +-зависимой фосфолипазы А2. При этом за счет Са2 +- индуцированного сокращения микротрубочек гранулы «подтягиваются» к плазматической мембране, а 1,2- диацилглицерин, продукты его расщепления (моноацилглицерин, лизофосфатидиловая кислота) и активации фосфолипазы А2 (лизофосфатидилхолин) обусловливают слияние депонирующих гранул тучной клетки (или базофила крови) со стенкой мембраносвязанных канальцев и цитоплазматической мембраной, через которые медиаторы гранул (первичные) и медиаторы, образующиеся при активации клеток (вторичные; см. табл. 8-2), высвобождаются наружу. Источником вновь образующихся медиаторов в клетках-мишенях являются продукты распада липидов: фактор активации тромбоцитов (ФАТ), простагландины, тромбоксаны и лейкотриены. Следует отметить, что при псевдоаллергических реакциях (дегрануляция тучных клеток и базофилов может происходить и под влиянием неиммунологических активаторов, т.е. быть IgE-независимой. В результате выделения из тучных клеток и базофилов факторов хемотаксиса нейтрофилов и эозинофилов последние скапливаются вокруг клеток-мишеней I порядка. Нейтрофилы и эозинофилы активируются и тоже высвобождают биологически активные вещества и ферменты. Часть из них являются также медиаторами повреждения (например, ФАТ, лейкотриены и др.), а часть (гистаминаза, арилсульфатаза, фосфолипаза D и др.) - ферментами, разрушающими определенные медиаторы повреждения. Так, арилсульфатаза эозинофилов вызывает разрушение лейкотриенов, гистаминаза - разрушение гистамина. Образующиеся простагландины группы E снижают высвобождение медиаторов из тучных клеток и базофилов.
Стадия клинических проявлений. В результате действия медиаторов повышается проницаемость сосудов микроциркуляторного русла, что сопровождается развитием отека и серозного воспаления. При локализации процесса на слизистых оболочках возникает гиперсекреция. В органах дыхания развивается бронхоспазм, который, наряду с отеком стенки бронхиол и гиперсекрецией мокроты, обусловливает резкое затруднение дыхания. Все эти эффекты клинически проявляются в виде приступов бронхиальной астмы, ринита, конъюнктивита, крапивницы (гиперемия и волдыри), кожного зуда, местного отека, диареи и др. В связи с тем что одним из медиаторов является ФХЭ, очень часто I тип аллергии сопровождается увеличением количества эозинофилов в крови, мокроте, серозном экссудате.
8 РТПХ, основные условия для его развития
Реакция «трансплантат против хозяина» развивается при трансплантации реципиенту («хозяину») тканей донора, содержащих иммуноциты (например, костного мозга, селезёнки, лейкоцитарной массы).
Для возникновения РТПХ необходимо соблюдение ряда условий:
1. Трансплантат должен обладать иммунологической активностью, так как РТПХ - это иммунная агрессия. Поскольку клетки иммунной системы весьма обильно разбросаны по организму, а некоторые органы представляют собой их массивное скопление, оказалось невозможным индуцировать состояние толерантности в отношении следующих тканей (а следовательно, и их трансплантировать): костный мозг, лимфоидная ткань, селезенка, печень, тимус. Столь строгие ограничения в пересадке органов и тканей резко сужают возможности трансплантологии.
2. Реципиент должен быть чужеродным в антигенном отношении для иммунологически активного трансплантата, поскольку в любом иммунном процессе необходима антигенная несовместимость. К сожалению, это условие, естественно, соблюдается практически при любой аллогенной трансплантации, поскольку лишь в случае пересадки органов и тканей между монозиготными близнецами оно будет нарушено, а это встречается крайне редко.
3. Реципиент должен обладать определенной иммунологической инертностью, то есть его иммунная защита в силу тех или иных причин должна быть подавлена, он должен быть неспособен отторгать трансплантированные клетки агрессора, иначе эти клетки будут разрушены раньше, чем успеют агрессию осуществить. Другими словами, развитие реакции трансплантат против хозяина должно опередить развитие реакции хозяин против трансплантата.
Дата добавления: 2018-08-06; просмотров: 2018; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
