Модели атома. Водородоподобные атомы. Энергия, квантовые числа, спектр атома.
Первые модели строения атома, а-модель «сливового пудинга» (Томсон, 1904 г.), согласно которой атом представляет собой положительно заряженную сферу с внедренными в нее электронами; б-ядерная модель атома (Резерфорд, 1911 г.), согласно которой положительно заряженное ядро окружено облаком электронов; в планетарная модель атома (Бор, 1913 г.), согласно которой электроны движутся вокруг ядра по круговым орбитам.

А́том (от др.-греч.«неделимый, неразрезаемый») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атомы состоят из ядра и электронов (точнее электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента.
Водородоподобный атом — атом (ион), содержащий в электронной оболочке один и только один электрон.
Таким атомом, кроме атома водорода и его тяжёлых изотопов (дейтерия и трития), может быть любой ион, если число потерянных им электронов равно заряду атома минус один, например, дважды ионизированный атом лития. Поскольку у такого иона остаётся только один электрон, его и называют водородоподобным атомом. Электронные спектры таких атомов описываются теорией водородоподобных атомов Бора.
Квантовое число. 1) Электроны могу находиться в атоме водорода, только имея определенные значения энернии:
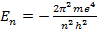 (2.30)
(2.30)
(n=1, 2, 3, …). Состояния с другими значениями, как и в рассмотренных выше примерах, следует трактовать как н е у с т о й ч и в ы е (нестационарные), поэтому при E ≠  электрон должен излучать (или поглощать) энергию, с тем чтобы перейти в одно из состояний, “дозволенны” для него при данных условиях. Формула (2.30) совпадает с выражение для энергии атома водорода, полученным в &9 на основе постулатов Бора;
электрон должен излучать (или поглощать) энергию, с тем чтобы перейти в одно из состояний, “дозволенны” для него при данных условиях. Формула (2.30) совпадает с выражение для энергии атома водорода, полученным в &9 на основе постулатов Бора;
2) состояние электрона в атоме водорода характеризуется набором значений трех “квантовых чисел”: главного квантового числа n, определяющего энергию электрона в атоме согласо формуле (2.30);
Орбитального квантового числа l, определяющего момент кол-ва движения по орбите L:
 (3.31)
(3.31)
Число l принимает значения 0, 1, 2, …, n – 1, т.е. для данного значения главного квантового числа n существует n значений орбитального числа l.
Энергия. Подсчитывая энергию испускаемых радиемα-частиц, авторы сделали вывод, что «энергия радиоактивных превращений по крайней мере в 20 000 раз, а может, и в миллион раз превышает энергию любого молекулярного превращения… Энергия, скрытая в атоме, во много раз больше энергии, освобождающейся при обычном химическом превращении». Выделяющаяся самопроизвольно энергия излучения радия была измерена калориметром в 1903 г.
Спектр.АТОМНЫЕ СПЕКТРЫ - спектры поглощения и испускания свободных или слабо взаимодействующих атомов, возникающие при излучательных квантовых переходах между их уровнями энергии. А. с. наблюдаются для разреженных газов или паров и для плазмы. А. с. линейчатые, т. е. состоят из отд. спектральных линий, каждая из которых соответствует переходу между двумя электронными уровнями энергии атома 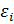 и
и  характеризуется значением частоты
характеризуется значением частоты  поглощаемого и испускаемого эл--магн. излучения; согласно условию частот Бора.
поглощаемого и испускаемого эл--магн. излучения; согласно условию частот Бора.  Наряду с частотой, спектральная линия характеризуется волновым числом
Наряду с частотой, спектральная линия характеризуется волновым числом  (с - скорость света) и длиной волны
(с - скорость света) и длиной волны  .Частоты спектральных линий выражают в
.Частоты спектральных линий выражают в  , волновые числа - в
, волновые числа - в  , длины волн - в нм и мкм, а также в ангстремах (
, длины волн - в нм и мкм, а также в ангстремах (  ). В спектроскопии волновые числа также обозначают буквой
). В спектроскопии волновые числа также обозначают буквой  .
.
Дата добавления: 2018-06-27; просмотров: 379; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
