Электролиз раствора гидроксида натрия с графитовыми электродами
Процессы, происходящие при электролизе раствора гидроксида натрия, представим в виде схемы:
NaOH ⇄ Na+ + OH-
H2O ⇄ H+ + OH–
K(–): Na+; H+ (H2O) A(+): OH– (H2O)
2Н2О + 2ē → Н2 + 2ОН– 2ОН–-2ē →½О2 + Н2О
Суммарное уравнение электролиза:
2Н2О + 2ē → Н2 + 2ОН–
2ОН– -2ē →½О2 + Н2О
Н2О = Н2 + ½О2
Процесс электролиза количественно описывается законами Фарадея.
1 закон Фарадея: массы (для твердых и жидких) или объемы (для газообразных) веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит:
 , ,
| (4.1) | |
 , ,
| (4.2) |
где m – масса вещества, образующегося на электроде, г;
Q – количество электричества, Кл;
F – постоянная Фарадея, 96500Кл = 26,8А∙час;
I – сила тока, А;
τ – продолжительность электролиза, с;
Mэ – молярная масса эквивалента, г/моль;
V – объем газа, образующегося на электроде, л;
Vm – молярный объем, л/моль (молярный объем при нормальных условиях равен 22,4 л).
2 закон Фарадея (закон эквивалентов для электрохимических реакций): массы прореагировавших на электродах веществ, при постоянном количестве электричества, относятся друг к другу как их молярные массы эквивалентов:

| (4.3) |
где m(A) – масса вещества А, г;
|
|
|
m(B) – масса вещества B, г;
Mэ(А) – молярная масса эквивалента вещества А, г/моль;
Mэ(B) – молярная масса эквивалента вещества B, г/моль.
Количество электричества, которое затрачивается на выделение нужных продуктов, характеризуется величиной, называемой выходом по току (η):

| (4.4) |
Выход по току – это отношение массы практически выделившегося вещества (mПР) к массе рассчитанной по закону Фарадея (mТЕОР).
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т.д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д.
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами – процесс электрорафинирования или с нерастворимыми анодами – процесс электроэкстракции.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают натрий, алюминий, магний, титан, цирконий, уран, бериллий и др. (см. рисунок 4.2, 4.3).
|
|
|

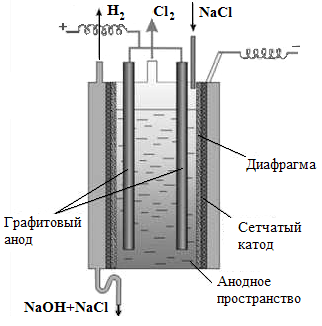
| Рисунок 4.2. Схема установки для получения металлического натрия | Рисунок 4.3. Схема установки для электролиза хлорида натрия |
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегию и гальванопластику.
Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера. Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля.
Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами.
С помощью гальванопластики изготовляют бюсты, статуи и т. д. Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д.).
|
|
|
Кроме указанных выше, электролиз нашел применение и в других областях:
· получение оксидных защитных пленок на металлах (анодирование);
· электрохимическая обработка поверхности металлического изделия (полировка);
· электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
· электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.);
· получение металлических сплавов;
· получение гальванических покрытий;
· электрохимическая очистка производственных сточных вод (электродиализ и обессоливание) – удаление из воды различных примесей, а также извлечение меди и других цветных и драгоценных металлов.
Актуальность электролиза объясняется тем, что многие вещества получают именно этим способом. Преимущество электролиза в относительной дешевизне и простоте. Однако чтобы производство было наиболее выгодным, с наименьшими затратами электроэнергии и с наибольшим выходом продукции, необходимо учитывать различные факторы, влияющие на количество и качество продуктов электролиза (сила тока, плотность тока, температура электролита, материал электродов и др.).
|
|
|
Таким образом, исследование электрохимических процессов, определение факторов, влияющих на них, установление новых способов использования процессов электролиза в промышленных условиях сохранило свою актуальность в наши дни.
Примеры решения задач
Пример 1. Какая масса меди выделится на катоде при электролизе раствора хлорида меди в течение 2 ч при силе тока 5 А?
Решение: Согласно I закону Фарадея:

Молярная масса эквивалента меди в CuCl2 равна 63,54/2 = 31,77 г/моль.
Подставив в формулу (4.1) значения Mэ = 31,77 г/моль; I = 5 А; τ = 2 ч = 7200 с, получим
 г
г
Пример 2. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение: Из формулы (4.2) выразим силу тока:
 или
или 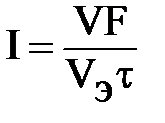 , где Vэ – эквивалентный объем газа.
, где Vэ – эквивалентный объем газа.
Эквивалентный объем водорода при нормальных условиях равен половине молярного объема 22,4/2 = 11,2 л.
Подставив в приведенную формулу значения VH2 = 1,4 л; Vэ(H2) = 11,2 л;
τ= 1 ч 40 мин 25 с = 6025 с, получим:
 А
А
Пример 3. В течение какого времени необходимо пропускать ток силой 2 А через раствор сульфата цинка, чтобы на катоде выделилось 10 г металла, если выход по току составляет 70%?
Решение: Используя формулы (4.4) и (4.1), выразим mПР и τ:
 ;
; 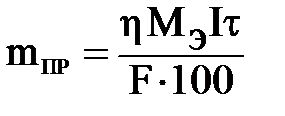 ;
; 
Подставив в приведенную формулу значения η = 70%; F = 96500 Кл;
mПР = 10 г; Mэ(Zn) = 65,38/2 = 32,69 г/моль; I = 2 A, находим

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: рассмотреть последовательность протекания процессов на электродах при электролизе водных растворов электролитов с растворимым и нерастворимым анодом.
Оборудование и реактивы: электролизер; выпрямитель ВСП-12; графитовые электроды; медный электрод. Растворы: нитрата калия (KNO3), 2%; иодида калия (KI), 0,2М; хлорида (сульфата) цинка (ZnCl2 (ZnSO4)), 5%; сульфата меди (CuSO4), 2%; серной кислоты (H2SO4), 2н. Лакмус 1%; фенолфталеин; крахмал.
Дата добавления: 2018-05-12; просмотров: 2209; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
