МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери железа вследствие ржавления достигают 20% от его ежегодного производства. Поэтому в технике широко используют различные меры защиты металлов, позволяющие свести коррозию к минимуму. Выбор метода защиты зависит от эффективности и экономической целесообразности.
Для защиты металлов от коррозии применяют следующие методы:
1. Легирование– введение добавок, повышающих коррозийную стойкость металлов. Например, при введении в состав стали до 12% хрома получают нержавеющую сталь, устойчивую к коррозии. Добавление цветных металлов – кобальта, никеля, меди усиливает антикоррозийные свойства стали, поскольку повышается склонность сплава к пассивации.
2. Обработка коррозийной среды – уменьшение содержания деполяризатора, нейтрализация кислых сред, удаление из воды кислорода (деаэрация), ее проводят на станциях водоочистки. Для этого воду пропускают через слой железной стружки, которая поглощает кислород из воды. В теплотехнике проводят обессоливание воды, так как соли – активаторы коррозии – значительно ускоряют коррозийный процесс. Для замедления коррозии металла в электролит вводят вещества, которые называются ингибиторами. К неорганическим ингибиторам относятся хроматы цинка и свинца, из органических ингибиторов используется уротропин, адипиновая кислота, бензонат натрия и др. Ингибиторы широко используются при химической очистке от накипи паровых котлов, а так же при хранении и перевозке кислот в стальной таре. Сравнительно недавно разработаны летучие (атмосферные) ингибиторы. Их применяют для пропитки бумаги, которой обертывают металлические изделия. Пары ингибитора адсорбируются на поверхности металла и образуют на ней защитную пленку.
|
|
|
3. Изоляция металлов от окружающей среды – различного рода покрытия. Покрытия бывают неметаллические, металлические, химические.
В качестве неметаллических покрытий используют самые разнообразные материалы: лаки, краски, эмали, битум, резину, синтетические смолы, полимерные материалы и т.п. Необходимым условием эффективности этого метода является чистота поверхности металла и отсутствие на ней влаги перед обработкой.
Химические покрытия получают путем химической или электрохимической обработки поверхности металла.
Например, оксидирование – обработка поверхности металла раствором кислот, щелочей, различных окислителей и восстановителей. Металл после такой обработки становится «пассивным», т.е. не подвергается коррозии и даже не растворяется в кислотах. Вещества, способствующие возникновению на поверхности металла защитной пленки обычно называют пассивирующими агентами (конц. HNO3, K2Cr2O7, NaNO2 и др.).
|
|
|
Фосфатирование – химическая обработка металлической поверхности, приводящая к образованию труднорастворимых фосфатов, которые характеризуются высокой степенью сцепления (адгезии) с основным металлом и хорошо защищает его от коррозии.
Из металлических покрытий широко распространены хромирование, никелирование, лужение, цинкование, серебрение, золочение. Металлические покрытия подразделяются на анодные и катодные.
Анодные покрытия изготавливают из металлов, имеющих меньшие значения электродных потенциалов, чем защищаемый металл.
Например, в случае оцинкованного железа (рисунок 3.1) поверхность железа (3) покрыта слоем цинка (2). До тех пор, пока целостность покрытия не нарушена, поверхность цинка изолирует основной металл (железо) от окружающей среды. Однако как только на цинковой поверхности образуется трещина, царапина или другое механическое повреждение, то кислота (1) входит в контакт с металлами, начинает работать микрогальванический элемент, в котором функцию анода выполняет цинк (Е° = - 0,763 В), а функцию катода – железо (Е° = - 0,440 В).
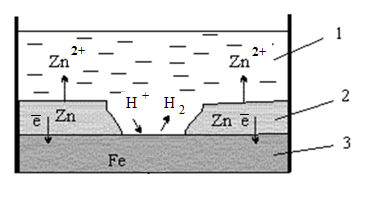
Рисунок 3.1. Схема разрушения оцинкованного железа в кислой среде
Составим схему и работу этого микрогальванического элемента в кислой
|
|
|
среде:
| А (–) Zn | HСl | Fe (+) K A(–): Zn – 2ē = Zn2+ – окисление K(+): 2Н+ + 2ē = Н2 – восстановление Zn + 2Cl- = ZnCl2 |
В этом случае разрушается слой покрытия, а стальная деталь не корродирует.
Подбирая анодные покрытия, необходимо учитывать то обстоятельство, что наиболее эффективно «работают» в роли анодных покрытий те металлы, электродные потенциалы которых максимально отличаются от электродных потенциалов основного металла (другими словами, металл-покрытие и основной металл должны стоять в таблице стандартных электродных потенциалов (см. приложение В) как можно дальше друг от друга).
Разновидностью анодной защиты является протекторная защита(см. рисунок 3.2).В переводе с латинского protector– защитник, покровитель. В этом методе к защищаемой металлической детали (3) припаивают или присоединяют металлическим проводником (2) пластины из более активного металла (1). При этом создается гальванопара, анодом которой является более активный металл, т.е. протектор. В качестве протекторов используют магний, алюминий, магниево-алюминиевые сплавы, цинк (его активность не столь высока, но он имеет низкую стоимость).
|
|
|
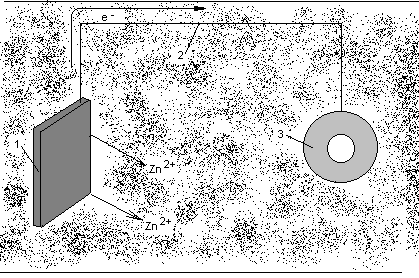
Рисунок 3.2 Схема протекторной защиты.
Металлы, применяемые для изготовления катодных покрытий, имеют больший электродный потенциал, чем защищаемый металл. Например: в случае луженого железа (белая жесть) железо (Е° = - 0,440 В), покрыто оловом (Е° = - 0,136 В).
Защитная роль катодного покрытия существенно отличается от действия анодных покрытий. На первой стадии (до нарушения целостности покрытия) особых различий нет, но как только возникают условия для работы гальванического элемента (оба металла вступают в контакт с агрессивной средой), функцию анода берет на себя основной металл, т.к. его потенциал имеет меньшее значение. В этих условиях коррозийному разрушению подвергается основной металл, а металл покрытия этому разрушению способствует, поляризуясь катодно.
Рассмотрим, как протекает процесс коррозии железа (3), находящегося в контакте с медью (2), во влажном воздухе (3) при нарушении покрытия (см. рисунок 3.3).
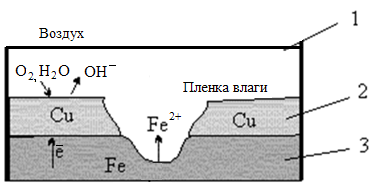
Рисунок 3.3 Схема атмосферной коррозии железа, находящегося в контакте с медью
| А (–) Fe | H2O, O2 | Cu (+) K A(–): Fe0 – 2ē = Fe2+ K(+): 2Н2О + О20 + 4ē = 4ОН- 2Fe + O2 + 2H2O = 2Fe(OH)2 При дальнейшем окислении железа получим: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
Катодное покрытие защищает основной металл от разрушения только при отсутствии повреждений на поверхности покрытия.
Для катодных покрытий целесообразно подбирать те металлы, электродные потенциалы которых в наименьшей степени отличаются от электродного потенциала основного металла (т.е. в таблице стандартных электродных потенциалов (см. приложение В) эти металлы должны находиться как можно ближе друг к другу).
4. Электрохимический метод защиты – катодная защита (метод внешнего потенциала).В этом методе (см. рисунок 3.4) защищаемое изделие (1) подключают к отрицательному полюсу внешнего источника постоянного тока (2), поэтому оно становится катодом, а анодом служит металлолом (3).
Например, защищаемая железная конструкция и вспомогательный (стальной) электрод образуют электрохимическую схему в воде:
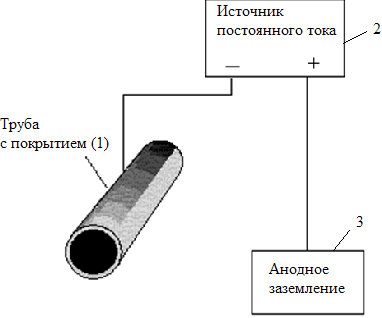
Рисунок 3.4. Схема катодной электрозащиты.
А (–) Fe | H2O | Fe (+) K
A(–): Fe0 – 2ē = Fe2+
K(+): 2Н2О + 2ē = H20 + 2ОН-
Fe + 2H2O = H2 + Fe(OH)2
При дальнейшем окислении железа:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Вспомогательный электрод разрушается и его периодически заменяют новым, а на защищаемой конструкции (катоде) восстанавливается среда (в данном случае – вода), получая электроны не от металла, а от источника тока.
С явлением «коррозия» мы встречаемся постоянно, поскольку изделия из металлов встречаются повсюду: автомобили, самолеты, мосты, станки, водопроводные трубы, железобетонные конструкции, предметы домашнего обихода и др. Борьба с коррозией в настоящее время приобрела особое значение, т. к. в промышленности и в технике применяют высокие температуры и давление, различные агрессивные среды – растворы кислот, солей, щелочей.
Коррозия наносит не только прямой ущерб – разрушение металла, но и косвенный – это связано с выходом из строя различных приборов, машин, металлоконструкций, которые являются более ценными, чем сам металл. Например, при коррозийном разрушении поршней автомобильного двигателя или шасси приводит к тому, что автомобиль теряет свое предназначение. Иногда коррозия приводит к авариям, например, в котельных установках могут происходить взрывы котлов.
Эффективность борьбы с коррозией основана на понимании механизма коррозийных процессов и должна решаться комплексным подходом – применением комбинированных методов защиты с учетом эффективности действия каждого из них в данных конкретных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы:смоделировать в лабораторных условиях процессы электрохимической коррозии металлических изделий и методы защиты металлов от коррозийных разрушений.
Оборудование и реактивы: пробирки; штатив для пробирок; наждачная бумага; фильтровальная бумага, пластинки: цинка, алюминия, оцинкованного железа, луженого железа; медный стержень; стальные гвозди; железные стружки; уротропин; 2%-ные растворы: сульфата меди (CuSO4), нитрата ртути (I) (Hg2(NO3)2), нитрата ртути (II) (Hg(NO3)2),гидроксида натрия (NaOH); растворы: серной кислоты (H2SO4), разб.; азотной кислоты (HNO3), конц.; красной кровяной соли (K3[Fe(CN)6]), 1M.
Дата добавления: 2018-05-12; просмотров: 618; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
