ОПЫТ 6. Влияние ингибитора на скорость коррозии
Налить в 3 пробирки (до 1/4 объема) раствор соляной кислоты. В одну из пробирок поместить пластинку цинка, во вторую – железные стружки и в третью – пластинку алюминия. Наблюдать выделение водорода. Затем добавить в каждую из пробирок немного уротропина. Какой наблюдается эффект?
КЕЙС-ЗАДАНИЯ
1. Газовая коррозия является примером химической коррозии. Она протекает на поверхности металла в условиях повышенных температур.
Определите термодинамическую возможность газовой коррозии изделия из углеродистой стали, протекающей по реакции:
Fe(т) + H2O(г) = FeO(т) + H2(г),
если это изделие эксплуатируется при 700°С под действием водяного пара с относительным давлением р H2O = 6 и р H2 = 1 (см. приложение Д).
2. Наиболее распространённый вид коррозии – это коррозия в электролитах. Такой вид коррозии называется электрохимический.
Возможна ли электрохимическая коррозия олова (Sn) в водном растворе (рН=6) при контакте с воздухом. Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода? (см. приложение В).
3. Наиболее распространенным окислителем, выполняющий роль деполяризатора, является кислород.
При электрохимической коррозии стального (железного) изделия с поглощением кислорода и без выделения водорода за 2 минуты работы коррозийного элемента образовалось 0,225 г Fe(OH)2. Вычислите объем кислорода при нормальных условиях, израсходованного на коррозию железа, коррозийный ток и массу растворенного металла.
|
|
|
4. Один из методов защиты металла от коррозии является применение различного рода покрытий – неметаллические, металлические и химические.
Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в нейтральную среду с рН=7? Рассчитайте ЭДС коррозийного элемента для стандартных состояний. При каких значениях рН прекратится процесс выделения водорода? (см. приложение В).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему коррозийная стойкость металла увеличивается при уменьшении примесей в нем?
2. Какой металл в паре Fe – Ni будет растворяться в разбавленном растворе уксусной кислоты? На каком металле выделяется водород?
3. В контакте с цинком или с железом коррозия магния будет происходить сильнее? Привести схему процесса коррозии.
4. Каковы причины возникновения коррозийных микрогальванических элементов?
5. Подвергается ли коррозии во влажном воздухе стальная деталь, покрытая кадмием или хромом при нарушении целостности защитного покрытия?
Лабораторная работа
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
|
|
|
4.1 Теоретическая часть
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую. Устройство для электролиза, называемое электролизером, состоит из двух электродов и электролита. Электрод, соединенный с отрицательным полюсом источника тока, называют катодом, а электрод, подключенный к положительному полюсу – анодом. На аноде протекают реакции окисления, на катоде – восстановления. При этом ионы электролита перемещаются к электроду противоположной полярности, а именно:
катионы – к катоду К (–)
анионы – к аноду А (+)
Например, при электролизе расплавахлорида магния MgCl2 на катоде образуется металлический магний, а на аноде молекулярный хлор (см. рисунок 4.1):
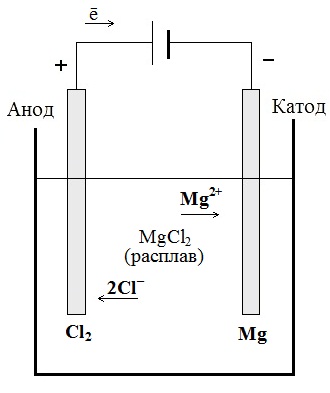 Рисунок 4.1 Электролиз расплава хлорида магния Рисунок 4.1 Электролиз расплава хлорида магния
| К (–) Mg2+ + 2ē = Mg0 A (+) 2Cl– – 2ē = Cl20↑ Суммарное уравнение процесса: MgCl2 = Mg0 + Cl20↑ Следовательно, при электролизе расплавов участниками этих процессов являются только ионы электролита (при условии использования инертных электродов). |
При электролизе водных растворовэлектролитов катодные процессы будут определяться электродным потенциалом катиона, который необходимо сравнить с потенциалом восстановления ионов водорода из воды (-0,41 В) (см. приложение Е):
|
|
|
1) Ионы металлов, потенциал которых значительно меньше этого значения, восстанавливаться не будут, на катоде будет восстанавливаться водород:
2H2O + 2ē = H2↑ + 2OH– (в нейтральной и щелочной средах)
2H+ + 2ē = H2↑ (в кислой среде)
К таким металлам относятся металлы начала ряда напряжений – приблизительно до марганца (см. приложение В).
2) При значениях потенциала металла, близких к -0,41 В (металлы средней части ряда от марганца до олова), на катоде происходит восстановление как ионов водорода (в зависимости от среды), так и ионов металла:
Men+ + nē = Me0
3) Ионы металлов, потенциал которых значительно выше этого значения (начиная от олова и до конца ряда напряжений), будут восстанавливаться на катоде.
Характер анодного процесса при электролизе зависит не только от природы аниона, входящего в состав электролита, но и от материала анода. Платиновый или графитовый электроды являются инертными анодами и не подвергаются окислению. Если же анод изготовлен, например, из железа, никеля, кадмия, меди, то происходит окисление материала анода. Такой электрод называют активным анодом.
|
|
|
Анодные процессы на инертных анодах будут определяться соотношением потенциалов разрядки анионов: прежде всего окисляются бескислородные анионы (I–, Br –, Cl–, S2–, CN–); если же раствор содержит кислородсодержащие анионы (PO43–, SO42–, NO3–), а также ионы F–, то на аноде будет выделяться кислород (см. приложение Е):
2H2O – 4ē = O2 + 4H+ (в кислой и нейтральной средах)
4OH– – 4ē = O2 + 2H2O (в щелочной среде)
В случае активного анода окисляется и сам анод. Например, процессы электролиза водного раствора сульфата меди с угольным (а) и медным (б) анодами включают следующие электродные процессы:
| а) K(–): Cu2+ + 2ē = Cu0 A(+): 2H2O – 4ē = O2 + 4H+ | б) K(–): Cu2+ + 2ē = Cu0 A(+): Cu0 – 2ē = Cu2+ |
В последнем случае происходит перенос массы металла с одного электрода (анода) на другой (катод). При этом масса анода уменьшается («анод растворяется»), а масса катода в процессе электролиза увеличивается. Поэтому электролиз с активным анодом часто называют электролизом с растворимым анодом.
Рассмотрим электролиз сульфата натрия с графитовыми электродами:
Na2SO4 ⇄ 2Na+ + SO42–
H2O ⇄ H+ + OH–
K(–): Na+; H+(H2O) A(+): SO42–; OH–(H2O)
Стандартный электродный потенциал системы Na+ + ē = Na0 (E°= -2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В), поэтому на катоде будет происходить электрохимическое восстановление воды по уравнению (см. приложение Е):
2H2O + 2ē = H2 + 2OH–
Ионы Na+ будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление воды по уравнению:
2H2O – 4ē = O2 + 4H+
Сульфат-ионы будут накапливаться в анодном пространстве.
Суммарное уравнение процесса:
эл.-з
2H2O = 2H2 + O2
Побочными продуктами электролиза являются гидроксид натрия (NaOH) и серная кислота (H2SO4).
Электролиз бромида хрома с графитовыми электродами:
CrBr3 ⇄ Cr3+ + 3Br –
H2O ⇄ H+ + OH–
K(–): Cr3+; H+ (H2O) A(+): Br –; OH– (H2O)
Стандартный электродный потенциал системы Cr3+ + 3ē = Cr0 (E° = -0,71В), поэтому на катоде будет происходить совместное восстановление хрома и восстановление воды с образованием водорода (см. приложение Е):
Cr3+ + 3ē = Cr0
2H2O + 2ē = H20 + 2OH–
На аноде разрядка бромид-ионов энергетически предпочтительнее окисления молекул воды, поэтому будет выделяться молекулярный бром:
2Br – – 2ē = Br20
Дата добавления: 2018-05-12; просмотров: 1218; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
