Некоторые сведения об органогенезах
Формирование головного мозга, глаз и конечностей позвоночных. Морфогенетические
взаимодействия между частями зачатка при развитии глаза, конечностей, желез пищеварительного тракта. Детерминация и регуляции при развитии органов.
Вторичные эмбриональные индукции, их механизмы.
Контактные и дистантные взаимодействия клеток. Механизмы клеточной агрегации.
Дифференцировка нервной трубки на головной и спинной мозг происходит одновременно с процессом нейруляции.
Нервная трубка зародышей всех позвоночных вскоре после замыкания состоит из более широкого переднего и более узкого заднего отделов. Расширенный передний отдел называют первичным мозговым пузырем (первичным головным мозгом - archencephalon)/ Первичный головной мозг открывается наружу невропором, а задний отдел посредством нервно-кишечного канала связан с задним отделом гастроцеля (в области дорсальной губы бластопора). Невропор и нервно-кишечный канал впоследствии зарастают.
 Нервная трубка по средней линии подстилается хордой, которая доходит до задней границы первичного головного мозга. Последний подстилается тканью, происшедшей из прехордальной пластинки. Как правило, задняя граница первичного головного мозга также отмечена резкой складкой вентральной стенки нервной трубки (вентральная мозговая складка), спереди от которой вентральная стенка первичного мозгового пузыря образует воронкообразный выступ (infundibulum), или воронку мозга. Вентральная мозговая складка и воронка формируют характерный для всех позвоночных теменной, или среднемозговой изгиб. В дальнейшем передняя часть нервной трубки дифференцируется на три мозговых пузыря: передний (prosencephalon), расположенный спереди от вентральной складки, средний (mesencephalon), находящийся над этой складкой, и задний (rhombencephalon), без резкой границы переходящий в спинной мозг. У зародышей высших позвоночных уже на стадии 3 мозговых пузырей при взгляде сверху отчетливо видны боковые выступы переднего мозгового пузыря, впоследствии дающие начало глазным зачаткам.
Нервная трубка по средней линии подстилается хордой, которая доходит до задней границы первичного головного мозга. Последний подстилается тканью, происшедшей из прехордальной пластинки. Как правило, задняя граница первичного головного мозга также отмечена резкой складкой вентральной стенки нервной трубки (вентральная мозговая складка), спереди от которой вентральная стенка первичного мозгового пузыря образует воронкообразный выступ (infundibulum), или воронку мозга. Вентральная мозговая складка и воронка формируют характерный для всех позвоночных теменной, или среднемозговой изгиб. В дальнейшем передняя часть нервной трубки дифференцируется на три мозговых пузыря: передний (prosencephalon), расположенный спереди от вентральной складки, средний (mesencephalon), находящийся над этой складкой, и задний (rhombencephalon), без резкой границы переходящий в спинной мозг. У зародышей высших позвоночных уже на стадии 3 мозговых пузырей при взгляде сверху отчетливо видны боковые выступы переднего мозгового пузыря, впоследствии дающие начало глазным зачаткам.
|
|
|
Позже передний мозговой пузырь подразделяется на два отдела: передний (telencephalon) и промежуточный (diencephalon) мозг. Из боковых стенок последнего в дальнейшем развиваются глазные зачатки. Средний мозговой пузырь в дальнейшем не расчленяется, а первичный задний мозговой пузырь подразделяется на задний (metencephalon) и продолговоатый (myelencephalon) мозг, переходящий без резкой границы в спинной мозг. У низших позвоночных эти отделы мозга лежат примерно в одной плоскости, а у высших головной мозг вскоре после формирования названных отделов образует новые резкие изгибы: затылочный и мостовой. Затылочный изгиб находится на месте перехода спинного мозга в продолговатый и направлен в ту же сторону, что и теменной. Мостовой изгиб располагается в области заднего мозга и назван так потому, что в вентральной стенке этого мозгового пузыря впоследствии возникает варолиев мост. Этот изгиб направлен в сторону, обратную двум другим изгибам. Все мозговые изгибы особенно хорошо выражены у высших млекопитающих и человека.
|
|
|
Уже на ранних стадиях развития разные отделы мозга отличаются друг от друга неравномерным утолщением стенок, что является прямым результатом интенсивности клеточного размножения в них. В области переднего мозга разрастаются переднебоковые стенки, что приводит к образованию пары выступов – зачатков полушарий головного мозга, которые особенно сильно разрастаются у высших позвоночных, где они накрывают собой все находящиеся сзади отделы мозга. вплоть до мозжечка. Неравномерное разрастание их поверхности приводит к появлению глубоких борозд. У низших позвоночных полушария переднего мозга развиты значительно слабее. Из них образуются лишь обонятельные доли мозга.
Из боковых стенок промежуточного мозга выпячиваются зачатки глаз – глазные пузыри. Утолщения боковых стенок промежуточного мозга образуют зрительные бугры. Дно промежуточного мозга формирует глубокое выпячивание – воронку мозга. Из ее нижнего конца возникает нейральная часть гипофиза. Из стенки промежуточного мозга, расположенной сзади от воронки, образуется подбугровая область мозга – гипоталамус, а в области тонкой дорсальной стенки промежуточного мозга – эпифиз, или шишковидная железа.
|
|
|
В четвертом мозговом пузыре (задний мозг) нижняя и боковые стенки вступают на путь развития мозжечка, а верхняя – варолиева моста. Пятый мозговой пузырь (продолговатый мозг) преобразуется в это время таким образом, что боковые стенки его утолщаются в связи с дифференцировкой проводящих путей от передних отделов мозга к сторону спинного. это приводит к растяжению дорсальной стенки, которая хорошо просвечивает на тотальных препаратах, так как данный отдел мозга аходится в боковом положении.
Продолговатый мозг переходит в спинной мозг. На протяжении шейного отдела зародыша спинной мозг выравнивается в плоское положение на желточном мешке. У птиц задний невропор закрывается на протяжении третьих суток инкубации.
|
|
|
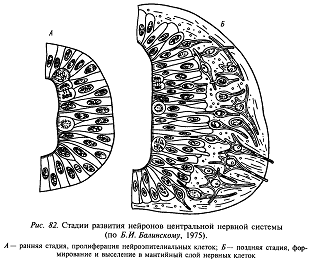 По гистологическому строению стенка нервной трубки (нейроэпителий) относится к ложномногослойным эпителиям. Это означает, что ядра слагающих ее клеток (нейробластов) находятся на разных уровнях но все нейробласты прикреплены к внутренней поверхности нервной трубки (к поверхности невроцеля). Во время деления нейробласты округляются, и их ядра смещаются в сторону невроцеля; в промежутках между делениями нейробласты вытягиваются, а ядра смещаются в сторону наружной поверхности нервной трубки. Таким образом, ядра нейробластов совершают как бы челночные движения. На более поздних стадиях развития, перед началом дифференцировки, нейробласты отрываются от внутренней поверхности нервной трубки и выходят из нейроэпителия наружу, образуя рыхлую клеточную массу – мантийный слой. В этом случае нейробласты приобретают характерные для нервных клеток отростки – дендриты (обращенные внутрь) и аксоны (направленные наружу) и превращаются в дифференцированные и не способные к клеточным делениям нейроны. Следующие поколения нейробластов, выходящих в мантийный слой, дифференцируются в клетки нейроглии. Клетки, оставшиеся в во внутреннем (прилежащем к невроцелю) слое нервной трубки, образуют эпендимную выстилку полостей головного и спинного мозга.
По гистологическому строению стенка нервной трубки (нейроэпителий) относится к ложномногослойным эпителиям. Это означает, что ядра слагающих ее клеток (нейробластов) находятся на разных уровнях но все нейробласты прикреплены к внутренней поверхности нервной трубки (к поверхности невроцеля). Во время деления нейробласты округляются, и их ядра смещаются в сторону невроцеля; в промежутках между делениями нейробласты вытягиваются, а ядра смещаются в сторону наружной поверхности нервной трубки. Таким образом, ядра нейробластов совершают как бы челночные движения. На более поздних стадиях развития, перед началом дифференцировки, нейробласты отрываются от внутренней поверхности нервной трубки и выходят из нейроэпителия наружу, образуя рыхлую клеточную массу – мантийный слой. В этом случае нейробласты приобретают характерные для нервных клеток отростки – дендриты (обращенные внутрь) и аксоны (направленные наружу) и превращаются в дифференцированные и не способные к клеточным делениям нейроны. Следующие поколения нейробластов, выходящих в мантийный слой, дифференцируются в клетки нейроглии. Клетки, оставшиеся в во внутреннем (прилежащем к невроцелю) слое нервной трубки, образуют эпендимную выстилку полостей головного и спинного мозга.
Глаза позвоночных формируются из парных боковых выпячиваний зачатка промежуточного мозга. По мере развития эти выпячивания (глазные пузыри) все больше отшнуровываются от зачатка промежуточного мозга, но полностью от него не отделяются, оставаясь соединенными с ним узким каналом – глазным стебельком.
Глазные пузыри растут немного назад и кнаружи, по направлению к покровной эктодерме, и затем соприкасаются с нею. В этом месте покровная эктодерма утолщается, образуя зачаток хрусталика – хрусталиковую плакоду. Та часть глазного пузыря, которая оказывается в контакте с хрусталиковой плакодой, начинает впячиваться, в результате чего глазной пузырь превращается в двухслойный глазной бокал. Инвагинация начинается в передненижней части пузыря, захватывая глазной пузырек. По мере углубления впячивания края глазного бокала начинают расти по направлению друг к другу, но некоторое время между ними остается щель, называемая глазной зародышевой щелью.
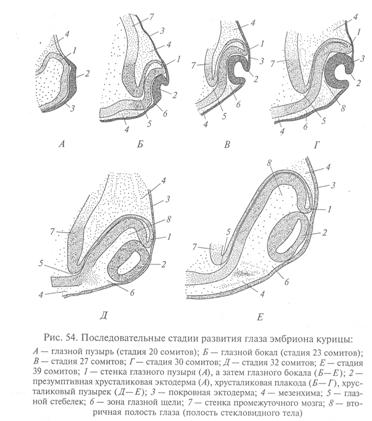 Внутренний слой глазного бокала становится зачатком сетчатки, а наружный – зачатком пигментного эпителия. Край глазного бокала (место перехода наружного листка во внутренний) становится зачатком радужки и цилиарного тела. Деление клеток приводит к утолщению и увеличению площади развивающегося зачатка сетчатки. Клетки же наружного листка истончаются и уплощаются, становясь зачатком пигментного эпителия.
Внутренний слой глазного бокала становится зачатком сетчатки, а наружный – зачатком пигментного эпителия. Край глазного бокала (место перехода наружного листка во внутренний) становится зачатком радужки и цилиарного тела. Деление клеток приводит к утолщению и увеличению площади развивающегося зачатка сетчатки. Клетки же наружного листка истончаются и уплощаются, становясь зачатком пигментного эпителия.
Перед тем, как превратиться в функционирующую сетчатку, внутренний слой глазного бокала должен пройти несколько этапов дифференцировки. Вначале клетки этого зачатка имеют одинаковое строение, сходное со строением клеток исходного мозгового зачатка, все они интенсивно делятся. Первыми прекращают деления и вступают на путь специфической дифференцировки глиальные элементы сетчатки, ядра которых занимают наиболее центральное положение в зачатке. Эти клетки называют мюллеровыми. Их отростки выходят на обе поверхности сетчатки и формируют ее наружную и внутреннюю пограничные мембраны. Следующими начинают дифференцировку будущие ганглиозные клетки, которые располагаются под внутренней пограничной мембраной. Аксоны ганглиозных клеток укладываются рядами вдоль внутренней поверхности сетчатки и, соединяясь в ее центре, выходят из глаза по глазной зародышевой щели, а позже, после ее замыкания – по глазному стебельку. Эти аксоны образуют зрительный нерв, подрастающий к первичному зрительному центру – крышке будущего среднего мозга.
Вслед за ганлиозными клетками дифференцируются клетки внутреннего ядерного слоя – биполяры, амакрины, горизонтальные клетки и наружного ядерного слоя.
По мере впячивания глазного бокала утолщенная часть покровного эпителия (хрусталиковая плакода) сама впячиватся в полость глазного бокала (она же – вторичная полость глаза), а затем полностью отшнуровывается от покровного эпителия. Возникает хрусталиковый пузырек – зачаток глазного хрусталика. Клетки внутреннего, обращенного к сетчатке слоя зачатка хрусталика сильно вытягиваются и превращаются в первичные хрусталиковые волокна, а клетки внешнего слоя сохраняют высокую пролиферативную активность и другие свойства эмбрионального эпителия.
Расположенный над хрусталиком покровный эпителий тоже испытывает сложные гистологические изменения, приводящие к тому, что он истончается, теряет пигмент (просветляется) и становится эпителием роговицы. Мезенхима, подстилающая покровный эпителий, дифференцируется в строму роговицы.
Наконец, в построении глаза участвуют и клетки эмбриональной мезенхимы, происходящие частично из мезодермы, но главным образом из нервного гребня. Эти клетки образуют сосудистую оболочку глаза – облегающие его кровеносные сосуды, а также склеру – опорную оболочку глазного яблока.
В ходе развития те части, из которых формируется глазной зачаток, вступают между собой в сложные индукционные взаимодействия. Еще в начале XX века было открыто, что у зародышей амфибий развитие хрусталика из покровной эктодермы индуцируется глазной чашей. Под влиянием пересаженной глазной чаши хрусталик может возникнуть на необычном месте, например развиться из брюшной или боковой эктодермы. Такая же индукция наблюдается при развитии глаза птиц и млекопитающих. Впрочем, у некоторых амфибий (зеленая лягушка) индуцировать развитие хрусталика глазной чашей не удалось. Однако, как показал Д.П. Филатов, это зависит не от отсутствия индуцирующих свойств у глазной чаши, а от более ранней детерминации покровной эктодермы. Действительно, у зародышей зеленой лягушки к моменту образования глазного пузыря эктодерма туловищной части зародыша уже утратила компетенцию к восприятию индукционных воздействий со стороны глаза. У этого вида амфибий индукция хрусталика происходит на более ранней стадии развития, причем индуктором служит передний конец хорды.
На более поздних стадиях развития и даже во взрослом состоянии глаз способен оказывать еще одно индукционное воздействие: он вызывает просветление покрывающей его эктодермы, превращая ее в роговицу.
Развитие и дифференцировка самого глазного зачатка (глазной чаши) в свою очередь зависит от воздействий со стороны окружения. Некоторое влияние на рост и форму глазного зачатка оказывает зачаток им же индуцированного хрусталика: удаление зачатка хрусталика ведет к прекращению роста глазного зачатка. Если же к глазному зачатку подсадить более крупный хрусталик от зародыша другого вида, то объем глазного зачатка тоже увеличивается.
Дифференцировка стенок глазной чаши в сетчатку и пигментный эпителий в значительной степени контролируется мезенхимным окружением. Та часть стенки глазного зачатка, которая (в норме или в опыте) окружена мезенхимой, дает начало пигментному эпителию; напротив, в сетчатку развивается та часть, которая лишена контактов с мезенхимой и утолщается в ходе развития.
В морфологической дифференцировке печени и поджелудочной железы немало общего: она сводится к последовательному ветвлению первоначальных зачатков — выступов кишечного эпителия — на все более тонкие выросты, вклинивающиеся в окружающую их мезенхиму. Как морфологическая, так и последующая цитологическая дифференцировка зачатков легких, печени и поджелудочной железы (как и более мелких желез пищеварительного тракта — больших слюнных желез) невозможна без взаимодействия эпителия с окружающей его мезенхимой. j
Зачаток печени (непарный печеночный вырост) подразделяется затем на две части: переднее выпячивание, образующее собственно зачаток печени, и заднее — зачаток желчного пузыря. Выпячивание печени, имеющее вначале вид плотного тяжа, в дальнейшем многократно разветвляется на многочисленные печеночные тяжи, которые, переплетаясь друг с другом и разрастаясь, образуют железистую паренхиму. В дальнейшем между ними врастают мезенхимная ткань и кровеносные сосуды.
В ходе последующего развития дифференцируются гепатоциты с их характерной внутриклеточной структурой. Небольшая часть гепатоцитов на поздних стадиях развития становится полиплоидной (тетра- или октаплоиды).
Поджелудочная железа развивается из двух выпячиваний кишечной трубки: дорсального и возникающего несколько позже центрального. В дальнейшем благодаря повороту двенадцатиперстной кишки вокруг своей оси оба зачатка сближаются и в конце концов срастаются, открываясь в кишку единым протоком. В поджелудочной железе образуются два типа специализированных клеток: эндокринные (вырабатывающие инсулин) и экзокринные (синтезирующие липазы и амилазы). Первый тип клеток — клетки островков Лангерганса. Они развиваются из клеток эпителия кишки под индуцирующим влиянием мезодермы.
Для дифференцировки энтодермальных зачатков требуются непосредственные контакты с мезодермой, причем на ранних стадиях развития менее специфические, а для окончательной дифференцировки — более специфические контакты. Так, для формирования выроста легкого из эпителия передней кишки достаточен контакт эпителия с мезенхимой этого же зачатка. Добавление чужеродной мезенхимы может полностью изменить направление развития зачатка: под влиянием мезодермы желудка легочная энтодерма будет образовывать структуры, сходные с железами желудка, под влиянием мезодермы печени — печеночные тяжи. Для начальных стадий морфогенеза зачатка печени необходим его контакт с мезодермальными клетками зачатка сердца, а для дальнейшей биохимической дифференцировки клеток печени — контакт с собственной, печеночной мезодермой. Присутствие специфической мезодермы необходимо также для полной дифференцировки и функционирования щитовидной железы. Несколько менее специфические влияния требуются при развитии поджелудочной железы: для нормальной дифференцировки эпителия поджелудочной железы в клетки, секретирующие гормоны (в том числе инсулин), также необходим контакт с мезенхимой, но в условиях эксперимента собственная мезенхима поджелудочной железы может быть заменена чужеродной мезенхимой слюнных желез или вторичной почки.
Почти все органы и структуры позвоночных животных формируются из участков столбчатого (поляризованного) эпителия (за исключением элементов скелета и кровеносных сосудов, строящихся из мезенхимных клеток).
По современным данным, в основе которых лежат работы американского ученого Д. Эдельмана, эпителизация мезенхимы, а также усиление контактов между эпителиальными клетками (происходящее при их поляризации) связаны с синтезом в данных клетках так называемых молекул клеточной адгезии (англ. — cell adhesion molecules, или САМ). Они представляют собой гликопротеины. Широкое распространение в зародышах и взрослых организмах имеет разновидность этих молекул, названная N-CAM. Эти молекулы определяют, в частности, адгезию нейроэпителиальных клеток зародыша друг к другу (N — от neural). У зародышей шпорцевой лягушки они появляются перед началом нейруляции, когда возрастают контактные зоны между поляризующимися клетками нервной пластинки. Присутствуют они и в других столбчатых эпителиях. Другая разновидность молекул клеточной адгезии называется L-CAM. Она выделена из печени (L — от liver — печень), но встречается и во многих типах клеток. При подавлении синтеза САМ клетки данного типа не образуют между собой контактов. Наоборот, если в мезенхимные клетки, лишенные генов L-CAM, ввести эти гены, то клетки склеиваются в плотный эпителий. Наконец, описаны так называемые Ng-CAM, ответственные за установление контактов между нейронами и клетками нейроглии.
Наличие и распределение различных видом САМ резко меняются по ходу развития зародышей. Например, в бластодерме куриного зародыша до начала гаструляции наблюдается более или менее равномерное распределение как N-CAM, так и L-CAM по всему эпибласту и гипобласту. При миграции мезодермальных клеток через первичную бороздку на их поверхности вообще не обнаруживается САМ. Вскоре, однако, на поверхности клеток презумптивной нервной системы и осевых органов обнаруживаются исключительно молекулы N-CAM, а на клетках будущей покровной эктодермы и энтодермы — исключительно L-CAM.
Сходные молекулы клеточной адгезии — кадгерины — обнаружены у зародышей млекопитающих, причем один из них (Е-кадгерин) выявляется уже на стадии зиготы. Позже в трофобласте, а также в стенке матки обнаруживается другой вид молекул — Р-кадгерин, возможно, ответственный за клеточные контакты при имплантации зародыша. Клетки нейроэктодермы утрачивают К-кадгерин, но приобретают новый — N-кадгерин. Таким образом, параллельно с морфологическими изменениями происходят сложные молекулярные перестройки клеточных поверхностей, определяющие, какие клетки будут в дальнейшем развиваться совместно, а какие — отделяться друг от друга.
Таким образом, основную роль в органогенезах играет кооперативное, согласованное поведение (поляризация, сокращение) обширных групп клеток, в ходе которого отдельные клетки перемещаются и меняют своих соседей сравнительно мало. Однако наряду с этими процессами в некоторых случаях наблюдаются весьма далекие (конечно, в масштабах зародыша) миграции
клеточных групп или одиночных клеток. На ранних стадиях развития зародышей позвоночных сюда можно отнести вентродорсальные движения мезодермы. На более поздних стадиях развития самыми активными мигрантами являются, как уже говорилось, клетки, произошедшие из нервного гребня
Существуют три гипотезы, претендующие на объяснение направленности движения клеток и роста аксонов: хемотаксическая, гальванотропическая и контактно-механическая. Согласно первой гипотезе, клетки или окончания аксонов «ощущают» градиенты концентрации определенных диффундирующих в межклеточную среду веществ и растут в сторону повышения их концентрации. Для аксонов нервных клеток к настоящему времени описан ряд таких веществ, причем некоторые действуют на относительно далеких расстояниях, а другие осуществляют более «близкое» притяжение. К первым, найденным у насекомых, относятся так называемый семафорин и особые белки — нетрин-1 и нетрин-2. В частности, клетки наиболее вентральной части эмбрионального спинного мозга выделяют нетрин-1, а более дорсально расположенные клетки — нетрин-2. К каждому из этих отделов притягиваются специфические нейроны. Примечательно, что функции нетринов изменяются, если они связываются с веществами межклеточного матрикса. Например, если нетрин-1 связывается с ламинином, входящим в состав базальных мембран, подстилающих эпителиальные слои, то он начинает отталкивать аксоны. Этот факт показывает, что химические факторы действуют в организме не сами по себе, а в зависимости от структур, с которыми они связаны
Рассмотрим другой, очень важный пример установления точных связей между окончаниями аксонов и нервными центрами. Речь пойдет о так называемой ретино-тектальной проекции — совокупности связей между окончаниями волокон зрительного нерва и строго определенными точками зрительной области среднего мозга (tectum opticum). В сетчатке развивающегося глаза формируется градиент концентрации особых рецепторных (и одновременно энзиматических) белков — рецепторов к белкам-эфринам. Концентрация эфриновых рецепторов (ЭР) выше на височной (темпоральной) стороне сетчатки, нежели на противоположной ей назальной. Аксоны, берущие начало от различных зон сетчатки, содержат ЭР в концентрациях, пропорциональных названному градиенту, так что последний по мере роста аксонов как бы «переносится» к tectum opticum. Независимо от этого, еще до установления контактов с аксонами, в tectum opticum устанавливается градиент концентрации лигандов к ЭР, то есть самих белков-эфринов. Их концентрация выше в заднем отделе tectum opticum и ниже — в переднем. Назальные аксоны с низкой концентрацией ЭР одинаково хорошо устанавливают связи со всеми областями tectum opticum, тогда как височные аксоны с высокой концентрацией ЭР — только с передней областью tectum opticum, где концентрация лигандов наименьшая. Очевидно, что такой гип связей обеспечивает одинаковую прочность контактов вдоль всей протяженности tectum opticum. Таким образом осуществляется «грубая разметка» ретино-тектальных связей. Более тонкая разметка достигается позже, когда зрительно-двигательная рефлекторная дуга начинает функционировать. В этот период действует метод «проб и ошибок»: «неправильные» контакты, которые не обеспечивают точных реакций, устраняются, а «правильные» закрепляются. Таким образом, точность не устанавливается изначально, а возрастает постепенно, с использованием целостных и вероятностных механизмов.
Определенное значение для ориентации роста аксонов и некоторых типов эмбриональных клеток могут иметь электрические поля. Установлено, что вне организма аксоны растут в сторону катода. Наличие хотя и слабых, но достаточных для ориентации аксонов электрических полей в зародышах доказано прямыми измерениями. Другие виды эмбриональных клеток (нервного гребня, миобласты, эндотелиальные) определенным образом ориентируются в электрических полях (чаще они становятся боком к вектору поля) и затем начинают двигаться к какому-либо полюсу (обычно к катоду). Тем не менее, еще не доказано, что именно гальванотропизм является решающим фактором, определяющим направление движений клеток.
Важную роль в ориентации роста аксонов и движений клеток играют механические натяжения и неоднородности субстрата. Впервые это было продемонстрировано более 70 лет тому назад австрийским эмбриологом П. Вейссом. Вейсс наблюдал, что эмбриональные фибробласты и окончания аксонов, высаженные на определенным образом растянутый субстрат (например, каплю кровяной плазмы), ориентируются и движутся вдоль линий механического натяжения; на нерастянутом субстрате они утрачивают определенную ориентацию и направление движения. Вейсс назвал данное явление «контактным ведением» (contact guidance). Оно может определяться неравномерной «концентрацией натяжений» в разных точках субстрата. Если в одних точках линии натяжений сконцентрированы вокруг одного фокуса, а в других областях они более «размазаны», то клетки движутся в область самой высокой концентрации натяжений. Такое явление названо тензотаксисом.
Многочисленные данные о влиянии неоднородностей субстрата (например, естественных или искусственных микро-бороздок) на движение клеток были получены Ю.М. Васильевым с сотр. Подобные факторы могут оказывать влияние на движения и образование скоплений клетками — производными нервного гребня. Важную роль играют также вещества внеклеточного матрикса. Если такие его компоненты, как ламинин (входящий в состав базальных мембран) и фибронектин стимулируют движения клеток нервного гребня, то коллаген II типа, откладывающийся, по данным ряда авторов, преимущественно на выпуклых поверхностях нейральных пластов, задерживает на себе эти клетки, повышая их концентрацию и способствуя образованию в этих местах хрящей черепа, слуховой и обонятельной капсул и висцерального скелета.
При обзоре развития различных органов мы отмечали наличие многочисленных индукционных взаимодействий между их частями: глазная чаша индуцирует в накрывающей ее покровной эктодерме образование сначала хрусталика, а затем роговицы; почечная лоханка (вырост вольфова протока) индуцирует образование мочевых канальцев в метанефрогенной мезенхиме и т.д. На более поздних стадиях развития многих зачатков происходят, как мы видели, эпителиально-мезенхимные взаимодействия.
В ряде случаев индукционные процессы следуют один за другим, образуя как бы цепи индукций. Например, энтодерма дорсальной стороны зародыша индуцирует из прилежащего к ней района крыши бластоцеля хордомезодерму; последняя индуцирует из покровной эктодермы центральную нервную систему, а выделившийся как ее часть промежуточный мозг — хрусталик; продолговатый мозг индуцирует слуховой пузырек, а последний — слуховую капсулу.
Но далеко не все этапы органогенезов связаны с индукциями. Например, несмотря на многочисленные поиски, так и не обнаружен индуктор закладки парных конечностей позвоночных в их нормальном развитии, а в экспериментальных условиях в роли индуктора выступает, совершенно чужеродная закладка — слуховой пузырек.
Практически ни в одном случае структура индуцируемой закладки не задается индуктором: она зависит в первую очередь от свойств индуцируемой ткани. Индукторы, как правило, — только пусковые, или «снимающие запрет», факторы («индукция по умолчанию»).
Механизмы индукции.
Несмотря на утверждения ряда исследователей, что индукция хрусталика глазной чашей определяется некоторым химическим фактором, выделяемым чашей, такой фактор с достоверностью не обнаружен. В случае индукции метанефрогенной мезенхимы чужеродным индуктором — нервной трубкой — показано, что для успешного результата необходимо наличие контактов между клеточными отростками индуктора и реагирующей ткани. Таким образом, в данном случае индукция осуществляется благодаря контактным межклеточным взаимодействиям.
Наиболее определенные результаты получены для мезенхимно-эпителиальных взаимодействий при развитии желез энтодермального происхождения. Здесь воздействие мезенхимы на эпителий осуществляется через посредство компонентов внеклеточного матрикса, в первую очередь коллагена, продуцируемого мезенхимными клетками. Именно выделяемый ими и подстилающий эпителий коллаген повышает пролиферативную активность эпителиальных клеток и сообщает эпителию способность ветвиться.
Возможно, что перестройки внеклеточного матрикса играют ключевую роль и в других индукционных процессах. Так, индукция мочевых канальцев в метанефрогенной мезенхиме связана с деградацией присутствующего в ней ранее коллагена II типа и с последующим синтезом другого, IV типа коллагена. Одна и та же стволовая клетка может дать начало соединительной ткани при добавлении в среду фибронектина и коллагена 1типа, хрящу — при добавлении коллагена II типа и эпителию — при добавлении коллагена IV типа. Возможно, что и индукция плакод органов чувств в покровной эктодерме связана с такими перестройками подстилающего их матрикса, в результате которых данные клетки перестают распластываться вдоль поверхности, как обычный покровный эпителий, и приобретают свойство поляризоваться.
Дифференциация клеток
Дифференцировка клеток как синтез специфических белков и сборка надмолекулярных структур. Дифференцирующая роль движений внутриклеточных компонентов. Дифференцировка клеточных мембран.
Современные представления о механизмах регуляции синтезов специфических белков.
Возможные уровни регуляции: уровень соматических мутаций, транскрипционный, трансляционный, посттрансляционный. Что дают опыты по пересадкам клеточных ядер для суждения об уровнях регуляции?
Дифференциальная экспрессия генов, ее основные пространственные закономерности у зародышей насекомых и позвоночных. Химические и физические регуляторы клеточной дифференцировки.
Каждый эмбриональный зачаток дает различные типы дифференцированных клеток. По современной номенклатуре в организме высших животных и человека насчитывается около 210 различных типов дифференцированных клеток, из которых более 60% возникают из различных эмбриональных эпителиев. Однако с учетом клонов В-лимфоцитов общее количество типов дифференцированных клеток в организме высших животных и человека должно превышать миллион.
Клеточная дифференцировка основана на синтезе специфических белков, т.е. клетки, дифференцированные в разных направлениях, отличаются друг от друга хотя бы по одному специфическому белку. Специфичность здесь понимается в совершенно определенном химическом смысле как специфичность последовательности аминокислот (первичной структуры) белковой молекулы. Обычно постулируется, что вторичная, третичная и четвертичная (если она есть) структуры белковой молекулы однозначно выводятся из первичной.
Специфичные белки иногда еще называют «белками роскоши», поскольку они требуются не для самого существования клетки, а связаны с выполнением ею определенной специализированной функции. Перечислим некоторые типы специфических белков («белков роскоши»), которые синтезируются в дифференцированных клетках: фибробласты синтезируют коллаген; клетки покровного эпителия — кератин; миобласты — миозин; фоторецепторы — опсин («зрительный белок»); эритроидные клетки (впоследствии превращающиеся в эритроциты) — гемоглобин; клетки эпителия пищеварительного тракта —- пепсин и трипсин (пищеварительные ферменты); В-лимфоциты различных клонов как уже говорилось, миллионы специфичных антител.
Синтез специфических белков далеко не исчерпывает всего, что связано с дифференцировкой. Дифференцированная клетка менее всего похожа на бесформенный мешок с белками. Еще первые гистологи и цитологи отмечали удивительно сложную структурную организацию многих дифференцированных клеток. В наибольшей мере это относится, пожалуй, к рецепторным клеткам. Сложной архитектурой обладают и другие типы клеток, например эпителиально-мышечные клетки кишечнополостных, выполняющие одновременно опорные, сократительные и иногда чувствующие функции.
Исследования недавнего времени позволили установить молекулярные и надмолекулярные основы столь сложной клеточной организации. Надмолекулярная организация клетки связана прежде всего со структурами их плазматических мембран и с элементами цитоскелета.
Основное свойство плазматических мембран дифференцированных клеток — наличие специфических мембранных рецепторов. Они представляют собой встроенные в липидный матрикс мембран молекулы гликопротеинов (комплексов белков с углеводами). На внешних, обращенных в межклеточное пространство концах рецепторов расположены строго определенные последовательности остатков углеводных молекул, изменяющих свою конформацию при связывании с эффекторами — молекулами гормонов, медиаторов, витаминов, вирусов, антигенов и других факторов, действующих извне на клетку. Эти конформационные изменения передаются по молекуле рецептора сквозь мембрану в субмембранные слои клетки, где начинаются каскады внутриклеточных реакций, осуществляющихся благодаря активации так называемых вторичных посредников— циклических нуклеотидов, звеньев инозитолфосфатной системы и др. В ряде случаев первым звеном, на которое оказывает влияние возбужденный (связанный с молекулой эффектора) внутриклеточный рецептор, является активация фермента аденилатциклазы, синтезирующего циклическую аденозинмонофосфорную кислоту (цАМФ).
Кроме специфических мембранных рецепторов в плазматическую мембрану встроены специальные «белковые машины», обеспечивающие транспорт ионов либо по градиентам их концентрации (ионные каналы), либо против градиентов (ионные помпы, или насосы). Из последних для жизнедеятельности клеток особое значение имеет Na+, К+-насос (или Na+, К+-АТФаза), откачивающий, при затрате энергии АТФ, ионы натрия и клетки во внешнюю среду, а ионы калия — внутрь клетки.
Мембранные рецепторы, ионные каналы и насосы — подвижные образования. Они могут перемещаться, концентрироваться или диспергироваться в плоскости плазматической мембраны (явление латеральной подвижности), а также выходить из плоскости мембраны, деградировать и заменяться новыми. Например, в миобластах каждую минуту деградирует и заменяется новыми молекулами примерно 1 мкм2 поверхности. Латеральная подвижность и деградация элементов плазматической мембраны связаны между собой и имеют определенную направленность: у ползущего фибробласта элементы мембраны постоянно встраиваются на переднем конце движущейся клетки, перемещаются по поверхности фибробласта назад и деградируют (интернализуются) на заднем конце клетки. Встраивание элементов мембраны связано с процессами экзоцитоза, а деградация — с процессами эндоцитоза. Надмолекулярная организация плазматической мембраны и клетки в целом имеет динамический характер.
В поддержании полярности дифференцированных клеток важную роль играют микротрубочки. При искусственном разрушении микротрубочек клетка, как правило, деполяризуется. Микротрубочки способствуют также определенному расположению в цитоплазме аппарата Гольджи и осуществляют направленный транспорт ряда белков. Микротрубочки — высоколабильные образования, способные разрушаться и вновь собираться в течение нескольких минут.
Существенную роль в поддержании характерной формы клетки, а также в передвижениях внутриклеточных органелл и мембранных пузырьков играют сократительные волоконца — микрофиламенты, состоящие из белка актина и других, связанных с ним белков (в первую очередь миозина). Микрофиламенты также способны быстро собираться, разбираться и перемещаться по клетке. Ряд сложных клеточных дифференцировок (всасывающие клетки эпителия почек и кишечника, рецепторные клетки) связан со сборкой мощных пучков актиновых микрофиламентов, образующих структурную основу микроворсинок, размеры и структура которых весьма точно регулируются. Например, в глазах головоногих моллюсков над поверхностью каждой клетки сетчатки плотно упакованы сотни тысяч микроворсинок, причем в соседних клетках ряды ворсинок взаимно перпендикулярны, что позволяет животным распознавать плоскость поляризации света. Еще более точно организованы микроворсинки на поверхности волосковых клеток внутреннего уха: в пределах каждой клетки имеются микроворсинки различной длины, расположенные в строгой последовательности. Таким образом, в ходе дифференцировки волосковой клетки должны регулироваться число, длина и расположение микроворсинок.
Особо сложные типы клеточных дифференцировок осуществляются путем координированной активности многих внутриклеточных образований — мембраны, микротрубочек (и центров их организации, связанных с центриолями), аппарата Гольджи и ряда других. Один из замечательных примеров такой цитодифференцировки — образование стрекающих клеток (нематоцист) кишечнополостных из тотипотентных интерстициальных клеток. Процесс начинается с того, что поблизости от аппарата Гольджи (вероятно, из его цистерны) формируется капсула, содержащая мелко гранулированный материал. Затем размеры капсулы увеличиваются, она удлиняется и по форме становится похожей на тыкву. Ее удлинение на этой стадии явно контролируется микротрубочками, которые образуют спиральный пучок, обволакивающий верхушку капсулы. После этого на верхушке капсулы ее внутренняя стенка начинает вворачиваться, образуя длинную свернутую нить. В непосредственном окружении нити формируется серия «шипов», образующих вооружение нематоциста; у некоторых видов нематоцист кроме шипов формируется еще и мощный стилет. Центриоль нематоцисты дает начало чувствующему волоску — книдоцилю, в основе которого лежит пучок микротрубочек. Книдоциль представляет собой механорецептор стрекательной клетки, в ответ на возбуждение которого происходит ее разрядка, представляющая собой быструю эвагинацию (выворачивание наружу) содержимого стрекательной капсулы — сначала стилета, а затем шипов и нити: «катапультирование» стилета осуществляется менее чем за 10 мс, причем за это время стилет развивает ускорение в 40 ООО g и достигает средней скорости 2 м/с. Предполагается, что движущей силой этого процесса является сброс высокого осмотического давления внутри капсулы.
Уровни регуляции клеточной дифференцировки:
1. Уровень соматических мутаций. Предположим, что в разных клетках зародыша произошли различные изменения в первичной структуре ДНК— выпадения, повторы, повороты (инверсии) или перемещения отдельных ее участков (генов). Эти изменения будут наследоваться в соматическом потомстве (клоне) данной клетки. Поэтому такие события можно назвать соматическими мутациями.
Разберем немногочисленные, но важные исключения из общего правила эквивалентности геномов соматических клеток. Одно из них — явление амплификации генов. Мы уже говорили об амплификации рибосомных генов в оогенезе многих видов животных. Установлено, что амплифицироваться могут и нерибосомные гены, например гены, кодирующие структуру белков хориона яйца у дрозофилы. Другие случаи амплификации генов в нормальном развитии неизвестны, однако амплификация описана при злокачественном росте.
Другой яркий пример клеточной дифференцировки на основе соматических мутаций — дифференцировка В-лимфоцитов, продуцирующих антитела. В эмбриональном развитии при дифференцировке клонов В-лимфоцитов в тех участках их генома, которые кодируют белки антител (иммуноглобулины), происходят перемещения (транслокации) определенных групп генов.
Иммуноглобулины состоят из так называемых легких и тяжелых аминокислотных цепей. Гены для легких цепей содержат 2вариабельных сегмента ДНК— V и J — и константный сегмент С. Сегмент V содержит около 300 различных нуклеотидных последовательностей, а сегмент J — 4-5 таких последовательностей. На нитях ДНК еще недифференцированных клеток участки V, J и С пространственно разделены. В ходе дифференцировки промежуточная ДНК элиминируется, и любая из V-последовательностей может сблизиться с любой из J- последовательностей, а их комбинация — с константным С-сегментом. Таким образом, возникает 300*5 = 1500 различных комбинаций генов. Гены для тяжелых цепей содержат вариабельные сегменты V, D и J, состоящие соответственно из 200, 10-15 и 4 последовательностей, а также константный участок С. Их комбинирование добавляет еще примерно 200*10*4 = 8000 вариантов. Произведение 1500 * 8000 = 10 млн достаточно велико, чтобы обеспечить потребности организма в различных типах антител.
Близкое к соматическим мутациям явление — инактивация одной из половых (X)-хромосом у эмбрионов самок млекопитающих (у самок мыши такая инактивация наступает на 3-6-й день эмбрионального развития). Для установления необходимого генетического баланса должна быть инактивирована одна из имеющихся Х-хромосом, причем выбор между инактивацией материнской или отцовской хромосомы осуществляется в каждой соматической клетке случайно. Инактивированная хромосома обнаруживается под микроскопом в виде плотного скопления хроматина — тельца Барра, присутствие которого используется для установления пола эмбриона.
Дифференцировка путем соматических мутаций наблюдается у фотосинтезирующих бактерий Anabaena, образующих многоклеточные колонии. Если эта бактерия живет в условиях избытка азотистых соединений, во всех клетках происходит фотосинтез, и все они похожи друг на друга. Но когда азота начинает не хватать, появляются специализированные клетки - гетероцисты, лишенные хлорофилла, но синтезирующие фермент нитрогеназу, с помощью которой атмосферный азот превращается в усвояемую форму. Оказалось, что при формировании гетероцист в них происходит перестройка ДНК, в результате которой возникает последовательность нуклеотидов, кодирующая одну из субъединиц нитрогеназы. Последнее позволяет предположить, что дифференцировка клеток путем соматических мутаций — эволюционно древний способ, который в дальнейшем ходе эволюции оказался почти полностью вытесненным другими способами, обеспечивающими большую пластичность клеточного состава организмов и легче доступных пространственно-временному управлению.
2. Уровень транскрипции. Пусть клетки обладают идентичной структурой ДНК, но в некоторых из них активны одни гены, а в других — другие. Тогда они будут осуществлять транскрипцию разных наборов мРНК и дифференцироваться в разных направлениях. В этих случаях мы будем говорить о регуляции дифференцировки на уровне транскрипции.
Клетки эукариот обладают широкими возможностями регуляции активности структурных генов. Для этого у них имеются обширные области ДНК, называемые контролирующими районами. В них различают промоторы — участки ДНК, непосредственно примыкающие к данному структурному гену и связывающие РНК-полимеразу, а также более удаленные и обширные участки ДНК, называемые энхансерами. Один структурный ген может
иметь несколько энхансеров. Это обозначается как многомодульная регуляция. Энхансеры связываются с обширными комплексами белков (так называемыми гетеромультимерами), которые в зависимости от своего состава могут либо усиливать, либо подавлять действие данного структурного гена. Многомодульная регуляция и переход от стимуляции данного структурного гена к его подавлению даже при небольшом изменении состава белкового гетеромультимера способствует разнообразию клеточных дифференцировок, столь характерному для эукариот. Воздействие энхансера на данный структурный ген осуществляется благодаря изгибу расположенного между ними участка ДНК, в результате чего комплекс энхансер-белки устанавливает непосредственный контакт со структурным геном. Изгиб возможен благодаря тому, что при связывании энхансера с белками изменяется структура (происходит деконденсация) всего достаточно обширного участка ДНК, расположенного между энхансером и контролируемым им структурным геном.
К процессам, регулирующим активность генов на уровне транскрипции, относится также метилирование-деметилирование различных участков ДНК по цитозину. Метилирование блокирует, а деметилирование деблокирует активность данных генов. Как правило, в ходе раннего развития зародышей происходит деметилирование ДНК, в результате чего и происходит активация генов. Позже, по ходу дифференцировки, уровень метилирования может снова возрасти, оказаться специфическим для данного типа клеток и способствовать поддержанию устойчивости его дифференцировки.
Другой недавно обнаруженный фактор, влияющий на активность и, возможно, на специфичность транскрипции — размер доменов (петлеобразных участков) ДНК, возникающих при ее прикреплении к ядерному матриксу. Этот размер, как правило, увеличивается по ходу развития.
Первыми результатами в пользу гипотезы дифференциальной активности генов были цитологические данные, показавшие, что способность к синтезу мРНК не распределена равномерно по всей хромосоме, а в ней существуют более и менее синтетически активные участки. Мы уже знакомы с этим на примере хромосом ооцита: синтез мРНК идет там только на выпетлившихся участках «ламповых щеток», а синтез рибосомальной РНК и амплификация генов — на других участках хромосом.
Аналогичные синтетически активные, вздутые участки хромосом (пуфы) обнаружены в ядрах клеток слюнных желез дрозофилы. Мощность и расположение пуфов изменяются под воздействием гормонов. Пуфы, как и «ламповые щетки», представляют собой расплетенные, деконденсированные участки хромосом.
Открытие пуфов явилось исторически первым свидетельством того, что гормоны непосредственно влияют на активность действия генов. Но приведенные выше данные в пользу дифференциальной активности генов являются все же косвенными. Прямыми данными были бы лишь сравнения различных типов дифференцированных клеток по составу молекул только что транскрибированных предшественников мРНК — пре-мРНК. Такие сравнения проводят методом молекулярной гибридизации молекул РНК с комплементарными им ДНК (кДНК), синтезированными на соответствующих молекулах мРНК методами генетической инженерии с использованием обратной транскриптазы — фермента, синтезирующего ДНК по матрице мРНК. Гибридизацию можно проводить как in vitro, в биохимических пробах, содержащих извлеченную из изучаемых клеток фракцию РНК, так и на образцах целых организмов или на гистологических срезах. В последнем случае, если наносить на срез ДНК, меченную каким-либо изотопом, можно получать карты-автографы экспрессии определенных генов. Этот метод получил название гибридизации in situ.
Впервые подробные исследования с применением этого метода были выполнены на яйцеклетке дрозофилы. Установлено, что у зародышей дрозофилы белки, кодированные ранее включенными генами, являются активаторами для последующих групп генов. Так, места экспрессии генов группы gap определяются концентрацией белка bicoid, а места экспрессии генов группы pair-rule — соотношением коцентраций белков, кодированных генами группы gap. При этом используется многомодульная регуляция структурных генов.
Надо, однако, заметить, что такой «прямолинейный» путь активации последующих генов белками, кодированными на ранее работавших генах, является скорее исключением, чем правилом: в яйцеклетке дрозофилы он может действовать благодаря ее синцитиальному строению, допускающему свободную диффузию продуктов. При обычных типах дробления, когда бластомеры с самого начала разгораживаются клеточными мембранами, активация генов осуществляется через посредство трансмембранной сигнализации. Интересно, что даже в яйцеклетке дрозофилы «концентрационный» путь регуляции полос экспрессии, по-видимому, не является единственным. Недавно было обнаружено, что градиент концентрации белка bicoid даже в нормальном развитии (и тем более — в экспериментально измененных условиях) может быть весьма изменчивым, а локализация полос генов группы gap тем не менее весьма точной. Таким образом, должны существовать дополнительные к концентрационным градиентам факторы регуляции, которые пока неизвестны.
В целом участие уровня транскрипции в регуляции клеточной дифференцировки не вызывает сомнений. По-видимому, это один из основных уровней регуляции. Надо только иметь в виду, что дифференциально экспрессируются, как правило, не отдельные гены, а целые группы (блоки) генов. По представлениям некоторых авторов, активность этих блоков («генных сетей», по Кауффману) является самоподдерживающейся.
Будучи один раз активированными, они затем спонтанно поддерживают свою активность на определенном уровне. Этим может быть объяснена высокая устойчивость дифференцированного состояния многих типов клеток.
3. Регуляция в процессе сплайсинга и транспорта мРНК в цитоплазму. Данный уровень регуляции ранее обозначался как посттранскрипционный, поскольку считалось, что он включается лишь после окончания транскрипции. По современным данным, однако, рассматриваемые здесь процессы протекают еще во время самой транскрипции (ко-транскрипционно). Остановимся на двух из них.
— Альтернативный сплайсинг. Как известно, только что транскрибированная молекула мРНК (пре-мРНК) состоит из экзонов и некодирующих «вставок» - интронов. Еще в процессе транскрипции интроны удаляются из новосинтезированной мРНК. Оставшиеся экзоны могут сливаться в различных комбинациях, в результате чего из одной молекулы пре-мРНК может образоваться несколько типов более коротких молекул мРНК, кодирующих различные белки.
Регуляция на уровне альтернативного сплайсинга была показана, например, для первичного транскрипта гена альфа-тропомиозина мыши. Путем различных сшивок он может продуцировать мРНК для гладких скелетных мышц, а также фибробластов и клеток мозга, то есть участвовать в дифференцировке совершенно различных типов клеток. Особенно широко представлен альтернативный сплайсинг у насекомых. В одном (правда, исключительном) случае ген дрозофилы, называемый DSCAM, может кодировать путем сплайсинга 38 ООО различных белков! Альтернативный сплайсинг контролируется макромолекулярным комплексом (так называемой сплайсосомой), состоящей из белков и малых молекул РНК. Некоторые авторы склонны считать данный уровень регуляции едва ли не самым важным.
— Регуляция транспорта мРНК из ядра. Например, у млекопитающих лишь около 5% синтезированной РНК покидает ядро и идет в трансляцию.
4. Уровень трансляции. Даже при одинаковом наборе готовых к трансляции мРНК клетки могут различаться между собой по времени начала (инициации) и по темпу трансляции: иногда трансляция может быть вообще на длительный период времени заблокирована, о чем мы уже знаем на примере зрелой неоплодотворенной яйцеклетки. В этих случаях говорят о регуляции на уровне трансляции.
Устранение блока трансляции после активации яйцеклетки достигается добавлением большого количества адениловых групп на 3-конце молекул мРНК. В дальнейшем по ходу дробления материнская мРНК вступает в трансляцию также не сразу повсеместно, а по определенной пространственно-временной программе. Это характерно, например, для яйцеклеток моллюсков. Фактор, регулирующий скорость трансляции, связан у них с полярной лопастью.
Существенные задержки в начале трансляции уже заготовленных мРНК отмечены также при дифференцировке эритроидных, сперматогенных и других специализированных типов клеток. Известны и обратные примеры: при дифференцировке клеток хрусталика куриного зародыша на 6-е сут. инкубации на 1 молекулу мРНК синтезируется в 5 раз больше соответствующего белка (а-кристаллина), нежели на 19-е сут. развития.
Регуляция на уровне трансляции имеет место в синтезе такой важной биологической молекулы, как гемоглобин. Как известно, каждая молекула гемоглобина состоит из 2 а-глобиновых цепей, 2 бета-глобиновых цепей и 4 относительно небольших молекул гема. Любое отклонение синтеза составных частей гемоглобина от данных соотношений приводит к тяжелым нарушениям.
Правильные количественные соотношения между компонентами гемоглобина регулируются следующим образом. Во-первых, избыток гема ингибирует ключевой фермент, ответственный за его же синтез. Во-вторых, этот же избыток активирует синтез глобинов. Данная активация и осуществляется на уровне трансляции: гем (или его окисленная форма гемин) ингибирует фермент протеинкиназу, который фосфорилирует (и тем самым ингибирует) фактор инициации трансляции глобина. Ингибиция ингибитора означает активацию; таким образом, избыток гема подавляет собственное производство и активирует на уровне трансляции синтез глобина, поддерживая тем самым нормальные соотношения компонентов гемоглобина.
Трансляционная регуляция синтеза гемоглобина имеет еще один аспект. Известно, что в диплоидной клетке имеются 4 активных альфа-глобиновых и только 2 активных бета-глобиновых гема. Если бы каждый ген транскрибировался и транслировался с одинаковой скоростью, то на 1 молекулу бета-глобина приходились бы 2 молекулы а-глобина. Между тем уже отношение концентрации бета:альфа мРНК не 1:2, a 1:1,4, а отношение концентрации самих белков в точности равно 1:1. Совершенно очевидно, что темпы синтеза обоих глобинов регулируются как на уровне транскрипции, так и на уровне трансляции. Регуляция на последней стадии осуществляется, очевидно, в результате конкуренции обеих мРНК за факторы инициации трансляции.
Недавно был открыт новый способ регуляции на уровне трансляции, основанный на так называемой РНК-интерференции. Он действует в ходе развития круглого червя Caenorhabditis elegans. Для нормального развития этого организма необходимо подавлять деление стволовых клеток на определенных стадиях развития — иначе, например, будут возникать «лишние» клетки покровов тела. Подавление происходит ввиду того, что на требуемых стадиях развития благодаря активности определенных генов и последующему сплайсингу возникают короткие молекулы РНК (размером 22 нуклеотида). Они комплементарны тем молекулам мРНК, которые перед этим были вовлечены в трансляцию. Связывание комплементарных молекул (это и есть РНК-интерференция) приводит к подавлению трансляции, а иногда и к деградации перед этим активных мРНК. РНК-интерференция обнаружена также в эмбриональных стволовых клетках мышей. Имеются указания на возможность РНК-интенференции в половой цитоплазме яйцеклетки насекомых.
5. Посттрансляционный уровень. Наконец, трансляция может состояться, но произойдет задержка (возникнет блок) на уровне дальнейших изменений структуры синтезированной белковой молекулы (отщепление фрагментов, изменение третичной структуры (конфор- мации), образование в ряде случаев четвертичной структуры из нескольких субъединиц, различные химические модификации, например добавление фосфорных или углеводных групп (ацети- лирование, фосфорилирование и гликозилирование)) или же на уровне ее «адресации», т.е. поступления в тот участок (отсек) клетки, где она должна функционировать. Это соответствует регуляции дифференцировки на посттрансляционном уровне.
У белков внеклеточного матрикса заключительные этапы посттрансляционной регуляции могут протекать вне клеток. Таковы, например, расщепление молекул предшественника коллагена — проколлагена и их последующая упаковка в правильные фибриллы. В этих процессах участвуют секретируемые в межклеточное пространство энзимы.
Время и место посттрансляционных превращений, как правило, строго определены. Временная задержка посттрансляционных модификаций может быть достаточно большой. Например, фермент тирозиназа появляется у зародышей амфибий еще в раннем эмбриогенезе, но переходит в активную форму лишь после вылупления зародыша. Роль посттрансляционных модификаций в регуляции клеточной дифференцировки изучена еще далеко не достаточно, но можно думать, что она весьма значительна, особенно при формировании надмолекулярной организации клеток.
Дифференцирующими, или дифференциальными, называют такие клеточные деления, которые разделяют материнскую клетку на две неравные дочерние, различающиеся между собой по составу цитоплазмы и, как правило, по величине.
Наличие дифференцирующих и квантальных клеточных делений подразумевает, что клетки зародыша делятся по четкому «расписанию». Уже давно было высказано предположение, что такое расписание и вообще направление клеточной дифференцировки может определяться составом той области цитоплазмы яйцеклетки, куда при дроблении попадает данный бластомер. Такое предположение лежало в основе одной из первых научных теорий клеточной дифференцировки — теории Дриша-Моргана (которая пришла на смену концепции неравнонаследственных делений Вейсмана).
Действительно, цитоплазма яйцеклетки оказывает несомненное воздействие на транскрипционную активность ядер. Лучше всего это показано в ставших уже классическими опытах Дж. Гердона по пересадке ядер дифференцированных клеток в энуклеированные яйцеклетки: в пересаженных ядрах начинается синтез различных видов РНК точно по тому же расписанию, что и в ядрах нормальной дробящейся яйцеклетки.
Известно также, что в яйцеклетках моллюсков вещества, содержащиеся в полярной лопасти, воздействуют на скорость протекания клеточных циклов в бластомерах, и это через ряд промежуточных звеньев может сказываться на транскрипционных процессах и других звеньях управления дифференцировкой.
Несмотря на вышеописанные примеры подчинения дифференцировки клеток «внутреннему расписанию», или ооплазматической сегрегации, основным для многоклеточных животных и растений является иной путь — дифференцировка в ответ на внешние сигналы. Именно такой путь обеспечивает гибкость и тонкую пространственно-временную координацию дифференцировок, без чего невозможно нормальное развитие.
Внешние дифференцирующие сигналы можно грубо разделить на две категории — химические факторы (называемые лигандами) и физические факторы (механические напряжения, температура, свет, электромагнитные поля). Из числа последних ниже обсуждается лишь роль механических напряжений, так как действие других физических факторов пока еще недостаточно изучено.
Рассмотрим химическую сигнализацию. Ее начальное звено — связывание молекулы лиганда с клеточным рецептором. Лиганд может продуцироваться на разной степени удаления от реагирующей клетки. Если расстояние между тканью — продуцентом лиганда — и воспринимающей его клеткой на много порядков превышает клеточный поперечник, то говорят о дистантных взаимодействиях. В этих случаях лиганд переносится с током крови или же путем диффузии по межклеточным пространствам. Классический пример дистантных взаимодействий — влияние гормонов на клетки-мишени. Иногда особо выделяют короткодистантные взаимодействия, когда расстояние между клеткой — продуцентом лиганда и воспринимающими клетками незначительно превышает клеточный поперечник. Такие случаи особенно важны для эмбриологии, поскольку сюда относят действие ньюкуповских и шпемановских индукторов.
Затем принято выделять важную категорию контактных взаимодействий, осуществляющихся между соседними клетками. При таких взаимодействиях лиганд либо диффундирует на короткие расстояния, либо он иммобилизован (встроен в мембрану своей клетки) и может перемещаться (как и рецептор) только вдоль нее. Один из примеров взаимодействий рецептора с иммобилизованным лигандом — взаимодействия эфринов с эфриновыми рецепторами в связи с формированием ретино- тектальной проекции. Заметим, что эти взаимодействия обоюдны, т.е. сигналы поступают не только в клетку-обладателя рецептора, но и в клетку — носителя лиганда.
Наконец, ряд важных дифференцировок (в частности, у клеток мезодермального происхождения) осуществляется в том случае, когда лиганд иммобилизован на компонентах межклеточного матрикса.
Дистантные взаимодействия.
Следует различать два типа лигандов. Молекулы лигандов первого типа в силу своей гидрофобности или же газовой природы свободно проникают через липидные компоненты клеточной мембраны. Сюда относятся:
1. Стероидные гормоны (эстрогены, кортизол и другие);
2. Ретиноевая кислота, играющая важную роль в дифференцировке ряда зачатков (например, конечностей);
3. Окись азота (NО) и активные формы кислорода.
Основная функция стероидных гормонов — связывание с молекулами белков-рецепторов (специфических для каждого типа гормона), которые локализованы либо в цитоплазме, либо в ядре реагирующей клетки. В отсутствие гормона эти белки-рецепторы неактивны, так как они связаны с другим белком — ингибитором. Когда же молекула гормона связывается с белком-рецептором, комплекс последней с ингибитором распадается, и белок-рецептор связывается с участком ДНК, ответственным за транскрипцию данного гена. Гормональная активация гена может протекать очень быстро: так, у дрозофилы уже через 5-10 мин после инъекции стероидного гормона линьки — экдизона — в гигантских политенных хромосомах появляются 6 новых пуфов — транскрипционно активных участков. Синтезированные на них белки индуцируют через некоторое время транскрипционную активность примерно сотни новых участков хромосом, так что в результате реакция на действие гормона во много раз усиливается.
Стероидные гормоны индуцируют синтез всех видов РНК - не только матричной, но рибосомальной и транспортной, поэтому они активируют не только транскрипцию, но и процессы трансляции. Клетки, в цитоплазме (или ядре) которых содержатся рецепторы к данному гормону, называются клетками-мишенями. Например, мишенью для действия эстрогена являются матка, влагалище, грудная железа, гипоталамус; тестостерона — семенные пузырьки, простата, семенник; к гидрокортизону — гормону надпочечника — оказались чувствительны все клетки организма. Весьма важно следующее: в разных клетках-мишенях стероидные гормоны индуцируют различные группы генов, хотя молекулы-рецепторы к данному гормону во всех клетках одни и те же. Следовательно, хроматин различных клеток-мишеней реагирует по-разному на связывание одного и того же молекулярного комплекса «гормон — рецептор».
Ко второму типу лигандов относятся белковые молекулы, которые в цитоплазму не проникают, а связываются с внешней частью клеточных рецепторов или с внеклеточными белками. Наиболее важные из них:
1. Белковые гормоны (инсулин, адренокортикотропный гормон соматотропин, эритропоэтин);
2. Ростовые факторы, стимулирующие клеточное размножение (факторы роста фибробластов, нервных клеток, опухолевых клеток и др.);
3. Факторы ньюкуповской и шпемановской эмбриональной индукции.
В ответ на связывание лигандов с внешней частью мембранных рецепторов в реагирующей клетке запускается каскад реакций, в которых могут участвовать так называемые вторичные посредники (циклическая аденозинмонофосфорная кислота — цАМФ, циклическая гуанозинмонофосфорная кислота — цГМФ, или Са2+). Они в свою очередь активируют протеинкиназы — энзимы, переносящие фосфатную группу с молекулы АТФ на белки. В основе передачи сигнала от комплекса лиганд-мембранный рецептор до генорегуляторных белков, связанных с ДНК,лежит, как правило, именно каскад фосфорилирования: фосфорилированный белок становится протеинкиназой для следующей молекулы белка, и так далее. В конце концов происходит фосфорилирование генорегуляторных белков, после чего они оказываются способными активировать определенные гены.
Дата добавления: 2018-05-09; просмотров: 614; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
