Гаструляция и формирование основных закладок органов у позвоночных животных: описание и
Результаты экспериментального анализа
Способы гаструляции: деламинация, иммиграция, эпиболия, инвагинация и различные их
сочетания. Типы гаструл. Способы закладки мезодермы. Осевая мезодерма и ее дальнейшая дифференцировка: боковая пластинка.
Нейруляция у зародышей амфибий. Морфогенетические движения при гаструляции и
нейруляции амфибий. Интеркаляция и конвергенция клеток. Карты презумптивных зачатков. Гетерономная метамерия.
Сегментация мезодермы и генетический контроль (гомеозисные гены).
После того, как зародыш достиг стадии бластулы, в нем начинаются интенсивные передвижения отдельных клеток и обширных участков стенки бластулы, приводящие к тому, что зародыш расчленяентся на два или три слоя, которые называются зародышевыми листками. Самый внутренний слой называется энтодермой(2), внешний - эктодермой(1). Эти листки имеются у всех животных. Лишь у губок дальнейшая судьба листков настолько необычна, что понятие экто- и энтодермы к ним не применяют. У всех животных, кроме губок и кишечнополостных, формируется еще и средний зародышевый листок - мезодерма. Процесс разделения зародыша на зародышевые листки называется гаструляцией, а сам зародыш на этой стадии - гаструлой.
Способы гаструляции разнообразны и отчасти связаны со строением бластулы.
Иммиграционныйтип гаструляции встречается у кишечнополостных. Этот процесс сводится к вселению в полость бластоцеля отдельных клеток, выклинивающихся из стенки бластулы. Когда процесс происходит по всей поверхности бластулы, говорят о мультиполярной иммиграции. Чаще выселение происходит с одного определенного полюса - униполярнаяиммиграция. Известна также биполярнаяиммиграция, когда выселение идет с двух противоположных полюсов.
|
|
|
У кишечнополостных, где дробление заканчивается морулой без полости, наблюдается другой тип гаструляции, который получил название деламинация (расслоение). В данном случае происходит выравнивание внутренних стенок клеток наружного слоя. Далее вдоль выровненных поверхностей формируется базальная мембрана, отделяющая внешний слой эктодермы от внетренней массы клеток энтодермы. Таким образом, при деламинации клеточные перемещения практически отсутствуют.
В целом процесс гаструляции приобретает в ходе эволюции более организованных характер и осуществляется обычно путем инвагинации. В этих случаях внутрь бластоцеля входят не отдельные клетки, а клеточный пласт, не утративший эпителиальной структуры. Полость вворачивания называется гастроцелем, а ведущее в нее отверстие - бластопором (первичным ртом). Края бластопора называются его губами.
|
|
|
Так как при инвагинации механическая целостность стенки бластулы не нарушается, вворачивание дна бластулы должно сопровождаться смещением клеточного материала боковых стенок. Такие движения всегда происходят, и скорость их, как правило, не меньше скорости вворачивания. Движения слоя, который в данный момент еще находится на поверхности гаструлы, называют эпиболией (обрастанием).
В соответствии с тем типом движения, в результате которого образовалась гаструла, выделяют несколько типов гаструл:
1. инвагинационная 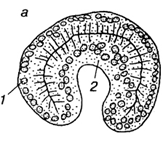
2. иммиграционнная 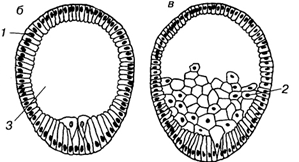
3.деламинационная 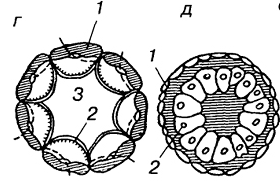
4. эпиболическая 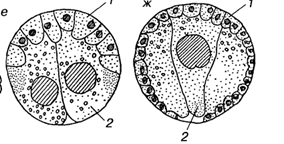
Материал, оставшийся на поверхности зародыша после завершения гаструляции - эктодерма. Погрузившийся внутрь листок лишь у кишечнополостных представляет собой чистую энтодерму. У всех вышестоящих систематических групп погрузившийся внутоб материал содержит кроме энтодермы еще и материал мезодермы.
Выделяют следующие типы закладки мезодермы:
ñ Телобластический(А), встречается у спирально дробящихся форм. В процессе дробления обособляются две крупные клетки, расположенные в полости бластоцеля в области губ бластопора. Они дают начало всей целомической мезодерме личинки. эти бластомеры называются мезобластами или мезотелобластами. Более мелкие мезодермальные клетки отпочковываются от этих крупных бластомеров. В результате возникает пара мезодермальных полосок, которые затем подразделяются на парные сомиты. Внутри сомитов путем расхождения клеток образуются участки вторичной полости тела - целома. Способ образования полостей путем расхождения клеток называется шизоцелевым, или кавитационным. В данном случае мезодерма никак не связана с энтодермой, образующейся из других бластомеров.
|
|
|
ñ Принципиально другой - энтероцельный (Б) - способ закладки мезодермы наблюдается у иглокожих и ланцетника. В данном случае материал будущей мезодермы вворачивается вместе с энтодермой в составе гастрального впячивания, которое называется первичным кишечником или архентероном. Мезодерма выделяется из архентерона путем выпячивания его стенок и отшнуровки возникших выпячиваний.
ñ Если мезодерма выделяется из архентерона путем деламинации, то выделяют деламинационный(В)тип закладки мезодермы.
ñ иммиграционный(Г)тип выделяют в том случае, когда мезодерма отделяется от архентерона путем иммиграции.
|
|
|
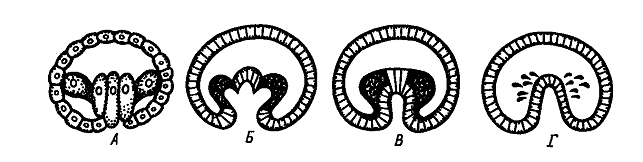
После отделения мезодермы, в составе стенки архентерона остается уже только энтодермальный материал, и архентерон превращается в полость вторичной (дефинитивной) кишки.
Как и полость сомитов первичноротых, полость отшнуровавшихся мезодермальных пузырьков называется целомом.
Особый способ закладки мезодермы в ходе гаструляции описан у пресмыкающихся, птиц и млекопитающих. Он заключается в миграции клеток первичной эктодермы через утолщение - первичную полоску и последующем их погружении (инвагинации) под эктодерму. У млекопитающих это происходит путем перемещения (иммиграция) клеток в области дна амниотического пузырька (первичная эктодерма) по направлению спереди назад, к центру и вглубь в результате размножения клеток. При этом образуется первичная полоска - источник формирования мезодермы. В головном конце первичная полоска утолщается, образуя первичный, или головной узелок, откуда берет свое
начало головной отросток - хорда, являющаяся основанием для формирования осевого скелета. Клеточный материал, выселяемый из первичной полоски, располагается в виде мезодермальных крыльев парахордально. В результате зародыш приобретает трехслойное строение в виде плоского диска, состоящего из эктодермы, мезодермы и энтодермы.
Гаструляция амфибий - комплексный процесс. Основными его компонентами принято считать эпиболию и инвагинацию, которые дополняются процессами иммиграции и деламинации. На вегетативном полюсе распологаются крупные, богатые желтком макромеры. Поэтому там не может возникнуть обширное впячивание. Но некоторые макромеры все же погружаются внутрь зародыша. Эти движения иммиграционного типа называются предгаструляционными. Они приволят к сокращению вегетативной зоны на поверхности зародыша и к увеличению анимальной зоны. Такой процесс можно рассматривать как первую фазу эпиболии.
Собственно гаструляция начинается в области серого серпа. Сначала возникает выровненная линия клеток, проходящая чуть вегетативнее границ анимального и вегетативного полушарий, а затем по этой линии образуется узкая, идущая вглубь щель - зачаток бластопора. Щелевидное впячивание углубляется, вовлекает в себя новые клетки поверхности зародыша и принимает вид серповидной бороздки. Область бороздки, расположенная непосредственно анимальнее бороздки, разывается дорсальной губой бластопора. Полость щелевидной бороздки расширяется и превращается в полость первичной кишки. Другое название этой полости - гастроцель.
Дальнейший ход гаструляции связан с подворачиванием клеточного материала через дорсаольную губу бластопора. При этом клетки анимальных районов смещаются в вегетативном направлении, и подвернувшись через ДГБ образуют дорсальную выстилку архентерона. Таким образом, клеточный состав ДГБ непрерывно обновляется. Данные движения представляют собой продолжение движения эпиболии, основой которой является интеркаляция клеток, то есть их "вставление" друг между друга. При этом происходит утрата прежних межклеточных контактов и установление новых. Выделяют два различных типа интеркаляции.
Интеркаляция первого типа называется радиальной. Она протекает с самого начала гаструляции вдоль всей крыши бластоцеля. При этом число клеточных слоев уменьшается, а общая площадь поверхности крыши бластоцеля увеличивается. При этом увеличение происходит изотропно, то есть равномерно во всех напрвлениях. Данный процесс ответственен за начальную стадию эпиболии.
 →
→ 
У хвостатых амфибий, где крыша бластулы состоит из одного слоя клеток, аналогом радиальной интеркаляции является радиальное уплощение клеток.
С начала видимой гаструляциии в области ДГБ начинает действовать второй типа интеркаляции - планарная конвергентнаяинтеркаляция. При этом клетки начинают двигаться в плоскости поверхности зародыша, то есть планарно, во встречных направлениях. Такой процесс приводит к сильному неравномерному растяжению области ДГБ, которая становится спинной стороной тела будущего животного. Именно благодаря этому процессу формируется продольная ось тела позвоночных животных и весь комплкекс осевых органов
 →
→ 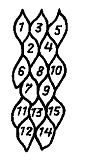
Далее бластопор продолжает расти в стороны, охватывая вегетативную зону сначала полукольцом, а потом и полным кольцом. Заключенный внутри кольцевидного бластопора светлый вегетативный материал называется желточной пробкой. В кольцевидном бластопоре кроме дорсальной, уже различают вентральную и боковые губы.
Ввернувшийся внутрь клеточный материал постепенно оттесняет бластоцель в вентральном направлении. Это движение называют инвагинацией.
Самая ранняя стадия инвагинации связана с вознокновением колбовидных клеток с узкими апикальными "шейками" и удлиненными раздутыми телами. Впячивание бластопора закладывается благодаря активному сужению этих "шеек".
При дальшейшей инвагинации решающее значение имеют следующие поцессы:
ñ Клетки вершины гастрального впячивания активно ползут по стенке бластоцеля, выбрасывая длинные отростки.
ñ Клетки внутренних слоев ДГБ при подворачивании резко меняют свою структуру и характер контактов: до подворачивания они представляют собой довльно плотно скрепленные столбчатые клетки эпителиального характера. В процессе подворачиваются они ошариваются и почти не контактируют друг с другом. Клеточные слои рассыпаются на отдельные клетки. Впоследствии контакты между клетками восстанавливаются.
ñ По мере вворачивания дорасльная губа бластопора смещается в вегетативном направлении. Такое смещение связано с тем, что скорость эпиболии превышает скорость подворачивания клеток через ДГБ. В том же направлении, к вегетативному полюсу, удлиняется деламинационная борозда, разграничивающая ввернувшийся и неввернувшийся материал.
То, какое положение займут различные районы бластулы после завершения гаструляции и какова их окончательная судьба, можно определить, нанося на поверхность бластулы метки и прослеживая движение меток в ходе гаструляции. Результаты исследования выражают, отмечая на схеме бластулы или ранней гаструлы судьбу каждой точки. Эти схемы названы картами презумптивных зачатков. Первым такие карты составил немецкий эмбриолог В.Фохт в 20-хх годах прошлого столетия.
По Фохту (рисунок со штриховкой), перед началом гаструляции все закладки зародыша выходят на поверхность. Сразу анимальнее щелевидной борозки бластопора располагается зачаток прехордальной пластинки (9), из которой развивается выстилка ротовой полости. Анимальнее прехордальной пластинки располагается зачаток будущей хорды (1). Дорсоанимальную часть занимает презумптивная эктодерма нервной системы - нейроэктодерма (8), а ветнроанимальную часть - эктодерма покровов тела (2). Между ними располагается метериал нервных валиков (7).
Вегетативнее их располагаются последовательно: материал осевой мезодермы, идущий на образование туловищных и хвостовых сомитов(5,6), боковой пластинки (4) - несегментированная часть мезодермы, и энтодермы (3). Прехордальная пластинка, хорда, мезодерма и энтодерма погружаются внурть зародыша.
В последние годы карты презумптивных зачатков для зародышей амфибий подверглись исправлениям и дополнениям. Установлено, что у бесхвостых амфибий (в отличие от хвостатых) материалы хорды, осевой мезодермы и боковой пластинки расположены во внутренних слоях стенки зародыша и не выходят на его поверхность, которая представлена в анимальной части зародыша тонким слоем эпиэктодермы (внешней эктодермы). При инвагинации через ДГБ бластопора именно ввернувшийся материал эпиэктодермы образует выстилку гастральной полости. Этот материал называется гипохордой. Благодаря наличию гипохорды у бесхвостых амфибий материал хорды и будущих сомитов ни на одной стадии развития не граничит с гастральной полостью, поэтому в данном случае она не является архентероном.
В ходе исследований было обнаружено три независимых друг от друга источника образования кровяных клеток (на новой карте презумптивных зачатков они отмечены крестиками). Один из них расположен вентральной мезодерме. Второй располагается в области прехордальной пластинки. Третий находится в области эктодермы глотки. При чем после завершения гаструляции последние два практически полностью объединяются.
 |

Следует подчеркнуть, что карты презумптивных зачатков дают сведения о судьбе отдельных участков зародыша лишь в его нормальном развитии и ничего не говорят о том, может ли судьба клеток быть переопределена при их перемещении в другое положение.
Движения гаструляции у зародышей позвоночных без существенного перерыва переходят в движения, связанные с нейруляцией - закладкой центральной нервной системы. На этой стадии формируется комплекс осевых структур. Зародыш в период нейруляции называется нейрулой.
В целом эти движения состоят в конвергентном(сходящемся) смещении материала эктодермы и мезодермы к средней линии спинной стороны зародыша (вентродорсальные движения). Происходит также растяжение дорсальной эктодермы зародыша в передне-заднем направлении.
Сначала нейральная эктодерма уплощается и превращается в нервную пластинку, которая в головной части зародыша шире, чем в туловищной. Края пластинки приподнимаются и образуют нервные валики, окаймляющие пластинку. Затем поверхность нервной пластинки начинет довольно сильно сокращаться в поперечном направдении. Одновременно она начинает складываться по средней линии. Возникающее углубление нервной пластинка называется нервным желобом. Еще чуть позже края неврной пластинки смыкаются и образуется нервная трубка, полость внутри которой называют невроцелем. Передняя расширенная часть трубки превращается в головной мозг, а ее невроцель - в полость мозгового пузыря. Более узкая туловищная часть трубки превращается в спинной мозг, а его полость - в спинномозговой канал.
Само формирование нервной пластинки происходит путем кооперативной поляризации клеток дорсальной эктодермы: клетки сильно вытягиваются в апико-базальном направлении, а их апикальные стенки сокращаются. Этот процесс начинается от дорсо-медиальной линии зародыша и распространяется в стороны (латерально), что приводит к скошенности клеток в сторону дорсо-медиальной линии. Образуется клеточный веер. На этой стадии нерная пластинка почти плоская. Ее последующее скручивание вызывается спрямлением скошенных клеток.
Описанная последовательность процессов типична не только для нейруляции, но и для всех других случаев образования органов из эпителиальных пластов (формирование хрусталика, органов слуха, обоняния, желез пищеварительной системы и т.д.).
Во всех этих процессах участвует как цитоскелет, так и клеточная мембрана. При этом их активность тесно скоординирована.
После смыкания нервного желобка в нервную трубку, материал нервных валиков, расположенный сначала по периферии нервной пластинки, концентрируется вдоль средней линии зародыша, дорсальнее нервной трубки - образуется нервный гребень. Клетки нервного гребня не входят в состав ЦНС, они дают множесто производных (периферическая НС, пигментные клетки).
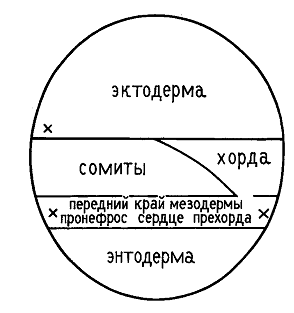
В начале скручивания нервной пластинки в трубку из осевой мезодермы по средней (сагиттальной) линии зародыша формируется хорда, которая располагается под туловищной частью нервной трубки. Спереди от хорды находится прехордальная пластинка.
Сразу латеральнее материала хорды располагается мезодерма будущих сомитов, которая плавно переходит в мезодерму боковой пластинки. Внутри зачатков сомитов возникает полость, переходящая в узкую щель, разделяющую боковую пластинку на два листка: париетальный (прилежит к эктодерма) и висцеральный (прилежит к энтодерме). Внутренняя полость и щель формируют вторичную полость тела - целом.
Вскоре после обособления хорды, начинается метамеризация осевой мезодермы, то есть ее разделение на парные сегменты - сомиты. Метамеризация мезодемы идет в направлении спереди назад. Механизмы метамеризации у разных позвоночных различны. У бесхвостых амфибий клетки осевой мезодермы поворачиваются на 90°, изменяя первоначальную ориентацию на продольную.
У хвостатых амфибий формирование сомитов связано с группированием мезодермальных клеток в "розетки". У зародышей птиц происходит образование веерообразных структур, сходных с розетками, которые постепенно достраиваются до полного сомита.
Фактором, влияющим на движения и изменения формы отдельных клеток при гаструляции и нейруляции, являются механические напряжения в тканях зародыша.
Они имеют два основных источника: первый - тургорное давление в бластоцеле. Оно обусловливает равномерное растяжение крыши бластоцеля. Второй источник - клеточные движения. Например, инвагинация вокруг ДГБ вызывает растяжение в этой области в передне-заднем направлении и ее сжатие в поперечном направлении. При этом возникает градиент механических напряжений с наивысшей точкой около бластопора.
Определенными методами можно составить карты механических натяжений для периодов гаструляции и нейруляции. Нарушение этих закономерных и стадиоспецифичных механических напряжений приводит к глубоким нарушениями структуры зачатков и точности их взаимного расположения.
Явление гетерономной метамериизаключается в том, что метамеры, сохраняя общий план строения, дифференцируются в различных направлениях, при этом теряют внешнее сходство (например, у членистоногих). При гомономной метамерии все метамеры, образовавшиеся в ходе сегментации развиваются одинаково. Так, например, у кольчатых червей.
Генетический контроль нейруляйции.Исследования подтвердили сходство этого этапа развитися у всех метамерно построенных животных. Были найдены и изучены высокогомологичные генетические конструкции, общие для представителей самых удаленных неродственных таксонов, с функцией которых связывают реализацию плана строения. Гены-регуляторы сегментации имеют общие черты: у всех них отмечена высокогомологичная последовательность ДНК размером в 183 пары оснований, названнаягомеобоксом. Гомеобокссодержащие гены независимо от сегментации участвуют в передаче позиционной информации - информации о специфической дифференцировки клеток, соответствующей их месторасположению в организме. 60-аминокислотный полипептид, кодируемый гомеобоксом называется гомеодоменом. У беспозвоночных генам гомеобокса присвоена аббревиатура Hom, у хордовых Hox.
Гены сегментации собраны в кластер. Структура кластера и алгоритм экспрессии генов в нем преформируют структуру и план посегментного строения организма. Такое соответствие генетической и морфологической организации называется коллинеарностью.
Все гены, регулирующие сегментацию, характеризуются ранней посегментной транскрипцией, и их работа ограничена во времени и пространстве. Т.е. они активны в местах будущих сегментов и далее в самих сегментах в период раннего эмбриогенеза.
В результате сделаны следующие выводы:
ñ Гены гомеобокса представляют собой группу генов-регуляторов раннего эмбрионального развития, чье функционирование реализуется в определенной иерархической последовательности.
ñ Эволючионная история этих генов восходит к прокариотам. Их функция состоит в обеспечении клеточных ядер зародыга начальными сигналами дифференцировки.
ñ В ходе эволюции функции этих генов могли меняться.
ñ Механизмы развития эволюционно различающихся животных гораздо более универсальны, чем полагали ранее.
Обращают внимание на три параметра гена: время "включения", место локализации и значение гена в онтогенезе (оно тем больше, чем раньше гены начинают работать).
Отношения между генами укладываются в следующие рамки:
ñ независимое действие
ñ "включение - выключение" одних генов другими
ñ сложная иерархическая сеть отношений, в которой возможно как прямое, так и опосредованное действие одних генов на другие.
Раньше других в реализации плана строения в развитии начинают работать материнские гены. Они осуществляют переднезаднюю полярность яйца в оогенезе. Это гены bicoid, необходимые для формирования передних структур, гены oscar - для формирования задних структур и ген torso. Эти же гены влияют на сегментацию. Они создают рисунок химических различий цитоплазмы в начале дробления, который затем претворяется в саму сегментацию. Эти различия воздействуют на активность генов следующего уровня регуляции сегментации - генов GAP и Pair-rule. Гены GAP включают материнские и зиготические гены. Среди них выделяют восемь генов, экспрессирующихся в оогенезе; пять генов, экспрессирующихся после оплодотворения, из которых три собственно зиготические (hunchback - hb, Kruppel - kr, knirs - kni). Мутация любого их этих генов зачеркивает сегментацию в подконтрольном ему районе.
Гены GAP контролируют метамеризацию, осуществляемую генами Pair-rule, но влияют и на гомеотические гены (гены гомеозиса), осуществляющие индивидуальную идентификацию сегментов.
Гены Pair-rule транскрибируются на стадии синцитиальной бластулы. Большинство этих генов назодится во взаимодействии с геном fushi tarazu (ftz). Этот ген имеет гомеобокс и является геном сегментации. Его транскрипция идет на стадии бластодермы и по расположению транскрипта претворяется в паттерн из семи поперечных полос еще до формирования клеточных мембран.
Заметнее всего метамеризацию определяет ген engralaid (en), отнесенный к группе Pair-rule. Его экспрессия приводит к образованию 15 рядов клеток (парасегментов) внутри зародышевой полоски, из которой развивается большая часть зародыша. Дальнейшая метамериация выражает активность гомеотических генов - генов гомеозиса.
Таким образом, в ходе сегментации первыми нчинают действовать гены материнского эффекта, чей транскрипт накапливается в оогенезе (bicoid, oscat, torso). Следующий уровень - гены GAP и Pair-rule. Последними работают гомеотические гены (гены гомеозиса), определяющие структуру парасегментов. Активность генов предыдущего уровня определяет работу следующего.
Полагают, что эволюция хордовых шла путем дупликации генов Hox. Так, у ланцетника имеется один инсулиноподобный ген, которому гомологичны три гена у млекопитающих.
У беспозвоночных эволюция шла путем изменения гомеобокссодержащих генов посредством тандемных дупликаций.
Понятие "гомеозис"ввел У.Бетсон в 1894г. Под гомеозисом он понимал способность одних сегментов, на которые разделен организм, приобретать признаки, свойственные другим.
Сегментация характеризуется количеством сегментов и их качетсвенными особенностями. Количество сегментов определяется сегрегационными генами, мутации которых нарушают переднезаднюю полярность сегментов, вызывают их слияние, уменьшение количества сегментов и образование нежизнеспособных уродов.
Качественные особенности сегментов контролируют гомеозисные гены, которые подразделяют на два комплекса: Antennapedia-Complex (ANT-C) и Bithorax-Complex (BX-C). ANT-C-гены контролируют развитие головных и передних грудных сегментов.
BX-C состоит из трех субкомплексов: Ubx, контролирующего сегменты груди, и субкомплексов abdomen-A и abdomen-B, контролирующих развитие брюшных сегментов.
Для генов субкомплекса Ubx характерны три особенности:
ñ Они собраны в кластер в небольшом участке 3-й хромосомы. В кластер входят следующие гены: bithorax (a), (bx); contrabithorax (b), (cbx); ultrabithorax (c) (ubx); bithoraxoid (d) (bxd); postbithorax (e) (pbx).
ñ Для них характерен цис-транс эффект, который проявляется в зависимости действия двух мутантных генов одной особи от положения в двух родительских хромосомах.

ñ Полярность проявления означает, что аллели дикого типа, лежащие справа от мутантного локуса, инактивируются, а их рецессивная мутантная аллель обнаруживает свое действие.
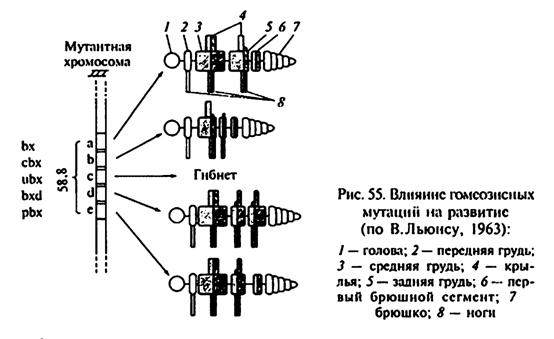
По гипотезе Э.Льюиса:
4. Сходство серии мутантов bithorax с опероном бакретий.
5. Предположение, что аллели дикого типа продуцируют морфогены, а мутанты - нет. Это означает что продукт трансляции гена подавляет потенцию развития сегмента по типу предыдущего сегмента. То есть, регуляция качественного развития метамеров гомеозисными генами состоит в том, что от предыдущего сегмента к последующему эти гены меняют формообразовательные потенции. Поэтому при мутации последующий сегмент проявляет потенции предыдущего.
6. Эмбриональная регуляция. Закон Дриша и "позиционная информация".
Эмбриональная регуляция. Закон Дриша и "позиционная информация".
В 1891 г. Г.Дриш открыл явление эмбриональных регуляций, отделяя друг от друга 2 бластомера яйцеклетки морского ежа. Сначала каждый из бластомеров образовывал половину бластулы, открытую с одной стороны. Затем каждая из них замыкалась в шар и из каждой получался целый зародыш. То есть некоторая часть зародыша может дать целостный организм нормальной структуры. Эмбриональная регуляция или «дришевские регуляции» - это восстановление нормальной, геометрически правильной и полной структуры организма, несмотря на удаление, добавление или перемешивание части материала зародыша.
Из этого следует:
1. Дришевские регуляции возможны лишь при наличие мультипотентности клеток зародыша.
2. В норме каждая часть зародыша принимает только одно значение из всего имеющегося набора потенций, т.е. детерминирует свою судьбу.
Из наличия эмбриональных регуляций следует закон Дриша: динамика развития каждой части зародыша зависит от ее места в целостном организме. Можно нанести на зародыша координатные сетки. Меридианы идут от вегетативного к анимальному полюсу, широты – от дорсального к вентральному. Регуляция заключается в том, что клетки находящиеся в определенном положении в такой системе координат, приобретут одно и то же значение, вне зависимости от их внутренних свойств, внешних условий или временного фактора.
Л.Вольперт предложил истолкование закона Дриша – концепцию «позиционной информации». Она состоит в том, что каждая клетка еще до видимой дифференцировки зародыша независимо от соседей получает информацию о своем положении в зародыше и затем на основании этих данных дифференцируется в том или ином направлении. Такая информация может задаваться концентрацией в данной точки некоего морфогена или соотношением концентраций нескольких морфогенов. Противоречие этой теории в том, что многие клетки обладают до определенной стадии развития зародыша мультипотентностью, ее путь дифференцировки жестко не определен, значит морфогены должны подаваться порциями и не могут присутствовать в данной точке изначально. С точки зрения концепции ПИ невозможно объяснить некоторые дришевские регуляции (например, образование нормального зародыша из 4 бластомеров, взятых от разных зародышей).
Концепция морфогенетических полей, напротив, утверждает, что все компоненты зародыша координируют поведение друг друга. (Каждая клетка вступает в дифференцировку на основании сигналов от ближних и дальних соседей).
К недришевским регуляциям относятся регуляции путем сортировки. При перемешивании клеток разных зародышевых листков клетки через некоторое время кооперируются таким образом, чтобы разграничить клеточную массу на однородные структуры (клетки эктодермы будут соединяться с подобными себе, мезодермальные – с мезодермальными, что приведет к образованию зародышевых листков). Явления данного типа основаны не на изменении презумптивных значений клеток согласно их новому положению, а, напротив, на сохранении каждым типом клеток исходных свойств. Такая сортировка объясняется тем, что клетки лучше контактируют с себе подобными за счет гомологичных связей, образующихся с помощью специфических молекул адгезии, различающихся у разных типов клеток.
Эмбриональная индукция и ее этапы в раннем развитии амфибий. Индукция нейральных закладок хордомезодермой (первичная индукция по Г. Шпеману). Индукция мезодермы (П. Ньюкуп). Тангенциальная индукция. Современные представления о молекулярных механизмах индукционных процессов.
Развитие представляет собой последовательность процессов:
1. образование переднезадней оси и радиальной симметрии на стадии оогенеза
2. формирование билатеральной симметрии вследствие поворота оплодотворения и образования серого серпа
3. закладка ньюкуповского центра организации во время дробления (стадия средней бластулы)
4. образование шпемановского индуктора (стадия поздней бластулы)
5. индукция гаструляции и нейруляции
Эмбриональная индукция – воздействие одной части зародыша (индуктора) на другую, реагирующую часть, в результате которого последняя изменяет направление своего морфогенеза и дифференцировки. В зародышах амфибий первой по времени (стадия средней-поздней бластулы) является Ньюкуповская индукция мезодермы энтодермой. Ньюкуп удалял у зародышей тритона зону, лежащую анимальнее энтодермы, которая при нормальном развитии становится мезодермой. После удаления он сшивал зону, лежащую выше удаленной, с энтодермой (из нее в норме образуется только эктодерма). Но из прилежащих к энтодерме участков развилась мезодерма. Было показано, что ндукционное действие энтодермы обладает дорсо-вентральной специфичностью: дорсальная энтодерма индуцирует дорсальную (осевую) мезодерму, вентральная энтодерма – боковую (латеральную) пластинку и ее производные.
Следующий этап индукционных процессов – индукция нейральной ткани из эмбриональной эктодермы под воздействием подстилающей хордомезодермы (дорсальной губы бластопора). Это был первый экспериментально обнаруженный факт индукционных взаимодействий (Г. Шпеман, Г. Мангольд, 1921), поэтому часто это явление называют первичной эмбриональной индукцией. хотя она следует за ньюкуповской. Мангольд вырезала кусочек ткани из дорсальной губы бластопора гаструлы гребенчатого тритона (Triturus cristatus) со слабопигментированным зародышем, и пересадила ее в вентральную область другой гаструлы близкого вида, тритона обыкновенного (T. vulgaris), зародыш которого характеризуется обильной пигментацией. Эта естественная разница в пигментации позволила различить в химерном зародыше ткани донора и реципиента. Клетки дорсальной губы при нормальном развитии образуют хорду и мезодермальные сомиты (миотомы). После пересадки у гаструлы-реципиента из тканей трансплантата развивалась вторая хорда и миотомы. Над ними из эктодермы реципиента возникала новая дополнительная нервная трубка. В итоге это привело к образованию осевого комплекса органов второго головастика на том же зародыше.
В ходе дальнейших экспериментов было установлено, что организатор не обязательно должен быть живыми клетками, да и прямой контакт между ним и реагирующей тканью не обязателен. Из этого следует, что индукция опосредуется действием каких-то химических соединений. Оказалось, что спектр в-в, обладающих таким воздействием, очень широк (ксенотрансплантанты, ткани печени и др. органов, неорг. в-ва и пр.). Встречались и случаи самоиндукции. В конце концов была выявлена белковая природа индукторов. Сочетание градиентов таких белковых факторов ведет к проявлению всего многообразия дифференцировок.
Процессы эмбриональной индукции представляют собой каскад активации или репрессии генов продуктами экспрессии других генов.
Около вегетативного полюса в период оогенеза синтезируется фосфорпротеин disheveled, который перемещается на дорсальную сторону при повороте оплодотворения. По всей цитоплазме диффузно распределен β-катенин, который вскоре после оплодотворения начинает расщепляться везде, кроме дорсальной стороны, где активность расщепляющего фермента подавлена белком disheveled. β-катенин явл. фактором ньюкуповской индукции. Он связывается с промоторами некоторых генов, таких как nodal (определяет лево-правую симметрию) и siamosis. Они начинают экспрессироваться. Продукт гена siamosis, взаимодействуя с белками семейства, активируют белок goosecoid, который содержится в ядрах клеток шпемановского организатора. Т.о., ньюкуповская и шпемановская индукции – не независимые события. goosecoid активирует гены, являющиеся непосредственными факторами шпемановской индукции – chordin и noggin. Они связывают молекулы BMP, белков семейства TGF – β. Когда BMP находятся в свободном состоянии, они связываются с мембранными рецепторами клеток, что не позволяет им развиваться в нейральные или осевые структуры. Когда BPM связан chordin и noggin, такое развитие становится возможным.
Понятие компетенции эмбриональной закладки, ее роль в определении ответа на индукционное воздействие.
Способность эмбриональных тканей отвечать на действие индуктора – компетенция. Она может меняться в зависимости от возраста закладки (например, в экспериментах презумптивная покровная эктодерма на стадии ранней гаструлы отвечает на действие Шпемановского организатора лучше всего, к стадии поздней гаструлы ответ исчезает).
Реагирующие ткани могут видоизменять поступающие к ним сигналы. Это было впервые показано опытным путем в эксперименте Г.Шпемана и Шоттэ, посвященном изучению индукционных взаимодействий при образовании ротовых структур у бесхвостых и хвостатых амфибий (у хвостатых это балансеры, нитевидные выросты, у бесхвостых – роговые зубчики). Эти структуры могут возникнуть из любого участка вентральной эктодермы, если этот участок будет пересажен в ротовую область. Индуктором является стенка эмбриональной глотки. Вентральную эктодерму лягушки подсаживали в рот к тритону. Участок эктодермы лягушки под воздействием индуктора тритона построил ротовые органы лягушки. Когда тритона с лягушкой «поменяли ролями», результат оказался аналогичным – индукция глоткой лягушки вызвала в тканях тритона развитие ротовых структур именно тритона. Это означает, что ткань, подвергнутая индукции может интерпретировать сигнал. Эта способность входит в понятие компетенции. Индукторы часто являются лишь триггерами, пусковыми механизмами, для тканей, имеющих готовую систему молекулярных и надмолекулярных структур, способных осуществить сложный сигнальный каскад, необходимый для той или иной дифференцировки или перестройки.
Однако иногда возникающие под воздействием искусственных индукторов структуры не имеют нормального строения. Значит, индукции недостаточно для правильной организации закладки. Индукторы осуществляют только эвокацию (побуждение к процессу), а индивидуация (образование пространственного порядка) осуществляется другими факторами. По одной из версий, индивидуация регулируется градиентами концентрации индукционных факторов. Соотношение концентраций нескольких факторов будет определять, какой из зачатков возникнет в каждой области. Но направление и возможность дифференцировок, структурная организация во многом также зависит от межклеточных взаимодействий, механических напряжений, геометрии клеточных групп и т.д..
Дата добавления: 2018-05-09; просмотров: 1033; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
