Глава 14. БУДОВА ТА ЗАПОВНЕННЯ ОБОЛОНОК СКЛАДНИХ АТОМІВ. ТЕОРІЯ ПЕРІОДИЧНОЇ СИСТЕМИ ЕЛЕМЕНТІВ
Д.І. МЕНДЕЛЄЄВА
Послідовність заповнення електронних
Оболонок атомів
Видатний російський учений Д.І. Менделєєв (1834-1907), почесний професор (1880 р.) Київського університету св. Володимира емпірично відкрив періодичну залежність зміни властивостей елементів від їх атомної ваги. Ці властивості надзвичайно красиво наводяться у вигляді таблиці елементів Д.І. Менделєєва (рис.14.1).
Усі відомі елементи утворюють 8 вертикальних стовпчиків – груп елементів. Номер групи відповідає найвищій позитивній валентності елемента. Групи складаються з двох а і б підгруп. Наприклад, а-підгрупа лужних металів і б-підгрупа  і
і  або а–підгрупа
або а–підгрупа 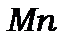 і б-підгрупа галогенів. Елементи однієї підгрупи мають подібні властивості, але у залежності від того, у якій підгрупі вони знаходяться по різному змінюють свої властивості при збільшенні атомного номера
і б-підгрупа галогенів. Елементи однієї підгрупи мають подібні властивості, але у залежності від того, у якій підгрупі вони знаходяться по різному змінюють свої властивості при збільшенні атомного номера  . Так у а-підгрупі збільшення
. Так у а-підгрупі збільшення  супроводжується збільшенням хімічної активності елементів, тоді як у б-підгрупі - навпаки зменшенням. Горизонтальні рядки таблиці називаються періодами й позначаються арабськими цифрами. Всередині кожного періоду спостерігається плавна зміна властивостей від активних металів до неметалів і інертних газів. У періодах, починаючи з 6-го, знаходяться близькі за властивостями групи з 14 елементів, які називаються лантаноїдами
супроводжується збільшенням хімічної активності елементів, тоді як у б-підгрупі - навпаки зменшенням. Горизонтальні рядки таблиці називаються періодами й позначаються арабськими цифрами. Всередині кожного періоду спостерігається плавна зміна властивостей від активних металів до неметалів і інертних газів. У періодах, починаючи з 6-го, знаходяться близькі за властивостями групи з 14 елементів, які називаються лантаноїдами  і актиноїдами
і актиноїдами 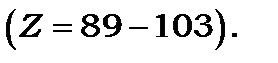
З розвитком атомної фізики стали відомі факти, які свідчать, що властивості атомів залежать від кількості електронів у його складі і їх розподілу між окремими оболонками атомів:
|
|
|
· атомний номер  у періодичній системі елементів характеризує заряд ядра або кількість електронів в атомі;
у періодичній системі елементів характеризує заряд ядра або кількість електронів в атомі;
· спостерігається чергування мультиплетності від парної до непарної при збільшенні  ;
;
· властивості іонів  подібні до властивостей атома
подібні до властивостей атома  з атомним номером на одиницю меншим.
з атомним номером на одиницю меншим.
Скористаємося тепер моделлю атомів, у якій знехтуємо спін-орбітальною взаємодією. У цьому випадку стаціонарний стан електрона в атомі визначається квантовими числами  . Послідовність заповнення електронних станів атома визначається двома принципами:
. Послідовність заповнення електронних станів атома визначається двома принципами:
· принципом виключення Паулі, згідно якого в атомі може бути лише один електрон із даним набором чотирьох квантових чисел;
· принципом мінімуму енергії, згідно якого при заданому числі електронів в атомі заповнюються стани з мінімальною енергією.
Вони допомагають знаходити розподіл електронів між електронними оболонками атома – станами з однаковими квантовими числами - головним  і орбітальним
і орбітальним  , який називається електронною конфігурацією. Для раціонального наведення електронної конфігурації користуються відповідними квантовими числами
, який називається електронною конфігурацією. Для раціонального наведення електронної конфігурації користуються відповідними квантовими числами  , біля яких вказують кількість електронів на оболонці, наприклад,
, біля яких вказують кількість електронів на оболонці, наприклад,  , тощо.
, тощо.
|
|
|
Спочатку повинні заповнюватись стани з найменшими квантовими числами, бо абсолютні значення енергії цих стаціонарних станів найбільші. Кількість станів при заданих квантових числах обмежена:
(1) у стані з 4-ма квантовими числами  за принципом Паулі може знаходитись лише один електрон;
за принципом Паулі може знаходитись лише один електрон;
(2)у стані з 3-ма квантовими числами  за принципом Паулі може знаходитись лише 2 електрони з різними магнітними спіновими числами
за принципом Паулі може знаходитись лише 2 електрони з різними магнітними спіновими числами 
(3) на оболонці- стані із двома квантовими числами  знаходиться
знаходиться  електронів. Залежно від квантового числа l оболонки називаються
електронів. Залежно від квантового числа l оболонки називаються  На кожній з оболонок може бути скінченне число електронів, яке визначається кількістю можливих значень магнітного орбітального числа
На кожній з оболонок може бути скінченне число електронів, яке визначається кількістю можливих значень магнітного орбітального числа  та магнітного спінового числа
та магнітного спінового числа  . Максимально кількість станів на оболонках та їхня електронна конфігурація наведені в таблиці 14.1.
. Максимально кількість станів на оболонках та їхня електронна конфігурація наведені в таблиці 14.1.
Таблиця 14.1. Максимальна кількість електронів на оболонках
| l | 0 | 1 | 2 | 3 | 4 |
| Оболонка | s | p | d | F | g |
 максимальна кількість станів максимальна кількість станів
| 2 | 6 | 10 | 14 | 18 |
| електронна конфігурація заповненої оболонки | s2 | p6 | d10 | f14 | g18 |
|
|
|
Повністю заповненим оболонкам відповідають нульові значення сумарних орбітальних і спінових моментів  Тому при визначенні термів для незаповнених оболонок усі повністю заповнені електронами оболонки атома можна не враховувати.
Тому при визначенні термів для незаповнених оболонок усі повністю заповнені електронами оболонки атома можна не враховувати.
(4) При даному  може бути
може бути  станів із різними квантовими числами
станів із різними квантовими числами  , бо
, бо
 .
.
Електронний стан із головним квантовим числом 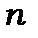 називається шаром. У таблиці 14.2 наведені значення максимальної кількості станів у
називається шаром. У таблиці 14.2 наведені значення максимальної кількості станів у  шарах.
шарах.
Таблиця 14.2. Максимальна кількість електронів у шарі
| N | 1 | 2 | 3 | 4 | 5 |
| назва шару | K | L | M | N | O |
| Кількість станів 2n2 | 2 | 8 | 18 | 32 | 50 |
З таблиці 14.2 видно, що найбільша кількість електронів на шарі з даним значенням головного квантового числа  може збігатися з кількістю елементів у періодах періодичної системи елементів, принаймні, при малих
може збігатися з кількістю елементів у періодах періодичної системи елементів, принаймні, при малих 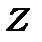 . Тому ймовірно, що періодичність властивостей елементів зі зміною атомного номера може бути зв’язана з періодичною зміною заповнення електронних оболонок при зростанні
. Тому ймовірно, що періодичність властивостей елементів зі зміною атомного номера може бути зв’язана з періодичною зміною заповнення електронних оболонок при зростанні .
.
Періодична система елементів
Розглянемо зміни електронної конфігурації при збільшенні атомного номера  . Енергія електронів у атомі залежить від квантових чисел
. Енергія електронів у атомі залежить від квантових чисел  , причому вона зростає як при збільшенні
, причому вона зростає як при збільшенні  так і
так і  .
.
|
|
|
Правило заповнення електронних оболонок було сформульовано Маделунгом,яке виконується в основному в загальних рисах . Заповнення оболонок іде в порядку зростання суми квантових чисел 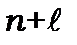 , причому для кожного значення суми
, причому для кожного значення суми  в міру зростання квантового числа
в міру зростання квантового числа 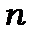 . Чим менше головне квантове число
. Чим менше головне квантове число  , тим більша енергія зв’язку, тобто тим нижче на шкалі енергії знаходиться електрон, бо
, тим більша енергія зв’язку, тобто тим нижче на шкалі енергії знаходиться електрон, бо  , коли
, коли  . Тому спочатку будуть заповнюватись шари
. Тому спочатку будуть заповнюватись шари  і
і  із квантовими числами
із квантовими числами  і 2, що відповідає першому та другому періодам періодичної системи елементів.
і 2, що відповідає першому та другому періодам періодичної системи елементів.
У першому періоді знаходиться 2 елементи  і
і 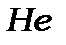 , бо заповнюється К-шар з
, бо заповнюється К-шар з  , у якому є лише одна
, у якому є лише одна  оболонка з
оболонка з  станами.
станами.
У другому періоді заповнюється  -шар з
-шар з  з двома
з двома  і
і  оболонками, у якому може бути лише
оболонками, у якому може бути лише  станів. Тому другий період містить 8 елементів: 2 стани на
станів. Тому другий період містить 8 елементів: 2 стани на  оболонці й 6 станів на
оболонці й 6 станів на  оболонці (
оболонці (  ). Згідно принципу Паулі, в цих станах, принаймні, одне із квантових чисел
). Згідно принципу Паулі, в цих станах, принаймні, одне із квантових чисел 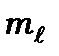 або
або  повинно бути для двох станів різним.
повинно бути для двох станів різним.
Нажаль, точно не можливо вказати, які із цих станів дійсно заповнені електронами, бо модель атома дуже наближена. Вона не враховує тонкощі у взаємодії електронів багатоелектронних атомів, що не дозволяє використовувати принцип мінімуму енергії. Тому для визначення електронної конфігурації, як і у випадку встановлення енергетичної ієрархії термів (розділ 11.3), використовують емпіричні правила Хунда (Гунда). Згідно правилам Хунда, найменшу енергію мають стани з найбільшим сумарним спіновим числом  і сумарним орбітальним числом
і сумарним орбітальним числом  . Число
. Число  набуває значень, що дорівнюють
набуває значень, що дорівнюють  , коли оболонка заповнена менше ніж наполовину, і
, коли оболонка заповнена менше ніж наполовину, і  , коли вона заповнена більш ніж наполовину та
, коли вона заповнена більш ніж наполовину та  коли рівне половиніі. На рис.14.2 наведена схема послідовності заповнення електронами оболонки
коли рівне половиніі. На рис.14.2 наведена схема послідовності заповнення електронами оболонки  .
.
Спочатку заповнюються стани з  і різними
і різними  а потім стани з
а потім стани з  і різними значеннями
і різними значеннями
| Рис.14.2. Заповнення станів 2р оболонки з конфігурацією 2рn, n=1…6. |
 Основні стани атомів визначаються за емпіричними правилами Хунда, наприклад, основний стан атому вуглецю, у якого на р оболонці 2 електрони має сумарне спінове число
Основні стани атомів визначаються за емпіричними правилами Хунда, наприклад, основний стан атому вуглецю, у якого на р оболонці 2 електрони має сумарне спінове число  і основний стан становить
і основний стан становить  . В атомі азоту
. В атомі азоту  і основний стан
і основний стан  . Якщо оболонка заповнена більше чим на половину для визначення основних станів можна використовувати правило еквівалентних електронів. Наприклад, для атома кисню, у якого на р оболонці 4 електрони, потрібно використати 2 еквівалентних електрони, що призводить то терму
. Якщо оболонка заповнена більше чим на половину для визначення основних станів можна використовувати правило еквівалентних електронів. Наприклад, для атома кисню, у якого на р оболонці 4 електрони, потрібно використати 2 еквівалентних електрони, що призводить то терму  . Електронні конфігурації елементів перших двох періодів періодичної системи елементів наведені в таблиці 14.3.
. Електронні конфігурації елементів перших двох періодів періодичної системи елементів наведені в таблиці 14.3.
Таблиця 14.3. Електронні конфігурації елементів перших двох періодів таблиці Менделєєва.
| Пе- ріод | Елемент | електронна конфігурація | Основний стан | Потенціал іонізації eVi | ||
| К | L | |||||
| 1 | 1 H водень | 1s1 | 2S1/2 | 13,54 еВ | ||
| 2 He гелій | 1s2 | 1S0 | 24,58 | |||
| 3 Li літій | 1s2 | 2s1 | 2S1/2 | 5,37 | ||
| 4 Be берилій | 1s2 | 2s2 | 1S0 | 9,32 | ||
| 5 B бор | 1s2 | 2s2 | 2p1 | 2P1/2 | 8,4 | |
| 2 | 6 C вуглець | 1s2 | 2s2 | 2p2 | 3P0 | 11,22 |
| 7 N азот | 1s2 | 2s2 | 2p3 | 4S3/2 | 14,53 | |
| 8 О кисень | 1s2 | 2s2 | 2p4 | 3P2 | 13,61 | |
| 9 F фтор | 1s2 | 2s2 | 2p5 | 2P3/2 | 17,42 | |
| 10Ne неон | 1s2 | 2s2 | 2p6 | 1S0 | 21,56 | |
Третій період починається з лужного металу натрію, в якому 11-й електрон починає заповнювати 3-й період, тобто М-шар із головним квантовим числом  . На трьох
. На трьох  оболонках цього шару може бути розміщено 18 електронів, бо найбільша кількість можливих станів цього шару є
оболонках цього шару може бути розміщено 18 електронів, бо найбільша кількість можливих станів цього шару є  . Проте третій період включає, як це видно з таблиці Менделєєва, лише 8 елементів. Тут уперше зустрічається розбіжність між експериментом і моделлю атома. Основною причиною цієї розбіжності є те, що в моделі не врахований енергетичний внесок орбітального руху електронів. Він залежить від
. Проте третій період включає, як це видно з таблиці Менделєєва, лише 8 елементів. Тут уперше зустрічається розбіжність між експериментом і моделлю атома. Основною причиною цієї розбіжності є те, що в моделі не врахований енергетичний внесок орбітального руху електронів. Він залежить від  - «відцентрової енергії електронів», де
- «відцентрової енергії електронів», де 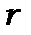 - відстань електрона від ядра. Кулонівська й «відцентрова» енергії мають різні знаки (дивись радіальну частину рівняння Шредінґера формула (8.48)), тому внесок «відцентрової» енергії може порушити плавне зменшення енергії електронів зі збільшенням
- відстань електрона від ядра. Кулонівська й «відцентрова» енергії мають різні знаки (дивись радіальну частину рівняння Шредінґера формула (8.48)), тому внесок «відцентрової» енергії може порушити плавне зменшення енергії електронів зі збільшенням  . Він відіграє більш важливу роль при більших зарядах ядра
. Він відіграє більш важливу роль при більших зарядах ядра  , бо при більших
, бо при більших  можливі стани з більшими орбітальними квантовими числами
можливі стани з більшими орбітальними квантовими числами  . Ця обставина є причиною того, що після заповнення оболонки 3p у атомі аргону
. Ця обставина є причиною того, що після заповнення оболонки 3p у атомі аргону  , наступний 19-й електрон в атомі калію починає заповнювати оболонку
, наступний 19-й електрон в атомі калію починає заповнювати оболонку  , а не
, а не  оболонку. Електронна конфігурація елементів третього періоду наведена в таблиці 14.4.
оболонку. Електронна конфігурація елементів третього періоду наведена в таблиці 14.4.
Таблиця 14.4. Електронна конфігурація елементів 3-го періоду
| Період | Елемент | електр.конфігур. Ne | Основний | ||||||||
| K | L | M | стан | Vi еВ | |||||||
| 1s | 2s | 2p | 3s | 3p | 3d | ||||||
| 11 Na натрій | 1s2 | 2s2 | 2p6 | 3s1 | 2S1/2 | 5,14 | |||||
| 12 Mg магній | 1s2 | 2s2 | 2p6 | 3s2 | 1S0 | 7,61 | |||||
| 13 Al алюміній | 1s2 | 2s2 | 2p6 | 3s2 | 3p1 | 2P1/2 | 5,96 | ||||
| 3 | 14 Si кремній (сіліцій) | 1s2 | 2s2 | 2p6 | 3s2 | 3p2 | 3P0 | 8,15 | |||
| 15 P фосфор | 1s2 | 2s2 | 2p6 | 3s2 | 3p3 | 4S3/2 | 10,48 | ||||
| 16 S сірка | 1s2 | 2s2 | 2p6 | 3s2 | 3p4 | 3P2 | 10,36 | ||||
| 17 Cl хлор | 1s2 | 2s2 | 2p6 | 3s2 | 3p5 | 2P3/2 | 13,01 | ||||
| 18 Ar аргон | 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 1S0 | 15,76 | ||||
Четвертий період. Дев’ятнадцятий електрон починає заповнювати  - шар із квантовим числом
- шар із квантовим числом  з 4-ми оболонками 4s, 4p, 4d, 4f, на яких може розміститись 32 електрона. Проте, залишилась ще незаповненою
з 4-ми оболонками 4s, 4p, 4d, 4f, на яких може розміститись 32 електрона. Проте, залишилась ще незаповненою  - оболонка, на якій може розміститись ще 10 електронів. Тому 4-й період розпочинається заповненням
- оболонка, на якій може розміститись ще 10 електронів. Тому 4-й період розпочинається заповненням 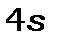 - оболонки (це
- оболонки (це  і
і  )), а потім після її заповнення починає забудовуватися незаповнена
)), а потім після її заповнення починає забудовуватися незаповнена  – оболонка, яка утворює групу з 10-ти перехідних елементів (від
– оболонка, яка утворює групу з 10-ти перехідних елементів (від 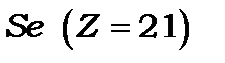 до
до 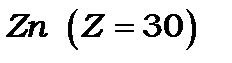 і, нарешті, після її забудови починає заповнюватись
і, нарешті, після її забудови починає заповнюватись  оболонка (елементи від
оболонка (елементи від  до
до  Період закінчується утворенням симетричної замкненої структури електронних оболонок інертного газу криптону. На цьому закінчується 4-й період, хоча залишилися ще незаповнені
Період закінчується утворенням симетричної замкненої структури електронних оболонок інертного газу криптону. На цьому закінчується 4-й період, хоча залишилися ще незаповнені  і
і  оболонки. Електронна конфігурація атомів 4-го періоду наведена в таблиці 14.5.
оболонки. Електронна конфігурація атомів 4-го періоду наведена в таблиці 14.5.
Таблиця 14.5. Електронна конфігурація елементів 4-го періоду.
| Пер | елемент | Електронна конфігурація | Основ. стан | Vi еВ | ||||
| M | N | |||||||
| конфіг. Ne | 3p | 3d | 4s | |||||
| 19 K калій | 1s22s23s23p6 |
| 4s1 | 2S1/2 | 4,32 | |||
| 20 Ca кальцій | (................) |
| 4s2 | 1S0 | 6,11 | |||
| 21 Sc скандій | (................) | 3d1 | 4s2 | 2D1/2 | 6,54 | |||
| 22 Ti титан | (................) | 3d2 | 4s2 | 3F2 | 6,82 | |||
| 23 V ванадій | (................) | 3d3 | 4s2 | 4F3/2 | 6,74 | |||
| 4 | 24 Cr хром | (................) | 3d5 | 4s1 | 7S3 | 6,76 | ||
| 25 Mn марганець | (................) | 3d5 | 4s2 | 6S5/2 | 7,43 | |||
| 26 Fe залізо | (................) | 3d6 | 4s2 | 5D4 | 7,87 | |||
| 27 Co кобальт | (................) | 3d7 | 4s2 | 4F9/2 | 7,86 | |||
| 28 Ni нікель | (................) | 3d8 | 4s2 | 3F4 | 7,63 | |||
| 29 Cu мідь | (................) | 3d10 | 4s1 | 2S1/2 | 7,72 | |||
| 30 Zn цинк | (................) | 3d10 | 4s2 | 1S0 | 9,39 | |||
| 31 Ga галій 32 Ge германій | (................) (................) | 4p1 4p2 | 3d10 3d10 | 4s2 4s2 | 2P1/2 3P0 | 5,27 7,88 | ||
| 33 As арсен | (................) | 4p3 | 3d10 | 4s2 | 4S3/2 | 9,81 | ||
| 34 Se селен 35 Br бром 36 Kr криптон | (................) (................) (................) | 4p4 4p5 4p6 | 3d10 3d10 3d10 | 4s2 4s2 4s2 | 3P2 2P3/2 1S0 | 9,75 11,84 14 | ||
З 37-го елемента починається 5-й період періодичної системи елементів. 37 елемент утворюється при заповненні О-шару із квантовим числом  . Цей шар має 4 оболонки
. Цей шар має 4 оболонки  , на яких можна розмістити 50 електронів.
, на яких можна розмістити 50 електронів.
Спочатку в 5-тому періоді починає заповнюватись  - оболонка, утворюючи лужний
- оболонка, утворюючи лужний  і лужноземельний
і лужноземельний  елементи. Потім, як і в попередньому 4-му періоді, починає заповнювати 10 станів незаповненої
елементи. Потім, як і в попередньому 4-му періоді, починає заповнювати 10 станів незаповненої  оболонки, утворюючи підгрупу перехідних
оболонки, утворюючи підгрупу перехідних  -металів із 10-ти елементів
-металів із 10-ти елементів 

 до
до  й лише після цього забудовується
й лише після цього забудовується  оболонка, утворюючи елементи
оболонка, утворюючи елементи 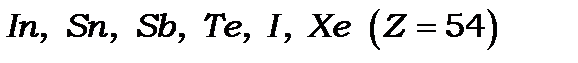 . П’ятий період закінчується 54 елементом ксеноном.
. П’ятий період закінчується 54 елементом ксеноном.
Усього п’ятий період має, як і попередній 4-й період, 18 елементів. Електронна конфігурація елементів 5-го періоду наведена в таблиці 14.6.
Таблиця 14.6. Електронна конфігурація елементів 5-го періоду
| період | Елемент | електрон. конфіг. | Основний стан | Vi еВ | |||
| конфіг. Kr | N | О | |||||
| 4d | 5s | 5p | |||||
| 37 Rb рубідій | 5s1 | 2S1/2 | 4,18 | ||||
| 5 | 38 Sr стронцій | 5s2 | 1S0 | 5,69 | |||
| 39 Y ітрій | 4d1 | 5s2 | 2D3/2 | 6,22 | |||
| 40 Zr цирконій | 4d2 | 5s2 | 3F2 | 6,84 | |||
| 41 Nb ніобій | 4d4 | 5s1 | 6D1/2 | 6,88 | |||
| 42 Mo молібден | 4d5 | 5s1 | 7S2 | 7,10 | |||
| 43 Tc технецій | 4d5 | 5s2 | 6S5/2 | 7,28 | |||
| 44 Ru рутеній | 4d7 | 5s1 | 5F5 | 7,36 | |||
| 45 Rh родій | 4d8 | 5s1 | 4F9/2 | 7,46 | |||
| 46 Pd паладій | 4d10 | 1S0 | 8,33 | ||||
| 47 Ag срібло | 4d10 | 5s1 | 2S1/2 | 7,57 | |||
| 48 Cd кадмій | 4d10 | 5s2 | 1S0 | 8,99 | |||
| 49 In індій | 4d10 | 5s2 | 5p1 | 2P1/2 | 5,76 | ||
| 50 Sn олово | 4d10 | 5s2 | 5p2 | 3P0 | 7,37 | ||
| 51 Sb сурма(стибій) | 4d10 | 5s2 | 5p3 | 4S3/2 | 8,64 | ||
| 52 Te телур | 4d10 | 5s2 | 5p4 | 3P2 | 9,01 | ||
| 53 I йод | 4d10 | 5s2 | 5p5 | 2P3/2 | 10,44 | ||
| 54 Xe ксенон | 4d10 | 5s2 | 5p6 | 1S0 | 12,13 | ||
Після ксенону починається 6-й період. Він починається з 55 елемента лужного металу цезію, у якого заповнюється  оболонка
оболонка  - шару із квантовим числом
- шару із квантовим числом  . Наступним елементом за нам є лужноземельний елемент
. Наступним елементом за нам є лужноземельний елемент  , у якому заповнюється оболонка
, у якому заповнюється оболонка  . Після цього починає, так як і в 5-му періоді забудовуватись незаповнена
. Після цього починає, так як і в 5-му періоді забудовуватись незаповнена  оболонка, на якій може бути 10 електронів. Проте електрону, починаючи з Z=58, енергетично вигідніше займати незаповнену
оболонка, на якій може бути 10 електронів. Проте електрону, починаючи з Z=58, енергетично вигідніше займати незаповнену  оболонку, на якій може розміститись 14 електронів. Таким чином, утворюються елементи, що отримали назву лантанідів. Лише після заповнення
оболонку, на якій може розміститись 14 електронів. Таким чином, утворюються елементи, що отримали назву лантанідів. Лише після заповнення  оболонки продовжує забудовуватись оболонка
оболонки продовжує забудовуватись оболонка  , після заповнення якої, починаючи з
, після заповнення якої, починаючи з  (талій), забудовуватись 6p – оболонка
(талій), забудовуватись 6p – оболонка  . З 87 елементу починає заповнюватись
. З 87 елементу починає заповнюватись  -шар з квантовим числом
-шар з квантовим числом  (таблиця 14.8).Починається 7-й період системи елементів. Спочатку в ньому заповнюються стани
(таблиця 14.8).Починається 7-й період системи елементів. Спочатку в ньому заповнюються стани 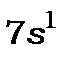 і
і  .При цьому утворюються елементи лужний метал францій і лужноземельний метал радій. З
.При цьому утворюються елементи лужний метал францій і лужноземельний метал радій. З  починає заповнюватись 6d1 оболонка
починає заповнюватись 6d1 оболонка  , а з торію
, а з торію  , іде заповнення
, іде заповнення  оболонки, і утворюється група з 14 елементів, що отримала назву актинідів (
оболонки, і утворюється група з 14 елементів, що отримала назву актинідів (  ).
).
| Таблиця 14.7. Електронна конфігурація елементів 6-го періоду | |||||||||||||
| пе-рі-од | Елемент | електрон. конфіг. | основний стан | Vi еВ | |||||||||
| N | O | P | |||||||||||
| Xe + | 4f | 5d | 6s | 6p |
|
| |||||||
| 55 Сs цезій |
|
| 6s1 | 2S1/2 | 3,89 | ||||||||
| 56 Ba барій |
|
| 6s2 | 1S0 | 5,2 | ||||||||
| 57 La лантан |
| 5d1 | 6s2 | 2D3/2 | 5,61 | ||||||||
| 58 Ce церій |
| 4f2 |
| 6s2 | 3І4 | 6,91 | |||||||
| 59 Pr празеодим |
| 4f3 |
| 6s2 | 4Н9/2 | 5,76 | |||||||
| 60 Nd неодим |
| 4f4 |
| 6s2 | 5I4 | 6,31 | |||||||
| 61 Pm прометій |
| 4f5 |
| 6s2 | 6H5\2 | 6,3 | |||||||
| 62 Sm самарій |
| 4f6 |
| 6s2 | 7F0 | 5,7 | |||||||
| 63 Eu європій |
| 4f7 |
| 6s2 | 8S7/2 | 5,66 | |||||||
| 6 | 64 Gd гадоліній |
| 4f7 | 5d1 | 6s2 | 9D2 | 5,98 | ||||||
| 65 Tb тербій |
| 4f9 |
| 6H15/2 | 5,85 | ||||||||
| 66 Dy диспрозій |
| 4f10 |
| 6s2 | 5I8 | 5,93 | |||||||
| 67 Ho гольмій |
| 4f11 |
| 6s2 | 4I15/2 | 6,02 | |||||||
| 68 Er ербій |
| 4f12 |
| 6s2 | 3H6 | 6,10 | |||||||
| 69 Tm тулій |
| 4f13 |
| 6s2 | 2F7/2 | 6,18 | |||||||
| 70 Yb ітербій |
| 4f14 |
| 6s2 | 1S0 | 6,25 | |||||||
|
| 71 Lu лютецій |
| 4f14 | 5d1 | 6s2 | 2D3/2 | 5,48 | ||||||
| 72 Hf гафній |
| 4f14 | 5d2 | 6s2 | 3F2 | 7,5 | |||||||
| 73 Ta тантал |
| 4f14 | 5d3 | 6s2 | 4F3/2 | 7,89 | |||||||
| 74 W вольфрам |
| 4f14 | 5d4 | 6s2 | 5D0 | 7,98 | |||||||
| 75 Re реній |
| 4f14 | 5d5 | 6s2 | 6S5/2 | 7,87 | |||||||
| 76 Os осмій |
| 4f14 | 5d7 | 6s1 | 5D4 | 8,7 | |||||||
| 77 Ir іридій |
| 4f14 | 5d7 | 6s2 | 4F9/2 | 9,1 | |||||||
| 78 Pt платина |
| 4f14 | 5d9 | 6s2 | 3D3 | 8,96 | |||||||
| 79 Au золото |
| 4f14 | 5d10 | 6s1 | 2S1/2 | 9,23 | |||||||
| 80 Hg ртуть |
| 4f14 | 5d10 | 6s2 | 1S0 | 10,43 | |||||||
| 81 Tl талій |
| 4f14 | 5d10 | 6s2 | 6p1 | 2P1/2 | 6,1 | ||||||
| 82 Pb свинець |
| 4f14 | 5d10 | 6s2 | 6p2 | 3P0 | 7,42 | ||||||
| 83 Bi вісмут |
| 4f14 | 5d10 | 6s2 | 6p3 | 4S3/2 | 7,29 | ||||||
| 84 Po полоній |
| 4f14 | 5d10 | 6s2 | 6p4 | 3P2 | 8,43 | ||||||
| 85 At астат |
| 4f14 | 5d10 | 6s2 | 6p5 | 2P3/2 | 9,5 | ||||||
| 86 Rn радон |
| 4f14 | 5d10 | 6s2 | 6p6 | 1S0 | 10,75 | ||||||
| Таблиця 14.8. Електронна конфігурація елементів 7-го періоду | |||||||||||||
| Пе-рі- од | Елемент | конфігурація Xe + | Vi еВ | ||||||||||
| 87 Fr францій | 7s1 | 2S1/2 | 3,98 | ||||||||||
|
| 88 Ra радій | 7s2 | 1S0 | 5.98 | |||||||||
|
| 89 Ac актиній | 7s2 6d1 | 2D3/2 | 6,9 | |||||||||
|
| 90 Th торій | 7s2 6d25f1 | 3F2 | 5,7 | |||||||||
|
| 91 Pa протакт. | 7s2 6d15f2 | 4K11/2 | 5,7 | |||||||||
|
| 92 U уран | 7s2 6d15f3 | 5L6 | 4 | |||||||||
|
| 93 Np нептуній | 7s2 6d15f4 | 6L11/2 | 5,9 | |||||||||
| 7 | 94 Pu плутоній | 7s25f6 | 7F6 | 5,71 | |||||||||
|
| 95 Am америц. | 7s25f7 | 8S7/2 | 5,19 | |||||||||
|
| 96 Cm кюрій | 7s25f76d1 | 9D2 | 6,09 | |||||||||
|
| 97 Bk верклій | 7s215f86d1 | 8H17/2 | 6,3 | |||||||||
|
| 98 Cf каліфор. | 7s25f10 | 5I8 | 6,41 | |||||||||
|
| 99Esейнштейн. | 7s25f11 | 4I15/2 | 6,8 | |||||||||
|
| 100 Fm фермій | 7s25f12 | 3H6 | 6,7 | |||||||||
|
| 101 Md менделевій | 7s25f13 | 2F7/2 | 6,5 | |||||||||
|
| 102 No нобелй | 7s25f14 | 1S0 | 6,84 | |||||||||
|
| 103 Lr лоуренцій | 7s25f146d1 | 2D3/2 | 5,83 | |||||||||
|
| 104 Rf резерфордій | 7s25f146d2 | 3F2 | ||||||||||
|
| 105 Db дубній | 7s25f146d3 | 4F3/2 | ||||||||||
|
| 106 Sg сіборгій 107 Bh борій 108 Hs хасій 109 Mt мейтнерій 110 Ds дармштадтій | ~7s25f146d4 ~7s25f146d5 ~7s25f146d6 ~7s25f146d7 ~7s15f146d9
|
| ||||||||||
Ця група елементів аналогічна за своїми властивостями групі елементів, у якій заповнюються  оболонка, і які називаються лантанідами (лантаноїдами). Після 105 елемента стійких елементів у природі не існує. Неможливість стабільного існування важких елементів пояснюється тим, що сили кулонівського відштовхування протонів в атомному ядрі не можуть бути врівноважені ядерними силами притяжіння і ядро стає нестійким. Перевага сил кулонівського відштовхування протонів у ядрі над силами між нуклонами ядра обумовлюється дальнодіючим характером кулонівських сил.
оболонка, і які називаються лантанідами (лантаноїдами). Після 105 елемента стійких елементів у природі не існує. Неможливість стабільного існування важких елементів пояснюється тим, що сили кулонівського відштовхування протонів в атомному ядрі не можуть бути врівноважені ядерними силами притяжіння і ядро стає нестійким. Перевага сил кулонівського відштовхування протонів у ядрі над силами між нуклонами ядра обумовлюється дальнодіючим характером кулонівських сил.
В 1994р. в Центрі дослідження важких іонів в Дармштадті (Германія) були штучно синтезовані хімічні елементи з 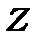 =111 та 112. Перший елемент отримав назву рентгеній , другий –копернікий. Елемент з
=111 та 112. Перший елемент отримав назву рентгеній , другий –копернікий. Елемент з  =112 офіційно признаний Міжнародним інститутом теоретичної та прикладної хімії і напевно буде введений в періодичну таблицю Менделєєва Синтез елементів з
=112 офіційно признаний Міжнародним інститутом теоретичної та прикладної хімії і напевно буде введений в періодичну таблицю Менделєєва Синтез елементів з  більше 112 активно розробляється і досліджується в провідних спеціалізованих центрах Росії ( Об’єднаний інститут ядерних досліджень,Дубна), Германії (Центр дослідження важких іонів, Дармштадт) , США(Національна лабораторія Лоренс Лівермор , Каліфорнія).
більше 112 активно розробляється і досліджується в провідних спеціалізованих центрах Росії ( Об’єднаний інститут ядерних досліджень,Дубна), Германії (Центр дослідження важких іонів, Дармштадт) , США(Національна лабораторія Лоренс Лівермор , Каліфорнія).
У таблиці 14.9 зведені дані про кількість електронів, що заповнюють різні шари й оболонки. Стрілками вказана послідовність заповнення оболонок з урахуванням «відцентрової» енергії.
Розгляд заповнення електронних оболонок показує, що він відбувається дуже закономірно. В кожній підгрупі періодичної системи знаходяться елементи з однаковою кількістю електронів на зовнішній оболонці. Вони мають однаковий стан і подібні властивості, що, наприклад, ілюструє таблиця 14.10.
| Таблиця 14.10. Електронні конфігурації у підгрупах | |||||||||
| s1 | s2 | s2p1 | s2p2 | s2p3 | S2p4 | s2p5 | s2p6 | ||
| 2 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne | 1s1 |
| 3 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar | 2s22p6 |
| 4 | 19K | 20Ca | - | - | - | - | - | - | 3s23p6 |
| 29Cu | 30Zn | 31Ga | 32Ge | 33As | 34Se | 35Br | 36Kr | 3d10 | |
| 5 | 37Rb | 38Sr | - | - | - | - | - | - | 4s24p6 |
| 47Ag | 48Cd | 51In | 52Sn | 53Sb | 54Te | 55I | 54Xe | 3d10 | |
| 6 | 55Cs | 56Ba | - | - | - | - | - | - | 5s25p6 |
| 79Au | 80Hg | 81Tl | 82Pb | 83Bi | 84Po | 85At | 86Rn | 4f145d10 | |
| 7 | 87Fr | 88Ra | 6s26p6 | ||||||
| Таблиця 14.9. Послідовність заповнення атомних оболонок |
| 2S1/2 | 1S0 | 2P1/2 | 3P0 | 4S3/2 | 3P2 | 2P3/2 | 1S0 |
Зі зміною  спостерігається чергування мультиплетності від парної до не парної і має місце подібність властивостей однократно іонізованого атома з атомом, що має атомний номер на одиницю менший
спостерігається чергування мультиплетності від парної до не парної і має місце подібність властивостей однократно іонізованого атома з атомом, що має атомний номер на одиницю менший  Наприклад, перша група - група водню має один слабко зв’язаний електрон на ns оболонці, а під нею знаходиться
Наприклад, перша група - група водню має один слабко зв’язаний електрон на ns оболонці, а під нею знаходиться  - заповнена симетрична сильно зв’язана оболонка. Ця група елементів має однакові властивості, а саме: дублетні терми, одновалентність по відношенню до водню, водневоподібні спектри тощо.
- заповнена симетрична сильно зв’язана оболонка. Ця група елементів має однакові властивості, а саме: дублетні терми, одновалентність по відношенню до водню, водневоподібні спектри тощо.
До другої групи належать  і лужноземельні метали
і лужноземельні метали  . Вони мають заповнену
. Вони мають заповнену  оболонку й два електрони на периферійній
оболонку й два електрони на периферійній  оболонці. Вони подібні за своїми хімічними та спектральними властивостями: двохвалентні хімічні зв’язки, синглетні терми тощо. Аналогічний розгляд елементів у групах можна було б і продовжити, розглядаючи групи бора (III), вуглецю (IV), азоту (V), кисню (VI), фтору(VI), інертних газів (VII) тощо. Отже можна дійти до висновку, що елементи однієї групи мають однакову будову периферійної електронної оболонки й однакові властивості.
оболонці. Вони подібні за своїми хімічними та спектральними властивостями: двохвалентні хімічні зв’язки, синглетні терми тощо. Аналогічний розгляд елементів у групах можна було б і продовжити, розглядаючи групи бора (III), вуглецю (IV), азоту (V), кисню (VI), фтору(VI), інертних газів (VII) тощо. Отже можна дійти до висновку, що елементи однієї групи мають однакову будову периферійної електронної оболонки й однакові властивості.
| Таблиця 14.11. Електронна конфігурація підгрупи скандію. | |||
| елемент | Ел. конфігурація | Основний стан | |
| 4 | 21Sc | Ar+ 3d14s2 | 2D3/2 |
| 5 | 39Y | Kr+ 4d15s2 | 2D3/2 |
| 6 | 57La | Xr+ 5d16s2 | 2D3/2 |
| 7 | 89Ac | Rn+ 6d17s2 | 2D3/2 |
Треба також звернути увагу ще й на те, що в деяких групах єпідгрупи, в якихбільш глибока оболонка  або
або  заповнена. Наприклад, у першій групі є підгрупа металів
заповнена. Наприклад, у першій групі є підгрупа металів  , у другій групі є підгрупа, в яку входять
, у другій групі є підгрупа, в яку входять  , у третій групі є підгрупа, у яку входять
, у третій групі є підгрупа, у яку входять  (таблиця 14.11), тощо. Елементи кожної підгрупи мають однакові властивості й мають подібну будову своїх периферійних електронних оболонок. Таким чином, можна дійти до висновку, що періодичний закон Д.І. Менделєєва відображає періодичність у заповненні електронних оболонок. Атоми з подібною будовою (конфігурацією) електронних оболонок мають подібні властивості. У подальшому буде також показано, що будова найбільш глибоких
(таблиця 14.11), тощо. Елементи кожної підгрупи мають однакові властивості й мають подібну будову своїх периферійних електронних оболонок. Таким чином, можна дійти до висновку, що періодичний закон Д.І. Менделєєва відображає періодичність у заповненні електронних оболонок. Атоми з подібною будовою (конфігурацією) електронних оболонок мають подібні властивості. У подальшому буде також показано, що будова найбільш глибоких  шарів у всіх елементів подібна й тому вони мають подібні рентгенівські спектри. Усе це і всі інші експериментальні дані свідчать, що квантова механіка задовільно пояснює всі закономірності періодичної системи Менделєєва.
шарів у всіх елементів подібна й тому вони мають подібні рентгенівські спектри. Усе це і всі інші експериментальні дані свідчать, що квантова механіка задовільно пояснює всі закономірності періодичної системи Менделєєва.
Дата добавления: 2018-05-09; просмотров: 414; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

