Равновесия в полярных НДВС-растворителях
Казалось бы, в этих растворителях с высокими значениями  равновесия диссоциации кислот не должны осложняться такими побочными процессами, как ассоциация ионов противоположного знака.
равновесия диссоциации кислот не должны осложняться такими побочными процессами, как ассоциация ионов противоположного знака.
Сольватация ионов в НДВС-растворителях
В протофобных (катионофобных) негидроксилсодержащих (НДВС) растворителях плохо сольватируются такие вышеуказанные анионы, а также катионы металлов.
В протофильных (катионофильных) НДВС растворителях маленькие анионы тоже плохо сольватированы (отсюда высокая активность и реакционная способность иона HO– в среде ДМСО; щелочь, как и метилат натрия в ДМСО образуют так называемые суперосновные среды).
В ДМСО присутствие ионов HO– и RO– может приводить к образованию димсил-иона CH3SOCH2–.
Но катионы металлов здесь сольватированы хорошо, о чем говорят значения констант устойчивости соответствующих металлокомплексов с краун-эфирами и криптандами (Таблица …).
Поэтому катионофобные растворители называют также «координирующими».
| Растворитель | 
| 
| 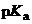 бензойной кислоты бензойной кислоты
|
| Диметилсульфоксид | 46.4 | 33.3 | 11.1 |
| Диметилформамид | 36.7 | 29.4 | 12.3 |
| Ацетонитрил | 35.9 | 33.3 | 20.7 |
| Ацетон | 20.56 | 32.5 | 18.2 |
| Пропиленкарбонат | 64.4 | 29.2 | 19.7 |
Паркер, Бордуэлл
Кольтгоф и Чантуни
Две группы: протофильные и протофобные полярные НДВС-растворители
Гомосопряжение и гетеросопряжение:
|
|
|
A– + HA  (HA2)– : [A ··· H ··· A] –
(HA2)– : [A ··· H ··· A] –
A– + HX  (HAX)– [A ··· H ··· X] –
(HAX)– [A ··· H ··· X] –
Порядок величин  в протофобных НДВС-растворителях иллюстрируют данные для кислот в ацетонитриле, представленные в Таблице …
в протофобных НДВС-растворителях иллюстрируют данные для кислот в ацетонитриле, представленные в Таблице …
| Кислота |  в ацетонитриле в ацетонитриле
|
| Уксусная | 4.7 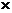 103 103
|
| Бензойная | 4 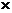 103 103
|
| 2,6-Дигидроксибензойная кислота | 400 |
| Салициловая | 2 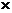 103 103
|
| Фенол | 1.1 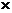 104 104
|
| 4-Нитрофенол | 5 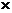 103 103
|
| 3,5-Динитрофенол | 4.4 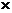 104 104
|
| 2,6-Ди-трет-бутил-4-нитрофенол | 0 |
| 2,6-Динитрофенол | 0 |
| 4-Хлор-2,6-динитрофенол | 0 |
| 2,4,6-Тринитрофенол (пикриновая кислота) | 2 |
| HCl | 200 |
| HNO3 | 200 |
| HBr | 250 |
| H2SO4 | 1.3 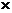 103 103
|
| Метансульфоновая | 7 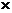 103 103
|
Примерно такого же порядка константы в нитрометане
Объяснение – связь со строением карбоксильных кислот и фенолов
Обращают на себя внимание низкие значения  для кислот с орто-заместителями, особенно – с объемистыми трет-бутильными и нитро-группами.
для кислот с орто-заместителями, особенно – с объемистыми трет-бутильными и нитро-группами.
Аналогичные процессы могут протекать и в растворах оснований при их протонировании, с образованием частиц HB2+. Особенно сильно проявляются подобные взаимодействия в среде растворителей с явно выраженными протофобными свойствами (нитрометан, нитробензол). В других случаях константы образования обычно ниже, чем для частиц HA2–.
|
|
|
Протофильные растворители вроде ДМСО конкурируют с анионами за молекулы HA, поэтому значения  в этом растворителе обычно на два порядка ниже, чем в ацетонитриле
в этом растворителе обычно на два порядка ниже, чем в ацетонитриле
АН > ДМФА > ДМСО
Особо – о роли воды.
Представление о пересольватации протона как о химической реакции
H3O+ + (СH3)2SO  (СH3)2SOH+ + H2O
(СH3)2SOH+ + H2O
В ацетонитриле, по данным Кольтгофа:
H2O + H+solv  H3O+,
H3O+, 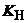 = 3
= 3 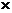 102
102
(СH3)2SO + H+solv  (СH3)2SOH+,
(СH3)2SOH+, 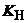 = 6
= 6 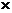 108
108
Предполагается также существование целого набора гидратов протона в ацетонитриле
В ДМСО и других протофильных НДВС-растворителях следы воды поэтому не опасны, если только не исследуются кислоты, более слабые, чем вода
Добавки ДМСО к ацетону

Геометрия комплексов а) H(DMSO)2+ и б) H(Ac,DMSO)+ по результатам квантово-химического расчета (А. В. Лебедь).
Некоторые кислоты могут быть нестойкими в органических растворителях. Например, в пропиленкарбонате в присутствии следов воды может протекать реакция:
HFSO3 + H2O 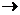 HF + H2SO4
HF + H2SO4
Трихлоруксусная кислота в органических растворителях, например, в ацетонитриле, особенно – в присутствии оснований, может разлагаться на хлороформ и диоксид углерода (реакция декарбоксилирования).
|
|
|
Поскольку получение 100%-ной хлорной кислоты затруднительно[17] и связано с опасностью взрыва,[18] то её вводят в органические растворители в виде водного раствора (например, 70 %-ного по массе), а появившуюся таким образом в системе воду связывают добавлением уксусного ангидрида. Конечно, при этом образуется уксусная кислота, но диссоциация её подавлена за счет присутствия HClO4.
В целом в органических растворителях кислоты обычно становятся слабее, чем в воде. В Таблице …. представлены значения 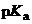 в ацетонитриле пикриновой кислоты (
в ацетонитриле пикриновой кислоты ( 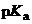 в воде
в воде 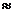 0.4), а также 4-толуолсульфоновой, 2,5-дихлорбензолсульфоновой и 2,4,6-тринитробензолсульфоновой кислот и некоторых других кислот, которые в воде диссоциируют практически нацело.
0.4), а также 4-толуолсульфоновой, 2,5-дихлорбензолсульфоновой и 2,4,6-тринитробензолсульфоновой кислот и некоторых других кислот, которые в воде диссоциируют практически нацело.




| Кислота | 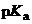 в ацетонитриле в ацетонитриле
|
| Пикриновая | 11.0 |
| 4-Толуолсульфоновая | 8.0 |
| Хлороводородная | 8.9 |
| 2,5-дихлорбензолсульфоновая | 6.2 |
| Бромоводородная | 5.5 |
| Трифторметансульфоновая | 2.6 |
| 2,4,6-тринитробензолсульфоновая | 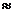 2 2
|
| Хлорная | 2.1 |
Такие высокие значения 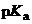 характерны для протофобных НДВС-растворителей, в то время как в протофильных сила кислот по сравнению с водным раствором осмлабляется не столь резко, из-за высокого сродства молекул растворителя к протону. Интересно, что в ДМСО пикриновая кислота становится даже более сильной, чем в воде: здесь накладываются два фактора – высокая основность растворителя и стабилизация его дипольными молекулами аниона пикрата, заряд которого сильно делокализован между электроноакцепторными нитро-группами.
характерны для протофобных НДВС-растворителей, в то время как в протофильных сила кислот по сравнению с водным раствором осмлабляется не столь резко, из-за высокого сродства молекул растворителя к протону. Интересно, что в ДМСО пикриновая кислота становится даже более сильной, чем в воде: здесь накладываются два фактора – высокая основность растворителя и стабилизация его дипольными молекулами аниона пикрата, заряд которого сильно делокализован между электроноакцепторными нитро-группами.
|
|
|
Для кислот средней силы в НДВС-растворителях вполне реально существование, наряду с молекулами HA, еще и ионных пар H+сольв.A–. В этом случае экспериментально определяемая методами кондуктометрии или потенциометрии константа 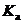 равна:
равна:

(см схему Измайлова)
«Самая сильная кислота» (Л. М. Ягупольский) –при взаимодействии с ДМСО даже начинает гореть:

карборановые кислоты?!
Основания
Щелочи обычно ограниченно растворимы в НДВС-растворителях, так как ион HO– плохо сольватирован в таких средах.
1,8-диаза-бицикло-[5.4.0]-7-ундецен
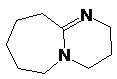
и другое супероснование, см. также ‘proton sponge’
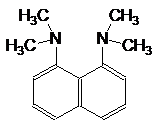
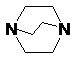
1,8-бис-(диметиламино)нафталин 1,2-диазабицикло[2.2.2]октан
Интересными свойствами обладает ион F– в некоторых НДВС-растворителях, например, в ацетонитриле. Введение фторида в раствор в виде N(н-C4H9)4F или других солей позволяет катализировать многие реакции. Важнейшим свойством плохо сольватированного фторида является его способность выступать сильным акцептором водородной связи и отрывать протон от NH и CH-групп, образуя молекулы HF или ионы HF2–.[19]
Примером сложного протекания ионных процессов в нитрометане является диссоциация трифенилхлорметана[20] (поведение которого в SO2 было рассмотрено выше). Образующийся в результате диссоциации хлорид
(C6H5)3C–Cl  (C6H5)3C+Cl–
(C6H5)3C+Cl–  (C6H5)3C+ + Cl–
(C6H5)3C+ + Cl–
взаимодействует с молекулой растворителя с образованием хлороводорода:
Cl– + CH3NO2  HCl + CH2NO2– ,
HCl + CH2NO2– ,
который, в свою очередь, образует комплексный анион (HCl + Cl–  HCl2–), далее взаимодействующий с карбокатионом:
HCl2–), далее взаимодействующий с карбокатионом:
(C6H5)3C+ + HCl2–  (C6H5)3C+HCl2–, либо:
(C6H5)3C+HCl2–, либо:
(C6H5)3C+Cl– + HCl  (C6H5)3C+Cl– …HCl
(C6H5)3C+Cl– …HCl  (C6H5)3C+HCl2–,
(C6H5)3C+HCl2–,
Возможно также образование эфира:

Галогеноводороды не вполне стабильны в ацетонитриле; электропроводимость их растворов после приготовления растет во времени. Это объясняется[21] как медленным установлением равновесия:

так и следующими процессами химического взаимодействия с растворителем:

Этот механизм возможен для HCl и особенно для HBr и HI.
Дата добавления: 2018-05-09; просмотров: 629; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
