Реакции обмена протоном в растворах
Выше мы уже видели ряд специфических эффектов, коренным образом определяющих характер диссоциации электролитов-ионофоров. Это, например, стабилизирующее влияние водородной связи при образовании ионных пар в НДВС-растворителях, а также высокие константы ассоциации, характерные для плохо сольватированных ионов. Тем более природа растворителя проявляется в случае кислот, когда речь идет о разрыве ковалентной связи, например, при превращении молекулы HA в ионы A– и H+. И действительно, константы диссоциации кислот, 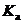
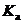 =
= 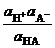 ;
; 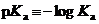
варьируют в гораздо более широких пределах, чем константы образования ионных пар – как в пределах одного растворителя, так и при переходе от одного растворителя к другому. Например, значение 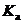 бензойной кислоты при переходе от ДМСО к ацетонитрилу уменьшается в четыре миллиарда раз!
бензойной кислоты при переходе от ДМСО к ацетонитрилу уменьшается в четыре миллиарда раз!
Кислотно-основные равновесия имеют первостепенное теоретическое и прикладное значение как сами по себе, так и при реакциях окисления-восстановления и комплексообразования. Поэтому рассмотрим их подробнее с учетом специфики растворителей различных классов.
О состоянии иона H+ в растворах – переход к кислотам
По размеру протон в примерно десять тысяч раз меньше атомов. Это создает огромную напряженность электрического поля, и поэтому свободный протон в растворе не существует. Ион лиония в любой жидкой среде представляет собой протон, внедрившийся в электронные оболочки молекулы растворителя.
|
|
|
Поэтому протолитические реакции протекают по двум основным механизмам: перенос протона от кислоты к молекуле растворителя и от кислоты непосредственно к основанию.
О скорости протонирования в водных растворах – см Белл и новая литература
Автоионизация растворителей и строение иона лиония в растворах
Автоионизация:
В простейшем случае предполагается схема:
2HL  H2L+ + L–;
H2L+ + L–; 
примеры:
спирты: 2ROH  ROH2+ + RO–
ROH2+ + RO–
аммиак: 2NH3  NH4+ + NH2–
NH4+ + NH2–
ДМСО: 2(CH3)2SO  (CH3)2SOH+ + CH3SOCH2–.
(CH3)2SOH+ + CH3SOCH2–.
уксусная кислота: 2CH3COOH  CH3COOH2+ + CH3COO–
CH3COOH2+ + CH3COO–
уксусный ангидрид – два механизма
и в других случаях картина может быть сложнее
Значения  некоторых растворителей (25 оС)
некоторых растворителей (25 оС)
| Растворитель | 
|
| Вода | 14.00 |
| Аммиак | 32.5 (–33 оС) |
| Уксусная кислота | 14.45 |
| Муравьиная кислота 1 | 6.2 |
| Серная кислота | 3.33 |
| Фтороводород | 12.5 (0 оС) |
| Уксусный ангидрид 2 | 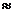 14.5 (20 оС) 14.5 (20 оС)
|
| Метанол | 16.7-17.2 |
| Этанол | 18.9-19.5 |
| 1-Бутанол | 21.6 |
| трет-Бутанол | 26.8-28.5 |
| Формамид | 16.8 (20 оС) |
| Диметилформамид | 29.4 |
| Диметилсульфоксид | 33.3 |
| Ацетон | 32.5 |
| Ацетонитрил | 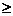 33.3 33.3
|
|
|
|
1 Имеются доводы в пользу того, что ион лиония муравьиной кислоты, HCOOH2+, разлагается на CO и H3O+, и именно ион гидроксония является ионом лиония в данном растворителе.
2 Молекула (CH3CO)2O диссоциирует, по всей вероятности, на ионы ацетилия CH3CO+ и ацетата CH3COO–.
даже для воды
Обычно в воде предполагают существование протона прежде всего в виде иона H3O+,
Цундель, Винник: H5O2+,
Эйген H9O4+,

Уэллс H11O5+,
Стехиометрия может быть и сложнее, так, наиболее вероятным считается состав иона лиония H(DMSO)2+:

Но точнее, вероятно, так:

Автоионизация возможна и в растворителях, молекулы которых вообще не содержат атом водорода:
POCl3  POCl2+ + Cl–
POCl2+ + Cl–
(Гутман)
N2O4  NO+ + NO3–
NO+ + NO3–
Температура кипения 21.3 оС ,  = 2.42 при 18 оС,
= 2.42 при 18 оС, 
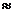 25
25
(Buvari – см)
Но в инертных малополярных растворителях, таких, как бензол или гексан, автоионизация вообще не происходит.
Особо – о роли воды.
Представление о пересольватации протона как о химической реакции
В простейшем случае:
H3O+ + СH3OH  СH3OH2+ + H2O
СH3OH2+ + H2O
H3O+ + (СH3)2SO  (СH3)2SOH+ + H2O
(СH3)2SOH+ + H2O
Отсюда – роль примесей воды в неводных растворителях и связь с основностью растворителей
Особенности кислотно-основных равновесий в растворителях различных групп
|
|
|
Дата добавления: 2018-05-09; просмотров: 683; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
