Физические характеристики неорганических растворителей
| Растворитель | Tплавл., К | Tкип., К | 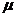 , Дб , Дб
| 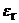
| 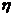  103, Па с 103, Па с
|
| Вода | 273.15 | 373.15 | 1.834 | 78.3 | 0.894 |
| Диоксид серы | 197.64 | 238.08 | 1.62 | 15.1 | 0.312 |
| Цианистый водород | 259.9 | 298.85 | 2.96 | 106.8 | 0.183 |
| Аммиак | 195.45 | 239.77 | 1.45 | 16.9 | 0.135 |
| Гидразин | 275.15 | 386.65 | 1.85 | 58.5 | 0.905 |
| Серная кислота | 283.52 | 603 | — | 100.5 | 24.54 |
| Фтороводород | 83.6 * |
* При 0 оС
температуры – при давлении 1.01325 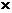 105 Па, прочие характеристики – при t = 25.0 o C
105 Па, прочие характеристики – при t = 25.0 o C
t = T – 273.15
Перейдем теперь к рассмотрению органических растворителей. Начнем со спиртов, которые можно рассматривать как продукт замещения атома водорода в молекуле воды на углеводородный радикал.
В таблице 2 представлены некоторые физические свойства пяти одноатомных спиртов с неразветвленной углеводородной цепочкой, а также трет-бутанола и двух многоатомных спиртов.
Как видно из этих данных, вязкость жидких спиртов нарастает параллельно с величиной углеводородного радикала, а особенно вязкими являются этиленгликоль и глицерин (вязкость последнего в тысячу раз выше, чем у воды).
О значениях Tплавл., Tкип и плотности сказать в тексте
Т а б л и ц а 2.
Физические характеристики спиртов (25 оС)
| Растворитель | 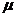 , Дб , Дб
| 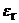
| 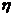 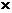 103, Па с 103, Па с
|
| Метанол | 1.70 | 32.66 | 0.5445 |
| Этанол | 1.69 | 24.55 | 1.087 |
| 1-Пропанол | 1.69 | 20.45 | 1.943 |
| 1-Бутанол | 1.64 | 17.51 | 2.61 |
| 2-Метил-2-пропанол * | 1.64 | 12.47 | 5.12 |
| 1-Октанол | 1.67 | 9.8 | 7.30 |
| Этиленгликоль | 2.30 | 37.7 | 16.63 |
| Глицерин | 2.66 | 42.5 | 945 |
*трет-Бутанол
|
|
|
Значения дипольных моментов молекул сравнительно невелики, и в случае одноатомных спиртов примерно такие же, как у воды.
Характерной особенностью спиртов является их способность выступать донорами водородной связи (ДВС). Водородная связь, или H-связь, – это вторая связь, образованная атомом водорода, уже связанным ковалентно с другим атомом:

Важным критерием образования водородной связи, образованной группой OH, является сдвиг частоты валентных колебаний связи O–H в инфракрасном спектре, обозначаемый как 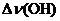 .
.
Длина водородной связи больше, чем ковалентной. Например, в кубической структуре льда расстояние между атомами кислорода соседних молекул, соединенных водородной связью (O – H ··· O), составляет 276 пм,[4] в то время как длина связи O – H равна 97 пм.
Иногда водородная связь может рассматриваться как первая ступень кислотно-основного взаимодействия. Водородная связь может быть не только межмолекулярной, как это было представлено выше, но и внутримолекулярной.[5]
Но для характеристики молекул растворителей важнее их способность образовывать межмолекулярные водородные связи.
|
|
|
Донором водородной связи может выступать не только группа OH, но и другие, например, NH.
Значение 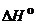 процесса образования водородной связи в растворах составляет обычно –(10–40) кДж моль–1, в то время как для образования ковалентной связи
процесса образования водородной связи в растворах составляет обычно –(10–40) кДж моль–1, в то время как для образования ковалентной связи 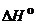 по абсолютной величине на порядок больше, а для неспецифических (ван-дер-ваальсовых) взаимодействий – на порядок меньше.
по абсолютной величине на порядок больше, а для неспецифических (ван-дер-ваальсовых) взаимодействий – на порядок меньше.
Малый размер атома водорода обусловливает бόльшую прочность H-связи по сравнению с неспецифическим диполь-дипольным взаимодействием:
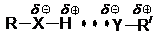
В отличие от воды, жидкие одноатомные спирты образуют двумерную систему водородных связей, в то время как этиленгликоль и глицерин – трехмерную, как и вода. Спирты являются типичными и главными представителями группы растворителей, называемых гидроксилсодержащими, или, шире, ДВС-растворителями. В этих растворителях хорошо сольватированы прежде всего анионы малого размера, такие, как F– и OH–:
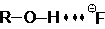
То же относятся и к ионам R–COO–, так как у них отрицательный заряд локализован на карбоксилатной группировке. Существует очень интересная и важная группа растворителей, молекулы которых высокополярны и, в противоположность спиртам, не являются донорами водородной связи. Эти растворители называют диполярными апротонными (по А. Паркеру) или, точнее, диполярными не являющимися донорами водородной связи растворителями (НДВС-растворителями, по Ф. Бордуэлу). Типичные представители этой группы даны в Таблице 3 и на Рисунке 1; значения 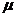 для них колеблются от 2.8 до 5.4, а относительная диэлектрическая проницаемость от 20 до 182.
для них колеблются от 2.8 до 5.4, а относительная диэлектрическая проницаемость от 20 до 182.
|
|
|
Структура этих жидкостей определяется их высокой полярностью: упрощенно можно представить себе, что их молекулы ассоциируют друг с другом по принципу «голова к хвосту» (положительный конец диполя молекулы с отрицательным концом диполя соседней молекулы) и выстраиваются в цепочечные или циклические структуры.
Т а б л и ц а 3.
Физические характеристики полярных НДВС-растворителей (25 оС)
| Растворитель | 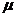 , Дб , Дб
| 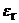
| 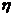  103, Па с 103, Па с
|
| Ацетон | 2.83 | 20.56 | 0.303 |
| Нитрометан | 3.17 | 36.7 | 0.612 |
| Нитробензол | 4.03 | 34.8 | 1.795 |
| Ацетонитрил | 3.45 | 35.95 | 0.3415 |
| Формамид | 3.37 | 109.5 | 3.302 |
| N-Метилформамид | 3.86 | 182.4 | 1.65 |
| N,N-Диметилформамид | 3.86 | 36.7 | 0.796 |
| N-Метилпирролидон | 4.08 | 32.2 | 1.666 |
| Диметилсульфоксид | 4.02 | 46.5 | 1.996 |
| Пропиленкарбонат | 4.98 | 65.0 | 2.51 |
| Сульфолан | 4.80 | 43.3 1 | 10.286 1 |
| Гексаметилфосфортриамид | 5.37 | 29.7 | 3.227 |
|
|
|
1 30 оС.
В таких растворителях, в противоположность спиртам, анионы с локализованным зарядом (F–, OH–, R–COO–) сольватированы плохо, поскольку растворитель не может быть донором водородной связи, а крупные анионы, такие как иодид, иод-иодид, перхлорат, тиоцианат, пикрат, тетрафенилборат и другие органические ионы с делокализованным зарядом сольватированы, как правило, хорошо.
I–, I3–, ClO4–, SCN–, C6H2(NO2)3O–, B(C6H5)4–
Такие анионы характеризуются достаточно высокой поляризуемостью, в них распределение электронной плотности может сравнительно легко изменяться, и высокий дипольный момент молекул растворителя способствует сольватации таких анионов за счет неспецифических ван-дер-ваальсовых, главным образом дисперсионных взаимодействий.
Эти растворители получили особенно широкое распространение, начиная с 60-х годов прошлого столетия благодаря тому, что множество химических реакций протекают в них гораздо быстрее и эффективнее, чем в других средах. Поэтому в те годы диметилсульфоксид, диметилформамид и некоторые другие такие растворители даже называли «суперрастворителями», чтобы подчеркнуть новые возможности, открывающиеся при их применении.
Прочие растворители можно условно разделить на три группы: растворители с явно выраженными кислыми либо оснóвными свойствами, а также малополярные («инертные», неполярные апротонные, неполярные НДВС). Некоторые типичные представители даны в таблице 4.
Т а б л и ц а 4.
Физические характеристики кислых, оснóвных
и малополярных растворителей (25 оС)
| Растворитель | 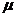 , Д , Д
| 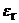
| 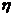  103, Па с 103, Па с
|
| Кислые: | |||
| Муравьиная кислота | 1.77 | 56.1 | 1.621 |
| Уксусная кислота | 1.73 | 6.2 | 1.13 |
| Оснóвные: | |||
| Этилендиамин | 1.90 | 12.9 | 1.54 |
| Пиридин | 2.37 | 12.3 | 0.884 |
| «Инертные» (малополярные): | |||
| 1,2-Дихлорэтан | 10.36 | ||
| Трихлорметан | 1.12 | 4.89 | 0.540 |
| Этилацетат | 6.02 | ||
| 1,4-Диоксан | 2.21 | ||
| Бензол | 2.27 | ||
| н-Гексан | 1.88 |
Важными характеристиками растворителей являются значения плотности энергии когезии и внутреннего давления жидкости.
Когезией называется явление сцепления молекул, находящихся в одной фазе. Поскольку при испарении жидкости все связи между молекулами разрываются, энергия когезии характеризуется теплотой испарения, 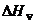 . Плотность энергии когезии,
. Плотность энергии когезии, 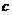 , вычисляется по формуле:
, вычисляется по формуле:
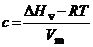 .
.
Здесь 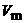 – мольный объем, а поправка RT показывает, что часть энергии расходуется на удаление испарившихся молекул на бесконечное расстояние друг от друга.
– мольный объем, а поправка RT показывает, что часть энергии расходуется на удаление испарившихся молекул на бесконечное расстояние друг от друга.
Внутреннее давление, 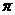 , характеризует изменение полное энергии жидкости,
, характеризует изменение полное энергии жидкости, 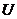 , при сжатии и вычисляется по формуле:
, при сжатии и вычисляется по формуле:
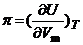 .
.
Параметры 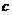 и
и 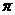 имеют размерность давления, выражаются в мегапаскалях и в некоторых (но далеко не во всех) случаях близки по численному значению. В таблице 5 представлены значения
имеют размерность давления, выражаются в мегапаскалях и в некоторых (но далеко не во всех) случаях близки по численному значению. В таблице 5 представлены значения 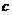 и
и 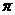 некоторых растворителей. Из этих данных следует, что серьезные расхождения в значениях этих двух параметров наблюдаются в ДВС-растворителях – в спиртах и, особенно – в воде. Этот факт лишний раз подчеркивает важность водородных связей для сцепления молекул друг с другом в жидкой фазе.
некоторых растворителей. Из этих данных следует, что серьезные расхождения в значениях этих двух параметров наблюдаются в ДВС-растворителях – в спиртах и, особенно – в воде. Этот факт лишний раз подчеркивает важность водородных связей для сцепления молекул друг с другом в жидкой фазе.
Донорами водородных связей могут быть не только вода, спирты, фенолы и кислоты. Так, замещение нескольких атомов водорода атомами галогенов может настолько ослабить остающиеся связи C–H в молекуле углеводорода, что атом водорода может приобретать некоторые признаки «кислых» свойств. Это относится, в частности, к трихлорметану (хлороформу).[6]
Т а б л и ц а 5
Значения плотности энергии когезии и внутреннего давления при 20 оС
| Растворитель | 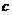 , МПа , МПа
| 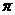 , МПа , МПа
|
| 1,4-Диоксан | 402 | 499 |
| Тетрахлорметан | 312 | 345 |
| Бензол | 357 | 379 |
| Ацетон | 398 | 337 |
| Ацетонитрил | 590 | 379 |
| Этанол | 703 | 291 |
| Метанол | 887 | 285 |
| Вода (25 оС) | 2302 | 151 |
Распространенной характеристикой растворителя является так называемый параметр Гильдебранда: корень квадратный из плотности энергии когезии: 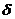 =
= 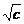 , МПа ½.
, МПа ½.
До сих пор речь шла об отношении растворителей к анионам. Отношение к катионам определяется электронодонорной способностью молекул растворителя. Мерой этой способности может служить стандартная энтальпия равновесия реакции донора электронной пары (т. е. основания Бренстеда) с акцептором электронной пары.
Такими акцепторами электронной пары могут быть так называемые кислоты Льюиса (L-кислоты). В противоположность привычным протонным кислотам, или H-кислотам, американский химик Дж. Льюис выдвинул представления об апротонных кислотах,[7] предоставляющих вакантную орбиталь для неподеленной электронной пары основания:
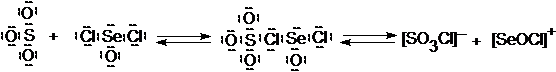
Кислотами Льюиса являются также AlCl3, FeCl3, SnCl4, SbCl5, катионы металлов и другие ионы и молекулы.
Позже австрийский химик В. Гутман предложил в качестве количественной характеристики электронодонорных свойств так называемые донорные числа (Donor Numbers, DN), выбрав в качестве стандартной кислоты Льюиса пентахлорид сурьмы (строение внешней электронной оболочки атома сурьмы 5s25p3):
D: + SbCl5  D:SbCl5
D:SbCl5
По определению, донорное число равно энтальпии этой реакции при комнатной температуре в 1,2-дихлорэтане, выраженной в ккал/моль и взятой с противоположным знаком: DN = 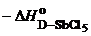 (ккал/моль).
(ккал/моль).
Наличие следов воды может привести к гидролизу SbCl5, поэтому растворитель и реагенты должны быть тщательно осушены. Некоторые численные значения DN представлены в Таблице 6. Используются также безразмерные нормированные донорные числа, DNN, отнесенные к донорному числу гексаметилфосфортриамида.
Т а б л и ц а 6
Дата добавления: 2018-05-09; просмотров: 441; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
