СООТНОШЕНИЯ МЕЖДУ РАЗЛИЧНЫМИ СИСТЕМАМИ ЕДИНИЦ
Nbsp; ВВЕДЕНИЕ В ФИЗИЧЕСКУЮ ХИМИЮ НЕВОДНЫХ РАСТВОРОВ Н. О. Мчедлов-Петросян Учебно-методическое пособие для студентов III курса химического факультета
Аннотация
Summary
INTRODUCTION TO THE PHYSICAL CHEMISTRY OF NONAQUEOUS SOLUTIONS
N. O. Mchedlov-Petrossyan
Kharkov V. N. Karazin National University, Kharkov, Ukraine
ПРЕДИСЛОВИЕ
В курсах общей и неорганической, аналитической и физической химии многие важные процессы, протекающие в растворах (кислотно-основные и окислительно-восстановительные реакции, комплексообразование), рассматриваются главным образом на примере водных растворов. В условиях сокращения лекционных часов, как правило, не хватает времени для подробного рассмотрения особенностей неводных растворов.
Между тем, именно разнообразие свойств неводных растворителей позволяет успешно решать множество проблем современной химии. Этим в значительной мере объясняется и чрезвычайно широкое использование богатого арсенала неводных, прежде всего – органических растворителей в сегодняшней повседневной практике.
Положения и закономерности, находившиеся еще 20-40 лет тому назад в стадии разработки, давно и прочно вошли в обиход современной химии, но зачастую так и не становились известными многим выпускникам химического факультета. Восполнение этого пробела и было целью настоящего небольшого курса, введенного в программу по предложению кафедры физической химии.
Настоящее пособие основано на лекциях, прочитанных студентам третьего курса химического факультета Харьковского национального университета имени В. Н. Каразина в 2007–2011 годах.
Автор ни в коем случае не стремился рассмотреть все особенности поведения неводных растворов, да это и невозможно. Не было также смысла приводить в этой брошюре значения многочисленных параметров, характеризующих органические растворители, поскольку соответствующие данные можно при необходимости найти в справочниках и в оригинальной научной литературе. Казалось более важным дать самые общие представления о разнообразии воздействия различных типов неводных растворителей на протекание химических реакций и физико-химических процессов, иллюстрируя их лишь тем минимумом численных данных, который позволит на первых порах ориентироваться в джунглях, называющихся «химия неводных растворов».
ЗНАЧЕНИЯ НЕКОТОРЫХ ВАЖНЫХ КОНСТАНТ
Диэлектрическая постоянная вакуума 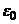 = 8.8542
= 8.8542 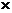 10–12 Ф м–1;
10–12 Ф м–1;
(1 Ф = Кл2 Дж–1 = Кл В–1)
Элементарный электрический заряд 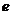 = 1.602
= 1.602 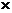 10–19 Кл
10–19 Кл
Число Авогадро 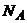 = 6.022
= 6.022 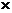 1023 моль–1
1023 моль–1
Число Фарадея F = 96 487 Кл моль–1
Постоянная Планка 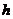 = 6.6256
= 6.6256 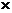 10–34 Дж с
10–34 Дж с
Газовая постоянная R = 8.3143 Дж моль–1 К–1
Постоянная Больцмана 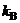 = R (
= R ( 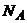 )–1 = 1.38054
)–1 = 1.38054  10–23 Дж К–1
10–23 Дж К–1
Скорость света в вакууме 2.997925  108 м с–1
108 м с–1
СООТНОШЕНИЯ МЕЖДУ РАЗЛИЧНЫМИ СИСТЕМАМИ ЕДИНИЦ
1 Дж = 0.2390 кал
1 кал = 4.184 Дж
1 Н = 105 дин
1 атм = 1.01325 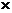 105 Па
105 Па
1 эв = 1.602 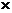 10–19 Дж
10–19 Дж
1 см–1 = 11.931 Дж моль–1
R = 8.3143 Дж моль–1 К–1 = 8.3143 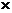 107 эрг моль–1 К–1 = 0.082057 л атм моль–1 К–1
107 эрг моль–1 К–1 = 0.082057 л атм моль–1 К–1
СОДЕРЖАНИЕ
1. Введение
2. Важнейшие физико-химические характеристики и классификация неводных растворителей
3. Влияние растворителей на электронные спектры поглощения. Сольватохромия
4. Очистка растворителей и меры предосторожности при работе с ними
5. Электролиты в растворах
6. Транспортные свойства ионов в неводных растворах
7. Протолитические равновесия
8. Сольватация и растворимость неэлектролитов
9. Электрохимические элементы и редокс-процессы в неводных средах
10. Влияние растворителей на скорость химических реакций
11. Сравнение данных о константах равновесий в различных растворителях
Рекомендованная литература
CONTENTS
1. Introduction
2. The characterization of the principal physico-chemical properties and the classification of nonaqueous solvents
3. The influence of the solvents on the electronic absorption spectra. Solvatochromism
4. The purification of solvents and precautions on working with them
5. Electrolytes in solution
6. Transport properties of ions in nonaqueous solvents
7. Protolytic equilibria
8. Solvation and solubility of nonelectrolytes
9. Electrochemical cells and redox processes in nonaqueous media
10. The influence of the solvents on the rates of chemical reactions
11. The comparison of equilibrium constants in different solvents
The recommended literature
ВВЕДЕНИЕ
В настоящее время считается, что около 99% всех изученных химических реакций протекают в жидкой фазе. В этом отношении положение вещей мало изменилось со времен Аристотеля, которому приписывается утверждение:
Дата добавления: 2018-05-09; просмотров: 427; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
