Работа 5.4. ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ ОКИСЛЕНИЯ ИОДИД-ИОНОВ ИОНАМИ ТРЁХВАЛЕНТНОГО ЖЕЛЕЗА
ФОТОМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы - Определение порядков реакции по реагентам, исследование влияния ионной силы раствора на константу скорости реакции фотометрическим методом.
Оборудование: Фотометр, секундомер, штатив с бюретками, стаканы 50 мл, кюветы, фильтровальная бумага.
Реактивы: Fe(NO3)3 •4 Н2О, KI, KNO3, дистиллированная вода.
Реакции в растворах и особенно реакции с участием ионов отличаются от газофазных реакций наличием взаимодействия реагирующих частиц с молекулами растворителя и друг с другом. Большое влияние на скорость реакции между ионами оказывает присутствие других электролитов. Состояние (активность) ионов в растворе зависит от зарядов и концентраций всех ионов в растворе. Для количественной характеристики этого фактора используется ионная сила раствора J
 5.48
5.48
здесь Сm,i – моляльная концентрация i-иона, zi – его заряд.
Для смеси электролитов ионная сила рассчитывается как сумма J всех электролитов, например, для раствора состоящего из трех электролитов
Jсмеси = Jl + J2 + J3 .
Ионная сила отдельного электролита зависит от числа катионов и анионов. Используя уравнение 5.48, нетрудно показать, что ионная сила 1-1- электролита равна его моляльности ( Сm) , а 2-2-электролита - 4Сm и т.д.. Например, для 1-2 электролита

Таблица 5.4.1.
| Тип электролита (число катионов- число анионов) | 1-1 | 1-2 или 2-1 | 2-2 | 1-3 или 3-1 |
| J | J1-1=Cm | J1-2=3Cm | J2-2=4Cm | J1-3=6Cm |
|
|
|
Теория сильных электролитов дает следующее приближение для зависимости коэффициента активности ионов от ионной силы раствора:
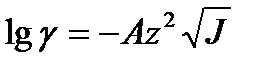 5.49
5.49
где А –постоянная, равная для водных растворов при 298 К примерно 0,509 (А пропорциональна радиусу иона). Выражение 5.49 называют предельным законом Дебая-Гюккеля.
Рассмотрим бимолекулярную реакцию
А + В ↔ АВ* => продукты 5.50
протекающую в растворе через стадию образования промежуточного вещества (активированного комплекса АВ*). В случае неидеального раствора константу равновесия между исходными веществами и активированным комплексом следует выразить через активности
 5.51
5.51
Константа скорости реакции (5.50) по теории активированного комплекса равна:
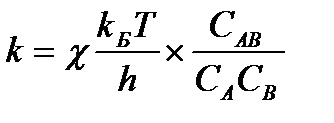 5.52,
5.52,
где kБ - константа Больцмана, h - постоянная Планка, Т - абсолютная температура, С - концентрация, χ - трансмиссионный коэффициент (χ < 1), который представляет собой вероятность того, что потенциальный барьер реакции будет преодолен, то есть АВ* → продукты.
|
|
|
Выразив СAB* / СAСв из уравнения (5.51) и подставив его в уравнением (5.52), получим уравнение Бренстеда-Бьеррума:
 или
или  5.53
5.53
После подстановки соответствующих коэффициентов активности с учетом уравнения (5.49) для реакции
А zА + В zB <=> (AB*)zA+zB => продукты
получаем:
 5.54
5.54
или
 5.55
5.55
Следовательно, логарифм константы скорости при взаимодействии заряженных частиц (ионов) должен быть линейной функцией корня квадратного от ионной силы раствора.
Величина k* имеет смысл константы скорости реакции, протекающей в идеальной системе, например, для ионной реакции при бесконечном разведении, когда γ = 1.
Для проверки уравнения (5.55) экспериментальные значения константы скорости реакции k, рассчитанные с учетом порядков реакции в соответствие с уравнением (5.14)  , представляют в виде зависимости In k от
, представляют в виде зависимости In k от 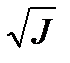 , которая должна быть линейной.
, которая должна быть линейной.
Порядок выполнения работы:
1. Приготовить растворы:0,03 М Fe(NO3)3, 0,05 М KI, 0,1 М HNO3, 0,1 М KNO3, дистиллированная вода. Для приготовления 100 мл растворов солей взвешивают 0,94 г (Fe(NO3)3 •4 Н2О), 0,83 г (KI), 1,01 г (KNO3). Указанные навески подтвердить расчетом.
2. Подготовить штатив с 4 бюретками для растворов HNO3, KNO3, KI и Н2О. Раствор Fe(NO3)3 наливают пипеткой из колбы, стараясь избежать попадания в пипетку осадка, который в небольшом количестве может образоваться при растворении нитрата железа.
|
|
|
3. Включить фотометр и произвести настройку нуля. В ходе реакции измеряют коэффициент пропускания раствора Т%, который уменьшается со временем (образующийся в реакции йод окрашивает бесцветный раствор в желтый цвет). Кинетические зависимости реакции представляют как изменение оптической плотности раствора D, которая связана с коэффициентом пропускания
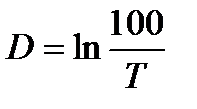 5.56
5.56
В соответствие с законом Бугера-Ламберта-Беера для не слишком концентрированных растворов оптическая плотность есть линейная функция концентрации вещества (С), то есть:
D = ECx 5.57
где Е - молярный коэффициент поглощения или экстинция, х - толщина слоя анализируемого раствора (длина кюветы фотометра х =1 см).
I. Определение порядков реакции по реагентам реакции 2Fe+3 + 2I- → 2Fe+2 + I2.
а) Определение порядка реакции по отношению к Fе+3.
1. Поскольку на скорость реакции между ионами влияет ионная сила раствора J, то для поддержания постоянной величины J, а также для подавления гидролиза Fe+3 в реакционную смесь добавляют растворы HNO3 и KNO3. Рассчитайте ионную силу реакционных растворов, используя таблицу 5.4.1. и учитывая разбавление. Во всех опытах объем реакционной смеси равен 10 мл. Пример расчета для реакционного раствора №2:
|
|
|
HNO3 KNO3 Fe(NO3)3 KJ
J(№2 )= 0,1x 1/10 + 0,1 x 2/10 + 6 x 0,03 x 1/10 + 0,05 x 2/10.
2. В четыре стаканчика налить растворы Fe(NO3)3 , HNO3 и KNO3 и дистиллированную воду в соотношениях указанных в табл. 5.4.2а. В первый раствор добавить 2 мл 0,05 М KI, раствор быстро перемешать, включить секундомер, заполнить кювету фотометра реакционной смесью и определить пропускание раствора Т % с интервалом в одну минуту в течение 8 минут. Данные записать в таблицу 5.4.2а.
3. Провести аналогичные кинетические опыты с другими растворами.
4. Построить кинетические зависимости D=f(t). Эти зависимости криволинейные, поэтому для определения начальной скорости реакции их необходимо представить в линейных координатах 1/D - 1/t , из которых найти тангенс угла наклона, а затем начальную скорость реакции
 ( см. ниже tg α = a ). Действительно, если форма кинетической кривой удовлетворяет уравнению
( см. ниже tg α = a ). Действительно, если форма кинетической кривой удовлетворяет уравнению
 5.58,
5.58,
или  5.58*
5.58*
то после дифференцирования dD/dt = а / (а+bt)2 находим начальную скорость реакции
 5.59
5.59
Рассчитанная скорость реакции выражена в условных единицах - W(D). Для нахождения W (моль/л•мин) требуется от кинетических зависимостей D=f(t) перейти к зависимости C=f(t). Это можно сделать, если известна величина экстинции Е из справочника или из специально полученного калибровочного графика, связывающего С (в моль/л) и D. В данной работе такая калибровка не производится.
б) Определение порядка реакции по отношению к I-.
1. Приготовить четыре смеси с растворами KI, HNO3, KNO3 и дистиллированной водой, взятых в указанных в таблице 5.4.2б количествах.
2. Добавить в первую смесь 2 мл 0,03 М раствора Fe(NO3)3 , перемешать и отметить начало реакции (включить секундомер). Раствор быстро налить в кювету фотометра и измерять пропускание (Т%) реакционного раствора в течение 8 минут.
3. Аналогичные опыты провести со всеми растворами 1-4.
4. Построить кинетические зависимости D = f(t) и зависимости 1/D = f (1/t), из которых рассчитать начальные скорости реакции Wo (в условных
величинах) для всех четырех растворов.
Таблица 5.4.2а
Растворы и их состав (объемы электролитов V, мл)
| Растворы | №1 | №2 | №3 | №4 | |||||||||
| Fe(NO3)2 | 0,5 | 1,0 | 1,5 | 2,0 | |||||||||
| HNO3 | 1 | 1 | 1 | 1 | |||||||||
| KNO3 | 3,0 | 2,0 | 1,0 | 0,3 | |||||||||
| Н2О | 3,5 | 3,0 | 4,0 | 4,7 | |||||||||
| Кинетика реакции после добавления 2 мл 0,05 М KI: Со (I-) =……. | |||||||||||||
| t | 1/t | T | D | 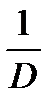
| T | D | 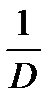
| T | D | 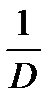
| T | D | 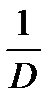
|
| 1 | |||||||||||||
| 2 | |||||||||||||
| 3 | |||||||||||||
| 4 | |||||||||||||
| 5 | |||||||||||||
| 6 | |||||||||||||
| 7 | |||||||||||||
| 8 | |||||||||||||
| Wo (D) |
|
|
|
| |||||||||
| lnWo |
|
|
|
| |||||||||
| Co (Fe3+) |
|
|
|
| |||||||||
| lnCo |
|
|
|
| |||||||||
| J |
|
|
|
| |||||||||
| Порядок реакции: n (Fe3+) = …… | |||||||||||||
5. По результатам таблиц 5.4.2 построить графики:
а)  и
и 
 ;
;
б)  и
и 
 .
.
6. Порядки реакции по соответствующему реагенту определить по методу Вант-Гоффа, как тангенс угла наклона зависимостей In Wo - In Co. Порядок реакции в целом равен n = n (Fe+3) + n (I-).
Примечание.Для не слишком концентрированных растворов при расчете ионной силы J вместо моляльнои концентрации можно использовать молярную концентрацию.
Таблица 5.4.2б
Растворы и их состав (объемы электролитов V, мл)
| Растворы | №1 | №2 | №3 | №4 | |||||||||
| KI | 1 | 2 | 3 | 4 | |||||||||
| HNO3 | 1 | 1 | 1 | 1 | |||||||||
| KNO3 | 2,5 | 2,0 | 1,5 | 1,0 | |||||||||
| Н2О | 3,5 | 3,0 | 2,5 | 2,0 | |||||||||
| Кинетика реакции после добавления 2мл 0,03М Fe(NO3)3 : Со (Fe3+) =……. | |||||||||||||
| t | 1/t | T | D | 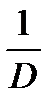
| T | D | 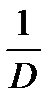
| T | D | 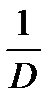
| T | D | 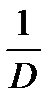
|
| 1 | |||||||||||||
| 2 | |||||||||||||
| 3 | |||||||||||||
| 4 | |||||||||||||
| 5 | |||||||||||||
| 6 | |||||||||||||
| 7 | |||||||||||||
| 8 | |||||||||||||
| Wo (D) |
|
|
|
| |||||||||
| lnWo |
|
|
|
| |||||||||
| Co (Fe3+) |
|
|
|
| |||||||||
| lnCo |
|
|
|
| |||||||||
| J |
|
|
|
| |||||||||
| Порядок реакции: n (I-) = …… | |||||||||||||
6. Анализ механизма реакции.Сравнить экспериментальные порядки реакции с порядками кинетического уравнения, полученного теоретически в предположении следующего механизма реакции :
1)  ;
;
2)  5.60
5.60
Реакция протекает в две стадии с константами  (константа равновесия стадии 1) и k2 - для стадии 2.
(константа равновесия стадии 1) и k2 - для стадии 2.
Кинетическое уравнение реакции можно получить двумя способами. В первом способе можно предположить, что стадия 2- лимитирующая. Такой анализ приведен в лабораторной работе №5.2 «Изучение кинетики гомогенного каталитического разложения перекиси водорода на К2Сг2О7». Получите кинетическое уравнение по аналогии.
Часто промежуточное вещество находится не в равновесии с исходными веществами, а устанавливается лишь стационарное состояние, при котором скорость образования промежуточного продукта равна скорости его расходования. По второму способу анализа реакции к промежуточному веществу I2-можно применить условие стационарности , то есть dI2-/dt =0.
II. Определение зависимости константы скорости реакции от ионной силы раствора.
1. Приготовить четыре смеси растворов Fe(NO3)3, HNO3 и KNO3 в соотношениях указанных в табл.5.4.3. После добавления в смесь 2 мл KI раствор перемешать, включить секундомер, быстро заполнить кювету фотометра и измерить пропускание.
2. Получить зависимости D = f(t) и 1/D = f(l/t), из которых определить начальные скорости реакции Wo.
3. Рассчитать ионную силу реакционных растворов J.
4. По уравнению  (5.8) с учетом порядков реакции по реагентам, полученных в задании №1, найти константы скорости реакции k и Ink.
(5.8) с учетом порядков реакции по реагентам, полученных в задании №1, найти константы скорости реакции k и Ink.
5. Построить зависимость Ink от  . Эта зависимость должна быть линейной с тангенсом угла наклона, равным 1,02 zAzB (см. уравнение 5.55). Сравнить рассчитанный и полученный графически тангенс. Линейная зависимость Ink -
. Эта зависимость должна быть линейной с тангенсом угла наклона, равным 1,02 zAzB (см. уравнение 5.55). Сравнить рассчитанный и полученный графически тангенс. Линейная зависимость Ink -  , как правило, хорошо выполняется. При высоких концентрациях реагентов возможно расхождение между теоретическими и опытными данными, что связано с отклонениями от закона Бутера-Ламберта-Беера (5.56).
, как правило, хорошо выполняется. При высоких концентрациях реагентов возможно расхождение между теоретическими и опытными данными, что связано с отклонениями от закона Бутера-Ламберта-Беера (5.56).
Таблица 5.4.3
Влияние ионной силы раствора на константу скорости реакции 2 Fe(NO3)3 + 2 KI = 2 Fe(NO3)2 + 2 KNO3+ I2
Растворы и их состав (объемы электролитов V, мл)
| Растворы | №1 | №2 | №3 | №4 | |||||||||
| Fe(NO3)3 | 1 | 1 | 1 | 1 | |||||||||
| HNO3 | 1 | 1 | 1 | 1 | |||||||||
| KNO3 | 2,5 | 2,0 | 3,5 | 5,0 | |||||||||
| Н2О | 5,5 | 4,0 | 2,5 | 1,0 | |||||||||
| Кинетика реакции после добавления 2мл 0,05 М KI : Со (Fe3+) =……. Со (I-) =……. | |||||||||||||
| t | 1/t | T | D | 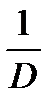
| T | D | 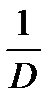
| T | D | 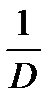
| T | D | 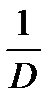
|
| 1 | |||||||||||||
| 2 | |||||||||||||
| 3 | |||||||||||||
| 4 | |||||||||||||
| 5 | |||||||||||||
| 6 | |||||||||||||
| 7 | |||||||||||||
| 8 | |||||||||||||
| Wo (D) |
|
|
|
| |||||||||
| lnWo |
|
|
|
| |||||||||
| k |
|
|
|
| |||||||||
| lnk |
|
|
|
| |||||||||
| J |
|
|
|
| |||||||||
|
|
|
|
|
| |||||||||
Примечание: Если порядки реакции по Fe3+ и I- не определены, то проверяют зависимость начальной скорости реакции от ионной силы раствора по графику In Wo -  . В этом случае уравнение
. В этом случае уравнение  (5.55) можно представить как
(5.55) можно представить как
 или
или

КОНТРОЛЬНЫЕ ВОПРОСЫ К РАБОТЕ 5.4
Перед выполнением работы:
1. К какому типу реакций относится исследуемая реакция окисления иодид-ионов ионами Fe+3 (по молекулярное, обратимости, реакция сложная или простая, каталитическая или некаталитическая и т.д.)? С какой целью
в реакционную смесь добавляют растворы HNO3 и KNO3?
2. Назовите методы определения порядков реакции. Какие требуются экспериментальные данные?
3. Как определяется количество йода, образующегося в ходе реакции ?
4. Как рассчитываются начальная скорость реакции и константа скорости реакции?
5. С чем связано влияние состава реакционной смеси (присутствия других электролитов) на константу скорости реакции?
6. Нарисуйте (схематично) зависимость константы скорости реакции между ионами для а) взаимодействия двух катионов, б) двух анионов, в) катиона и аниона.
К защите работы:
1. Сформулируйте закон действующих масс. Каков физический смысл константы скорости реакции ?
2. Почему скорость химической реакции максимальна при стехиометрическом соотношении компонентов ?
3. Приведите примеры простых и сложных реакций. Что понимают под механизмом сложной реакции?
4. В чем заключается метод стационарных концентраций? Какая стадия реакции называется лимитирующей?
5. Почему на константу скорости реакции оказывает влияние ионная сила раствора (J)? Как рассчитывается значение J?
6. Какой физический смысл имеют параметры линейной регрессии а и b уравнения  ?
?
С О Д Е Р Ж А Н И Е
| ТЕХНИКА БЕЗОПАСНОСТИ | 3 | |
| 1 | ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ | 5 |
| 1.1 | Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита. | 15 |
| 1.2 | Определение константы диссоциации слабого электролита методом электропроводности. | 16 |
| 1.3 | Кондуктометрическое титрование. | 17 |
| 1.4 | Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения. | 18 |
| 2 | ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ | 22 |
| 2.1 | Измерение ЭДС медно-цинкового гальванического элемента. | 42 |
| 2.2 | Измерение электродных потенциалов медного и цинкового электродов. | 43 |
| 2.3 | Измерение ЭДС концентрационных гальванически элементов. | 44 |
| 2.4 | Измерение окислительно-восстановительных потенциалов. | 45 |
| 2.5 | Определение рН и буферной емкости буферных систем. | 46 |
| 2.6 | Расчет термодинамических величин для ОВР гальванического элемента на основе справочных данных по ЭДС и ее температурному коэффициенту для этого гальванического элемента. | 47 |
| 3 | АДСОРБЦИЯ | 49 |
| 3.1 | Изучение адсорбции паров воды на твердом адсорбенте. | 63 |
| 3.2 | Изучение адсорбции уксусной кислоты и водного раствора на активированном угле. | 67 |
| 3.3 | Изучение адсорбции поверхностно-активны веществ (ПАВ) на границе раствор-водух. | 72 |
| 4 | ГАЗОВАЯ ХРОМАТОГРАФИЯ | 79 |
| 4.1 | Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон. | 88 |
| 4.2 | Определение мольных теплот растворения нормальных углеводородов C6- C9 в апьезоне хроматографическим методом. | 92 |
| 4.3 | Определение индексов Ковача веществ и их температурных коэффициентов на апьезоне. | 95 |
| 5. | ХИМИЧЕСКАЯ КИНЕТИКА | 98 |
| 5.1 | Кинетика омыления этилацетата в присутствии ионов гидроксила. | 109 |
| 5.2 | Изучение кинетики гомогенно-каталитического разложения Н2О2 . | 113 |
| 5.3 | Изучение кинетики инверсии сахарозы. | 123 |
| 5.4 | Изучение кинетики реакции окисления иодид-ионов ионами трехвалентного железа фотометрическим методом. | 132 |
Дата добавления: 2018-04-15; просмотров: 1523; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

