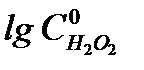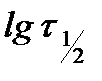C. Варианты задания и методика расчетов.
I. Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
Исходные данные:
концентрация Н2О2 – 0,15 моль/л;
концентрация K2Cr2O7 – 0,02; 0,04; 0,06; 0,08 моль/л;
температура – комнатная.
Порядок проведения опыта:
1. Подготовить реактор к работе, как описано выше п.п.А. 6-8.
2. Провести кинетический опыт (см. п.п. В) и получить зависимость количества выделившегося кислорода от времени. Результаты записать в таблицу 5.2.1.
3. Провести аналогичные измерения для разных исходных концентраций катализатора. Количество перекиси водорода во всех опытах не изменяется. Построить кинетические кривые в координатах 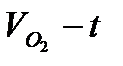 .
.
4. Рассчитать максимальный объём кислорода (в мл), который может выделиться при полном разложении 15 мл 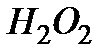 данной концентрации по формуле 5.35.
данной концентрации по формуле 5.35.
5. Рассчитать объем кислорода, который выделяется при разложении половины исходного количества 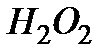
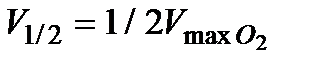 .
.
6. Из графиков для каждой кинетической кривой определить время полупревращения 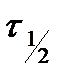 и величину
и величину 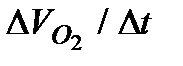 .
.
7. Рассчитать скорость реакции 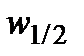 в момент времени
в момент времени 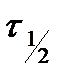 по формуле (5.36). Результаты вычислений записать в таблицу 5.2.2.
по формуле (5.36). Результаты вычислений записать в таблицу 5.2.2.
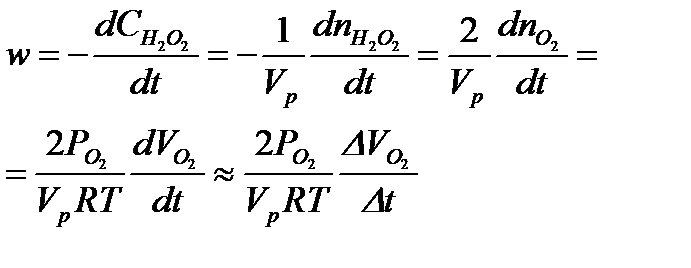 5.36
5.36
Таблица 5.2.2.
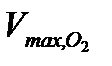 = ……….
= ………. 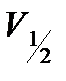 = …………….
= …………….
| № опыта | 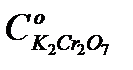
| 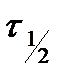
| 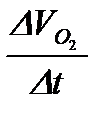
| 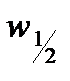
|
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 |
Графическое дифференцирование проводится по схеме, показанной на рисунке 5.7.
|
|
|
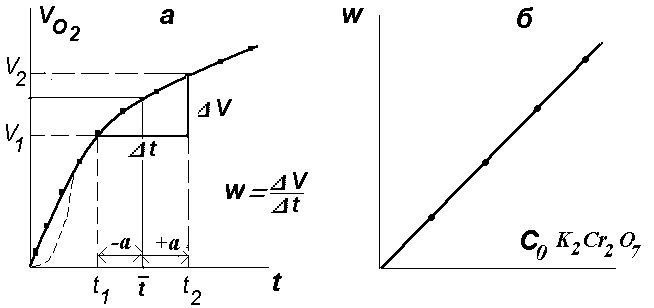
Рисунок 5.7 . а - графическое определение скорости реакции разложения Н2О2 , б - зависимость скорости реакции от начальной концентрации катализатора
8. Построить график зависимости 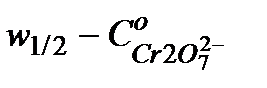 .
.
II. Влияние начальной концентрации Н2О2на период полупревращения. Определение порядка реакции.
Порядок реакции можно определить по времени полупревращения 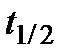 перекиси водорода. Скорость разложения
перекиси водорода. Скорость разложения 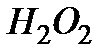 описывается уравнением:
описывается уравнением:
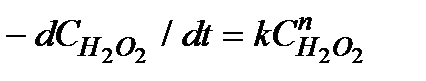 5.37
5.37
Интегрируя это выражение, получим:
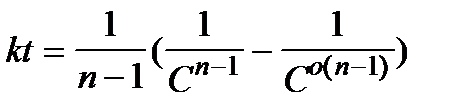
При 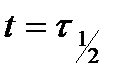 ,
, 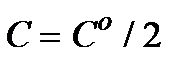 и
и 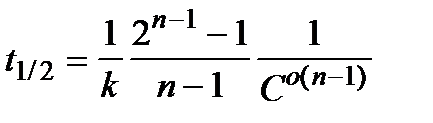 или
или 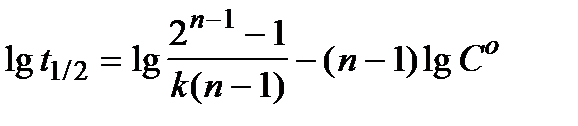 5.38
5.38
Если имеются значения 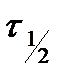 для различных исходных концентраций перекиси водорода
для различных исходных концентраций перекиси водорода 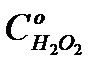 , то в координатах
, то в координатах 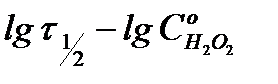 получают линейную зависимость, позволяющую определить порядок реакции n. Тангенс угла наклона данной прямой равен (1 - n).
получают линейную зависимость, позволяющую определить порядок реакции n. Тангенс угла наклона данной прямой равен (1 - n).
Исходные данные:
концентрация Н2О2 – 0,3 моль/л;
концентрация K2Cr2O7 – 0,02 моль/л;
температура – комнатная.
Порядок проведения опыта:
1. Подготовить реактор к работе, как описано выше п.п.А. 6-8.
2. Провести 4 кинетических опыта (см. п.п. В) и получить зависимости количества выделившегося кислорода от времени для растворов с различной концентрацией Н2О2 и одинаковой концентрацией катализатора. Результаты записать в таблицу 5.2.3., в которой указаны составы реакционных смесей.
|
|
|
3. Расчитать исходные концентрации Н2О2 в реакторе 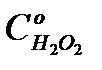 , величины
, величины 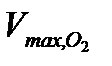 ,
, 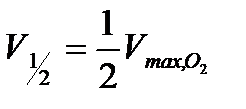 как описано в задании I. Из графика определить время полупревращения
как описано в задании I. Из графика определить время полупревращения 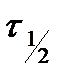 . Результаты записать в таблицу 5.2.3.
. Результаты записать в таблицу 5.2.3.
Таблица 5.2.3.
| № опыта | 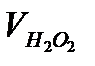
| 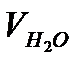
| 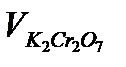
|
|
|
|
| n |
| Раствор 1 | Раствор 2 | |||||||
| 1 | 4 | 6 | 2 | |||||
| 2 | 6 | 4 | 2 | |||||
| 3 | 8 | 2 | 2 | |||||
| 4 | 10 | 0 | 2 | |||||
4. Построить линейную зависимость 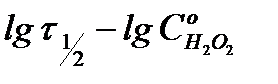 , определить тангенс угла наклона прямой
, определить тангенс угла наклона прямой 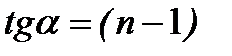 и вычислить величину порядка реакции.
и вычислить величину порядка реакции.
III. Определение константы равновесия 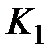 и константы скорости
и константы скорости 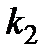 реакции разложения перекиси водорода.
реакции разложения перекиси водорода.
Для расчета константы равновесия 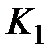 и константы скорости
и константы скорости 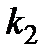 реакции используют уравнение (5.34).
реакции используют уравнение (5.34).
Уравнение (5.34) можно преобразовать в линейную форму, взяв обратное значение скорости:
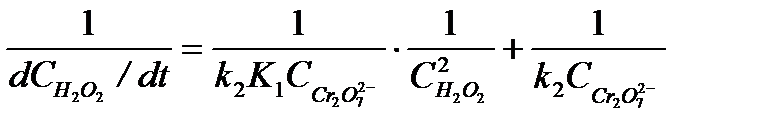 5.39
5.39
Из графика в координатах 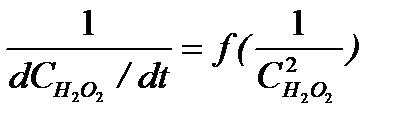 по тангенсу угла наклона прямой при известной исходной концентрации катализатора
по тангенсу угла наклона прямой при известной исходной концентрации катализатора 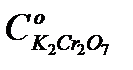 находят произведение k2K1, а по отрезку, отсекаемому на оси ординат, значение k2.
находят произведение k2K1, а по отрезку, отсекаемому на оси ординат, значение k2.
|
|
|
Порядок проведения опыта:
1. Провести кинетический опыт, как описано в п.п.А.1-8 (концентрации перекиси водорода и катализатора указываются преподавателем). Получить зависимость количества выделившегося кислорода от времени. Результаты записать в таблицу 5.2.1.
2. Построить кинетическую кривую в координатах 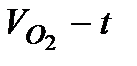 . Из кривой для 6-7 значений t графическим дифференцированием определить величину
. Из кривой для 6-7 значений t графическим дифференцированием определить величину 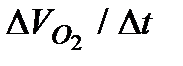 .
.
3. По формуле (5.36) вычислить скорость реакции 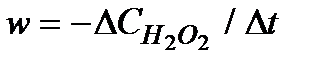 .
.
4. По формуле (5.35) рассчитать максимальный объем кислорода 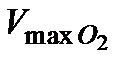 , который может выделиться при полном разложении
, который может выделиться при полном разложении 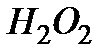 заданной концентрации.
заданной концентрации.
5. Учитывая, что концентрация перекиси водорода в момент времени t пропорциональна величине 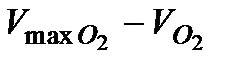 рассчитать концентрацию
рассчитать концентрацию 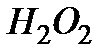 по формуле (5.40)
по формуле (5.40)
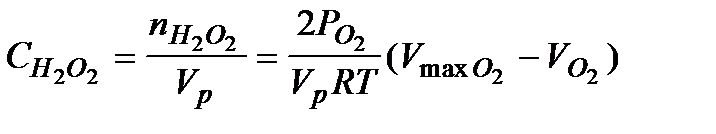 5.40
5.40
6. Результаты вычислений записать в таблицу 5.2.4. Построить зависимость 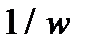 от
от 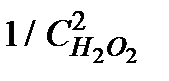 . Тангенс угла наклона прямой позволяет найти произведение
. Тангенс угла наклона прямой позволяет найти произведение 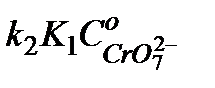 , а отрезок, отсекаемый на оси ординат, значение
, а отрезок, отсекаемый на оси ординат, значение 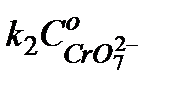 , см. уравнение (5.39). Из найденных произведений, зная концентрацию катализатора, найти величины
, см. уравнение (5.39). Из найденных произведений, зная концентрацию катализатора, найти величины 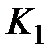 и
и 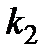 .
.
Таблица 5.2.4
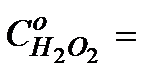 ……………….
………………. 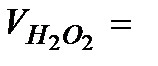 ……………….
……………….
|
|
|
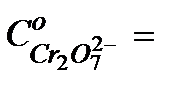 …………….
……………. 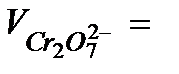 ……………..
……………..
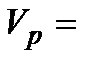 ……………………
…………………… 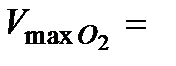 ……………….
……………….
| t,мин. | 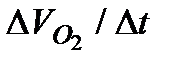
| 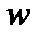
| 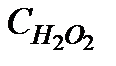
| 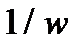
| 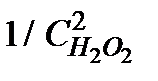
|
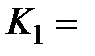 …………….
…………….
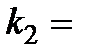 ……………
……………
КОНТРОЛЬНЫЕ ВОПРОСЫ К РАБОТЕ 5.2
Перед выполнением работы:
1. Расскажите последовательность подготовки системы к работе и порядок проведения опыта.
2. Какие концентрации рабочих растворов 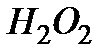 и растворов катализатора следует приготовить для работы?
и растворов катализатора следует приготовить для работы?
3. Как проверить установку на герметичность?
4. Как рассчитать максимально возможный объём кислорода, который может выделиться в результате разложения 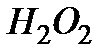 ?
?
5. Запишите реакции, протекающие в системе при разложении перекиси водорода раствором бихромата калия.
6. Как определить текущую концентрацию 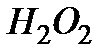 ?
?
7. Как рассчитать 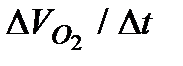 методом графического дифференцирования?
методом графического дифференцирования?
8. Как определить константу скорости и константу равновесия реакции разложения перекиси из экспериментальных данных?
К защите работы:
1. Дайте определение скорости реакции, порядка реакции. Поясните физический смысл константы скорости реакции.
2. Запишите кинетические уравнения необратимых реакций нулевого и второго порядка.
3. Запишите механизм разложения перекиси водорода в присутствии ионов 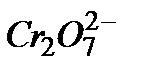 .
.
4. Каковы условия проведения реакции разложения 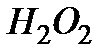 в присутствии бихромата калия по а) нулевому, б) второму порядку?
в присутствии бихромата калия по а) нулевому, б) второму порядку?
5. Перечислите известные вам виды катализа. В чем состоит особенность каталитических процессов?
6. Отразится ли на константе скорости реакции замена одного катализатора другим?
7. Как катализатор влияет на энергию активации данной реакции? Как графически моно определить энергию активации?
8. Объясните последовательность выполненных Вами расчетов.
Дата добавления: 2018-04-15; просмотров: 503; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!