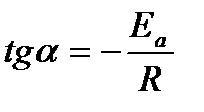Способы определения порядков реакции.
1. Графический метод Вант-Гоффа основан на построении зависимости w=f(С) в координатах Inw=f(lnC) или lgw=f(lgC). При логарифмировании кинетического уравнения w = k Сп получим
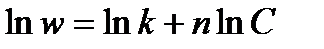 5.21
5.21
График зависимости должен быть прямой, тангенс угла которой равен порядку реакции.
Если реакция
исследуется методом избытка (например в избытке все вещества, кроме А1 и 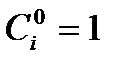 ), то определяется порядок по веществу А1:
), то определяется порядок по веществу А1:
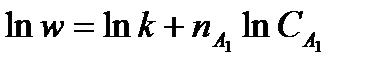 5.21*
5.21*
Уравнения (5.21) можно применить к зависимости начальной скорости от начальной концентрации lnwo - lnCo , полученной при постоянной начальной концентрации всех веществ, кроме А1, тогда при 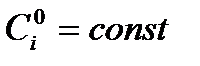
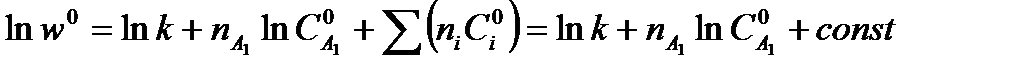
Можно, используя одну кинетическую кривую С=f(t) провести её графическое дифференцирование, определив скорость реакции для нескольких моментов времени t при текущей (изменяющейся) концентрации одного исходного вещества.
Таблица 5.1. Кинетические уравнения реакций различных порядков и их решения.
| Порядок реакции | Уравнение скорости | Кинетическое уравнение | Размерность константы скорости | Функция концентрации (с), линейно зависящая от времени | τ½ |
| 0 | 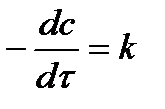
| 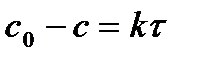
| 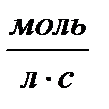
| с | 
|
| 1 | 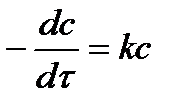
| 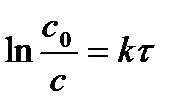
| с-1 | 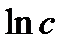
| 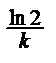
|
| 2 | 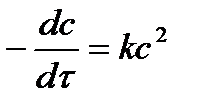
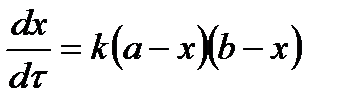
| 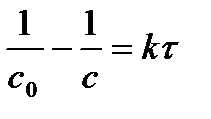
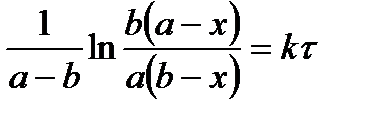
| 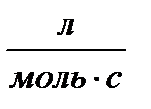
| 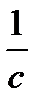
| 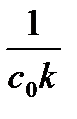
|
| 3 | 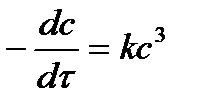
| 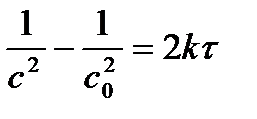
| 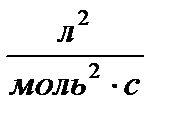
| 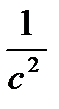
| 
|
| n | 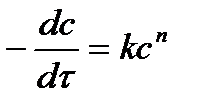
| 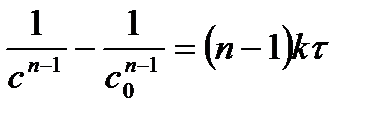
| 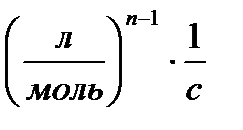
| 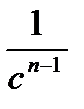
| 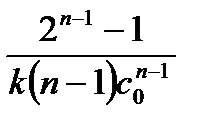
|
2. Способ постановки экспериментальных данных в уравнение скорости реакции первого, второго и третьего порядков. Если использование одного из уравнений дает постоянное значение константы скорости реакции, то реакция имеет соответствующий порядок. Часто более удобной бывает графическая поверка применимости кинетических уравнений, приведенных в таблице 5.1. Строятся различные функции концентрации, линейно зависящие от времени (см. пятый столбец табл.1). Отложив по оси абсцисс время реакции t, а на оси ординат In С, 1/С и 1/С2 получают три линии. Та из них, которая соответствует порядку данной реакции, будет прямой, остальные окажутся кривыми.
|
|
|
3. Метод Оствальда-Нойесаоснован на нахождении времени, в течение которого концентрация вещества изменяется (например, уменьшается) в
определённое число раз. Из решения кинетического уравнения скорости реакции n-порядка (табл.5.1) для времени уменьшения концентрации в х раз ( 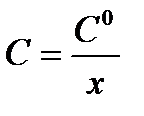 ) получим:
) получим:
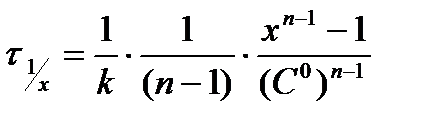 5.22
5.22
или 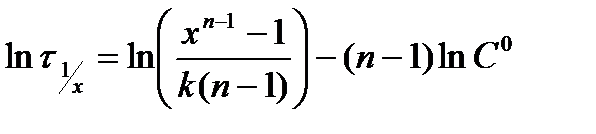 5.22*
5.22*
В координатах 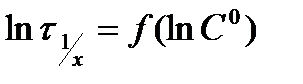 этому уравнению соответствует прямая линия, тангенс угла наклона которой равен (1 - n).
этому уравнению соответствует прямая линия, тангенс угла наклона которой равен (1 - n).
Частным случаем этого метода является определение порядка по зависимости периода полупревращения τ½ от начальной концентрации С0.
Зависимость скорости реакции от температуры
Скорость химической реакции существенно зависит от температуры. Так, увеличение температуры на 100 во многих случаях приводит к увеличению константы скорости гомогенной реакции в 2-4 раза, т.е.
|
|
|
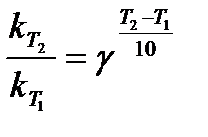 (правило Вант-Гоффа), 5.23
(правило Вант-Гоффа), 5.23
где 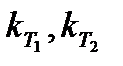 – константы скорости реакции при температурах Т1 и Т2; γ – температурный коэффициент.
– константы скорости реакции при температурах Т1 и Т2; γ – температурный коэффициент.
Это правило применяется для ориентировочных расчетов при невысоких температурах. Более точная зависимость константы скорости от температуры описывается уравнением Аррениуса:
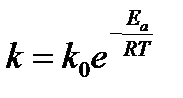 5.24
5.24
где k – константа скорости; k0 – предэкспоненциальный множитель; T – температура, К; R – универсальная газовая постоянная 8,31 Дж/(моль×К); Eа – энергия активации (Дж/моль).
Энергией активации элементарного акта реакции называется минимальная (избыточная над средней) внутренняя энергия, которой должны обладать реагирующие частицы, чтобы произошло химическое превращение.
|
| Энергия активации и предэкспонента может быть определена графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
|
Сложные реакции
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
Если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
В случае сложных реакций величина k в уравнении (5.8) представляет собой экспериментальную константу скорости, которая является комбинацией констант элементарных стадий, через которые протекает сложный процесс, поэтому, строго говоря, уравнение (5.24) относится только к элементарным реакциям. Однако, на опыте часто оказывается, что уравнение Аррениуса описывает зависимость k от температуры для сложных многостадийных реакций. В этом случае под величиной Еа следует понимать некую эффективную величину, зависящую от энергий активации элементарных стадий.
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса.
|
|
|
Целью кинетических исследований является определение вида кинетического уравнения и его параметров. На основании анализа зависимости текущей концентрации компонента от времени можно определить порядок реакции, константу скорости, а по температурной зависимости константы скорости – энергию активации.
Дата добавления: 2018-04-15; просмотров: 1011; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

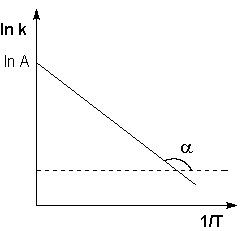 Рис.5.5 Зависимость логарифма константы скорости химической реакции от обратной температуры (Здесь A=k0).
Рис.5.5 Зависимость логарифма константы скорости химической реакции от обратной температуры (Здесь A=k0).