Определение константы скорости реакции при разных температурах.
¨ Для исследования зависимости константы скорости омыления уксусноэтилового эфира от температуры необходимо провести реакцию при 4 – 5 различных температурах, указанных преподавателем, определив для каждой температуры зависимость удельной электропроводности реакционной смеси от времени. Опыты проводить в одной и той же ячейке.
¨ Для каждой точки рассчитать Сτ по формуле (5.30) и k по формуле (5.25). Результаты измерений для каждой температуры и рассчитанные из них значения записать в таблицы, аналогичные 5.1.2.
¨ Если не наблюдается закономерного изменения k в ходе реакции, то вычислить среднеарифметическое значение k для данной температуры. В противном случае с помощью преподавателя выбрать интервал времени реакции, в котором k закономерно не изменяется, и рассчитать 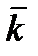 только для этого интервала. Определите доверительный интервал значений математического ожидания констант, соответствующей доверительной вероятности 0,90 (Используйте курс «Компьютерные технологии в химии»)
только для этого интервала. Определите доверительный интервал значений математического ожидания констант, соответствующей доверительной вероятности 0,90 (Используйте курс «Компьютерные технологии в химии»)
Определение энергии активации и предэкспоненциального множителя.
¨ Рассчитайте константы скорости 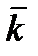 при нескольких температурах. Результаты запишите в таблицу 5.3. По данным таблицы 5.1.3 построить график зависимости натурального логарифма константы скорости реакции от обратной температуры (Т, К)-1 и рассчитать энергию активации и предэкспоненциальный множитель.
при нескольких температурах. Результаты запишите в таблицу 5.3. По данным таблицы 5.1.3 построить график зависимости натурального логарифма константы скорости реакции от обратной температуры (Т, К)-1 и рассчитать энергию активации и предэкспоненциальный множитель.
|
|
|
Таблица 5.1.3.
| t, 0С | Т, К | 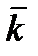
| ln 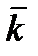
| 1/T |
| t1 | ||||
| t2 | ||||
| …. | ||||
| ti |
¨ Расчет проведите с помощью МНК, используя готовые программы курса «Компьютерные технологии в химии» и EXCEL или MATHSOFT MATHCAD.
КОНТРОЛЬНЫЕ ВОПРОСЫ К РАБОТЕ 5.1
Перед выполнением работы:
1. Сформулируйте цель данной работы.
2. Каков порядок и молекулярность исследуемой реакции?
3. Что называется константой скорости реакции и каков ее физический смысл?
4. По какой формуле рассчитывается константа скорости реакции.
5. Как определяется æо, æτ, Сτ? Расскажите последовательность проведения опытов.
6. Как из экспериментальных данных рассчитать кажущуюся энергию активации реакции омыления эфира?
К защите работы:
1. Какому порядку подчиняется реакция омыления эфира щелочью? Что означает совпадение порядка этой реакции с ее молекулярностью?
2. Дайте определение скорости химической реакции.
3. Запишите кинетическое уравнение для реакций второго порядка.
4. Что называется энергией активации реакции? Почему энергия активации, определяемая из экспериментальных данных, называется кажущейся? Какой смысл предэкспоненты?
|
|
|
Работа 5.2. Изучение кинетики гомогенно-каталитического разложения Н2О2 .
Цель работы – Получить зависимости количества выделившегося кислорода от времени реакции при различных концентрациях катализатора и Н2О2, провести расчеты степени разложения Н2О2, скорости и константы скорости реакции, определить порядки реакции.
Перекись водорода в водных растворах самопроизвольно разлагается с образованием воды и кислорода
С катализаторами реакция значительно ускоряется, например, при введении в раствор ионов железа, меди, иода, бихромат-иона (гомогенно-каталитическое разложение) и в присутствии металлов – платины, кобальта и т.д. (гетерогенно-каталитическая реакция). В организме человека разложение перекиси водорода, образующейся в процессе обмена веществ, происходит под действием фермента каталазы (ферментативный катализ). Каталитические реакции являются сложными реакциями, протекающими в несколько стадий.
Порядком сложной реакцииназывается показатель степени при концентрации данного вещества (частный порядок) в уравнении зависимости скорости реакции от концентрации реагентов. Экспериментальное определение порядков реакции позволяет подтвердить (или опровергнуть) предполагаемый механизм реакции, найти константы стадий этого механизма.
|
|
|
Гомогенно-каталитическое разложение перекиси водорода в растворе под действием бихромат-иона 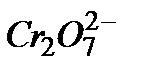 в общем виде можно представить двумя стадии. В первой обратимой реакции образуются ионы промежуточного соединения
в общем виде можно представить двумя стадии. В первой обратимой реакции образуются ионы промежуточного соединения 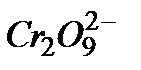 , которые необратимо распадаются с выделением кислорода и исходного
, которые необратимо распадаются с выделением кислорода и исходного 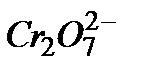 :
:
1. 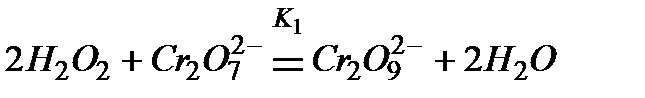
2. 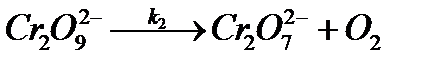
Если более медленно стадией (лимитирующей) является распад иона 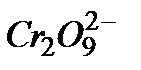 , то общая скорость реакции будет пропорциональна их концентрации
, то общая скорость реакции будет пропорциональна их концентрации
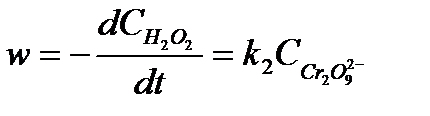 , 5.32
, 5.32
где 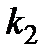 - константа скорости второй стадии реакции.
- константа скорости второй стадии реакции.
Концентрацию промежуточного соединения можно выразить через константу равновесия первой стадии 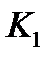
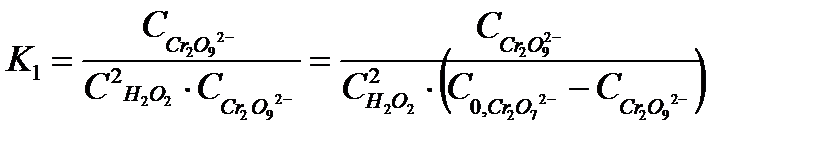 , 5.33
, 5.33
где
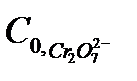 - исходная (начальная) концентрация катализатора,
- исходная (начальная) концентрация катализатора,
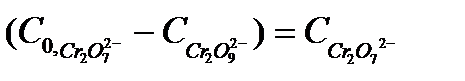 - равновесная концентрация катализатора,
- равновесная концентрация катализатора,
 - концентрация промежуточного продукта,
- концентрация промежуточного продукта,
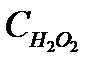 - равновесная концентрация перекиси водорода.
- равновесная концентрация перекиси водорода.
Вода находится в большом избытке, и её концентрацию можно считать постоянной. Выразив концентрацию ионов 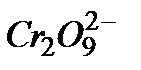 из (5.33) и подставив её в уравнение (5.32), получим
из (5.33) и подставив её в уравнение (5.32), получим
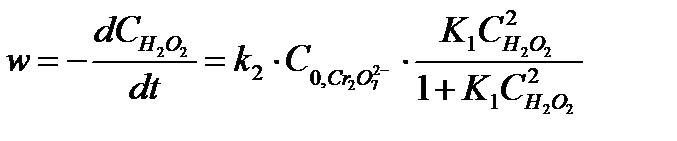 5.34
5.34
откуда следует что
|
|
|
· скорость процесса линейно увеличивается с ростом концентрации катализатора,
· порядок реакции по 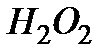 может изменяться от 0 до 2 (среднее значение n = 1).
может изменяться от 0 до 2 (среднее значение n = 1).
Действительно, если равновесие сдвинуто в сторону образования промежуточного продукта, т.е. в уравнении (5.34) 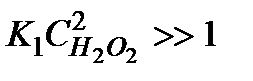 , порядок реакции по перекиси водорода равен нулю и скорость реакции равна
, порядок реакции по перекиси водорода равен нулю и скорость реакции равна 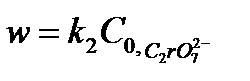 . В случае, когда
. В случае, когда 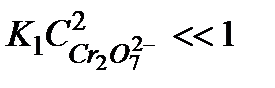 , равновесие сдвинуто в сторону исходного вещества и
, равновесие сдвинуто в сторону исходного вещества и 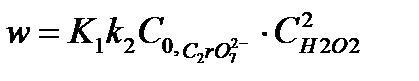 , то есть порядок реакции по перекиси водорода равен 2. Заметим, что сдвиг равновесия в ту или иную сторону зависит от температуры, поэтому порядок реакции может изменяться.
, то есть порядок реакции по перекиси водорода равен 2. Заметим, что сдвиг равновесия в ту или иную сторону зависит от температуры, поэтому порядок реакции может изменяться.
Поскольку сдвиг равновесия в ту или иную сторону зависит от температуры, порядок реакции разложения перекиси водорода изменяется с температурой.
Дата добавления: 2018-04-15; просмотров: 1092; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
