Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
Цель работы – определить значения констант скорости реакции при разных температурах, рассчитать энергию активации и предэкспоненциальный множитель.
Омыление сложного эфира щелочью является бимолекулярной реакцией:
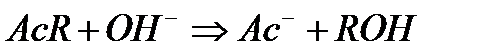
Скорость ее описывается уравнением второго порядка 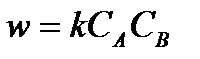 , т.е. порядок реакции и ее молекулярность в данном случае совпадают. Константа скорости реакции выражается следующим образом:
, т.е. порядок реакции и ее молекулярность в данном случае совпадают. Константа скорости реакции выражается следующим образом:
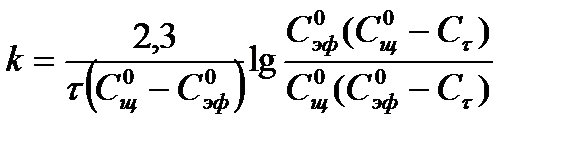 5.25
5.25
где 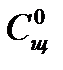 - начальная концентрация ионов
- начальная концентрация ионов 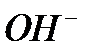 (практически равная начальной концентрации щелочи);
(практически равная начальной концентрации щелочи);
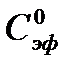 - начальная концентрация эфира;
- начальная концентрация эфира;
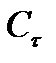 - концентрация ионов кислотного остатка (
- концентрация ионов кислотного остатка ( 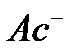 ), образовавшихся ко времени τ от начала реакции (эта величина практически равна концентрации соли);
), образовавшихся ко времени τ от начала реакции (эта величина практически равна концентрации соли);
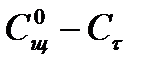 - концентрация щелочи, непрореагировавшей к моменту времени τ.
- концентрация щелочи, непрореагировавшей к моменту времени τ.
В процессе омыления подвижные ионы гидроксила заменяются в растворе менее подвижными ионами кислотного остатка 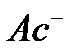 . Вследствие этого электропроводность реакционной смеси уменьшается и и поэтому по изменению электропроводности в ходе реакции можно изучать ее кинетику.
. Вследствие этого электропроводность реакционной смеси уменьшается и и поэтому по изменению электропроводности в ходе реакции можно изучать ее кинетику.
Удельная электропроводность в начальный момент реакции равна:
æо 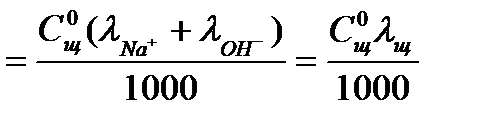 5.26
5.26
где 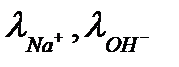 - подвижности ионов Na+ , OH- при данной температуре. Для раствора едкого натра с концентрацией 0,05н:
- подвижности ионов Na+ , OH- при данной температуре. Для раствора едкого натра с концентрацией 0,05н:
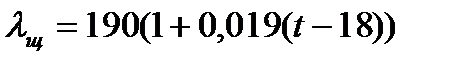 5.27
5.27
где t – температура опыта в 0С . Из уравнений (5.26) и (5.27) получаем:
|
|
|
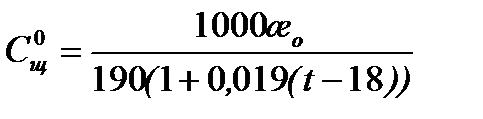 5.28
5.28
Удельная электропроводность в момент времени t от начала реакции равна:
æτ 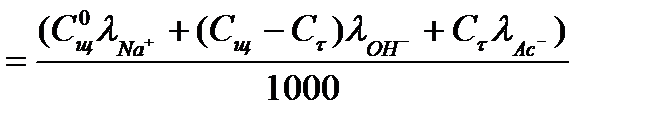 5.29
5.29
Из уравнений (5.27), (5.29) следует, что
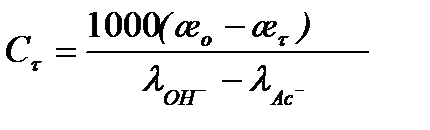
считая разность 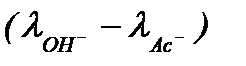 постоянной в течение реакции и равной примерно 139(1+0,0165(t-18)) получаем:
постоянной в течение реакции и равной примерно 139(1+0,0165(t-18)) получаем:
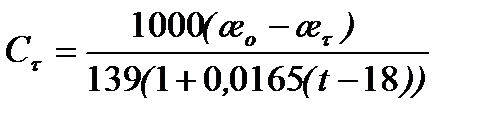 5.30
5.30
Так как начальная концентрация эфира 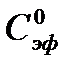 равна концентрации ионов
равна концентрации ионов 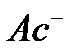 , образующихся к концу реакции, то из уравнения (5.30) следует, что
, образующихся к концу реакции, то из уравнения (5.30) следует, что
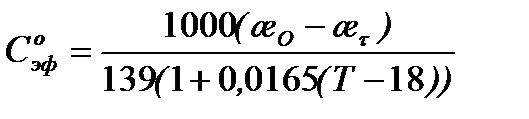 5.31
5.31
Измеряя в ходе реакции удельную электропроводность реакционной смеси, можно по уравнению (5.30) рассчитать значения Сτ, по уравнениям (5.28), (5.32) - 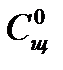 ,
, 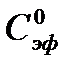 , а затем подставляя в уравнение (5.25) определить константу скорости реакции.
, а затем подставляя в уравнение (5.25) определить константу скорости реакции.
Порядок выполнения работы:
Оборудование: Кондуктометр, секундомер, стаканы 50 мл, 100 мл колбы с пробкой, термостат, фильтровальная бумага.
Реактивы: Растворы 0,05н щелочи, 0,05н этилацетата, дистиллированная вода.
1. С помощью лаборанта настроить термостат на температуру 250С. Поместить в термостат две колбы, одна из которых содержит 100 мл 0,05н раствора щелочи, а другая 80 мл 0,05н раствора этилацетата в воде. Обе колбы должны быть закрыты притертыми пробками.
2. Определение æ0.
|
|
|
¨ Приготовить раствор, состоящий из 50 мл щелочи концентрации 0,05н и 40 мл дистиллированной воды. Рабочим раствором щелочи 2 – 3 раза ополоснуть ячейку, затем заполнить ее. Поместить ячейку с раствором щелочи в термостат и через 10 мин три раза измерить удельную электропроводность. Результаты занести в таблицу 5.1.1. Определить среднеарифметическое значение 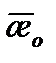 Повторить измерения при 4 – 5 значениях температур. Рассчитать
Повторить измерения при 4 – 5 значениях температур. Рассчитать 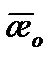 для всех температур.
для всех температур.
¨ Раствор щелочи можно сохранить и использовать его для измерения æ0 при каждой температуре до и после кинетического опыта, когда в термостате установилась постоянная температура.
Таблица 5.1.1.
| № | t, 0С | æ0 | 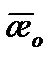
|
| 1 | t1 |
| |
| 2 | |||
| 3 | |||
| 1 | t2 |
| |
| 2 | |||
| 3 | |||
| …. | …. | …. | …. |
| 1 | . . ti |
| |
| 2 | |||
| 3 |
¨ Содержимое колб, находящихся в термостате (40мл эфира и 50 мл щелочи), быстро смешать, переливая из колбы в колбу. Время смешивания заметить по часам с точностью до 10 секунд или включением секундомера. Быстро сполоснуть ячейку полученной смесью, затем залить туда 50 мл этой смеси, поместить ячейку в термостат и через 1-2 минуты измерить удельную электропроводность. При низких температурах интервал между измерениями может составлять 3-5 минут.
|
|
|
¨ Периодически измерять удельную электропроводность реакционной смеси. в начале интервал между измерениями должен составлять 3 – 5 минут, затем, в зависимости от скорости реакции, 10 – 15 минут. Сделать не менее 10 измерений в опытах для каждой температуры. Результаты записать в таблицу 5.1.2.
Таблица 5.1.2.
Состав смеси: 40 мл 0,05н раствора эфира и 50 мл 0,05н раствора щелочи
t = ….. 0С; æо = ……… См·см2
| τ | æτ | Сτ | k | 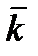
|
¨ Для определения 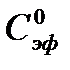 можно использовать æ∞, т.е. æ, которое получается после окончания реакции (æ = const) в опыте при самой высокой температуре. Удельная электропроводность в этом случае должна оставаться практически постоянной.
можно использовать æ∞, т.е. æ, которое получается после окончания реакции (æ = const) в опыте при самой высокой температуре. Удельная электропроводность в этом случае должна оставаться практически постоянной.
Дата добавления: 2018-04-15; просмотров: 1388; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
