Виды химических реакций и скорость их протекания.
Цель:закрепить теоретические знания условий химических реакций и скорости их протекания.
Обеспеченность занятия
1 Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
2 Таблица «Растворимость кислот, солей и оснований в воде».
3 Реактивы: растворы сульфата цинка, сульфата меди, сульфат никеля, карбонат натрия, ацетат натрия, гидроокисел натрия, соляная кислота, уксусная кислота. Гранулы цинка, меди, кальция, оксида меди.
Теоретический материал
Виды реакций: Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Признаки химических реакций:
- изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа - химическая реакция взаимодействия железа с кислородом);
- выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция);
- выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ);
- образование веществ слабых электролитов (например, реакции при которых одним из продуктов реакции является вода);
- свечение раствора.
|
|
|
Реакции обмена между растворами электролитов идут до конца, если образуется малодиссоциирующее вещество, или вещество, практически нерастворимое, выделяющееся из раствора в виде осадка или газа.
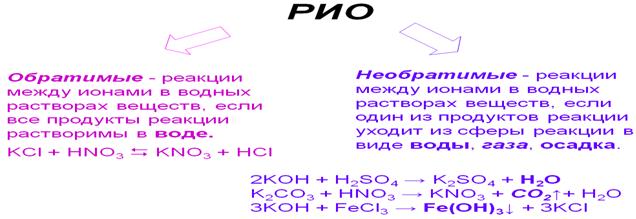
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
| 1). Записываем уравнение РИО в молекулярном виде: | Взаимодействие серной кислоты и хлорида бария: II II I I H2SO4 + BaCl2 = BaSO4 + 2HCl |
| 2). Используя таблицу растворимости указываем растворимость веществ воде: - если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓; - если продукт является газом, справа от химической формулы ставим знак ↑. | Р Р Н Р H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl Молекулярный вид |
| 3). Записываем уравнение РИО в полном ионном виде. | 2H+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2H+ + 2Cl- Полный ионный вид |
| 4). Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. | SO42- + Ba2+ + = BaSO4 ↓ Краткий ионный вид Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок BaSO4 ↓ |
Вопросы для закрепления теоретического материала
Составить уравнение реакции по схемам:
|
|
|
1. S→H2S→Na2S→CuS
2. FeS→H2S→S→SO2
3.S→SO2→H2SO3→PbSO3
Задание
- Повторить теоретический материал.
- Ответить на вопросы для закрепления теоретического материала.
3. Провести эксперимент, соблюдая правила техники безопасности.
- Оформить отчет.
Инструкция по выполнению лабораторной работы
1 Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2 Проведите опыты.
3 Заполните таблицу.
Опыт №1Реакция замещения меди железом в растворе медного купороса
В 2 пробирки порознь поместить по 5 капель растворов сульфатов меди и сульфата цинка.
В первую пробирку с CuSO4 поместить кусочек цинка, во вторую с ZnSO4 – кусочек меди. Через 4-5 минут, слить растворы из пробирок, достать кусочки металлов на фильтровальную бумагу.
Написать молекулярное уравнение реакции. Составить электронные уравнения.
Опыт №2 Реакции, идущие с образованием осадка
В пробирку внести 2-3 капли 0,5н. раствора сульфата меди (2), добавить 2-3 капли 2н. раствора гидроокисла натрия.
Описать наблюдения. Отметить цвет образующегося осадка.
Составить молекулярное и ионно-молекулярное уравнение проведенной реакции.
|
|
|
Опыт №3 Зависимость скорости взаимодействия соляной кислоты с металлами от их природы
В 3 пробирки поместить гранулы Ca, Zn, Cu. В каждую внести 7-8 капель HCl. Описать наблюдения.
Составить молекулярное и ионно-молекулярное уравнение реакции.
Опыт №4 Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации
В 3 пробирки поместить гранулы Zn и внести в 1ю пробирку 2Н HCl, во вторую 1Н HCl, в 3ю 1Н HCl.
Описать наблюдения.
Образец отчёта
Лабораторная работа № 5 Виды химических реакций и скорость их протекания.
Цель:закрепить теоретические знания условий химических реакций и скорости их протекания.
| Название опыта | что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Реакция замещения меди железом в растворе медного купороса | |||
| Реакции, идущие с образованием осадка. | |||
| Зависимость скорости взаимодействия соляной кислоты с металлами от их природы | |||
| Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. |
Вывод делать в соответствии с целью работы
Литература0.2.с 41 - 44
|
|
|
Тема 1.7Металлы и неметаллы
Лабораторная работа №6
Металлы и их свойства
Цель:закрепить знания свойств железа.
Обеспеченность занятия
1. Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
2. Реактивы: железо (порошок, пластина, скрепка),соляная кислота, сульфат меди
3. Спиртовка
Теоретический материал
Желе́зо— элемент побочной подгруппы восьмой группы четвёртого перида периодической системы химических элементов Д. И. Менделеева
Железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая(легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al[2]). Считается также, что железо составляет бо́льшую часть земного ядра.
Сидерит — FeCO3 — содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см³ и твёрдость 3,5—4,5 по шкале Мооса.
Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см³ и твёрдостью 5—6 по шкале Мооса.
Лёллингит — FeAs2 — содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7—7,4 г/см³, твёрдость 5—5,5 по шкале Мооса.
Миспикель — FeAsS — содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6—6,2 г/см³ и твёрдостью 5,5—6 по шкале Мооса.
Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8—1,9 г/см³.
Вивианит — Fe3(PO4)2·8H2O — встречается в виде сине-серых или зелено-серых моноклинных кристаллов с плотностью 2,95 г/см³ и твёрдостью 1,5—2 по шкале Мооса.
Помимо вышеописанных минералов железа существуют:
| ильменит — FeTiO3 магномагнетит — (Fe, Mg)[Fe2O4] фиброферрит — FeSO4(OH)·4,5H2O ярозит — KFe3(SO4)2(OH)6 кокимбит — Fe2(SO4)3·9H2O рёмерит — Fe2+Fe3+2(SO4)4·14H2O графтонит — (Fe, Mn)3(PO4)2 скородит — Fe3+AsO4·2H2O штренгит — FePO4·2H2O фаялит — Fe2SiO4 | альмандин — Fe3Al2[SiO4]3 андрадит — Ca3Fe2[SiO4]3 гиперстен — (Fe, Mg)2[Si2O6] геденбергит — (Ca, Fe)[Si2O6] эгирин — (Na, Fe)[Si2O6] шамозит — Fe2+4Al[AlSi3O10](OH)6·nH2O нонтронит — (Fe3+, Al)2[Si4O10](OH)2·nH2O |
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Для выплавки железа из руды разработан доменный процесс с получением в нем чугуна, поступающего затем на выработку стали.
По цвету свежего излома различают два вида чугуна: а) серый и б) белый. Оба эти вида отличаются по физическим и химическим свойствам.
Серый чугун (называемый также мягким) несколько ковок и обладает вязкостью, достаточной для возможности употреблять его в форме отливок.
Белый чугун (жесткий) тверд и хрупок и для применения в виде изделий не годит. При обработке образцов соляной или серной кислотой белый чугун растворяется без остатка, тогда как при такой же обработке серого всегда остается черный графитовый остаток.
При быстром охлаждении (например, при поливке водой) раскаленного серого чугуна, почти всякий серый чугун делается белым, если же такой отбеленный чугун опять накалить и охлаждать медленно, то он снова сделается серым.
Вопросы для закрепления теоретического материала
1. Цель закалки стали.
2. Назначение отпуска стали.
3.Определение чугунов.
4.Укажите руды железа.
Задание
- Повторить теоретический материал
- Ответить на вопросы для закрепления теоретического материала.
3. Провести эксперимент, соблюдая правила техники безопасности.
- Оформить отчет.
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. Выполните опыты.
- Результаты внесите в таблицу
Опыт №1 Определение ионов железа
В пробирку №1 внести соль железа двухвалентного. В пробирку №2 внести соль железа трёхвалентного. В каждую пробирку вводим раствор гидроокиси натрия. Заполните таблицу
Опыт №2 Химические свойства железа
а) В пустую пробирку налейте 2мл раствора соляной кислоты и опустите туда кусочек железа (скрепку, кнопку). Нагрейте содержимое на спиртовке. Что вы наблюдаете? Какая соль получилась? Чтобы проверить правильность вашего предположения о возможной формуле соли, проведите анализ на обнаружение ионов Fе+2 и Fe+3. Для этого добавьте в пробирку гидрооксид натрия. Что вы наблюдаете? Сделайте вывод о составе полученной соли.
б) Опустите кусочек железа в раствор медного купороса (CuSO4). Каковы признаки реакции? Каков состав полученной соли?
Напишите соответствующие химические реакции.
Образец отчёта
Лабораторная работа № 6 Металлы и их свойства.
Цель: закрепить знания свойств железа.
| Название опыта | Что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Определение ионов железа | |||
| Химические свойства железа |
Вывод делать в соответствии с целью работы
Литература 0.1 с.72 - 75
Практическая работа №2
Дата добавления: 2018-04-15; просмотров: 648; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
