Приготовление раствора заданной концентрации
Цель: научиться готовить раствор с заданной концентрацией.
Обеспеченность занятия
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Весы, разновесы, мерные колбы объёмом 0,5 л. и 1 л., пипетки, хлорид натрия
Теоретический материал
Концентрацией раствора называется весовое содержание растворённого вещества в определённом весовом количестве или в определённом объёме раствора.
В химии применяют следующие способы выражения концентрации раствора: процентная, молярная, моляльная и нормальная.
Процентная концентрация выражается числом граммов растворённого вещества, содержащимся в 100 г. раствора. Например, 20%-ный раствор поваренной соли – это раствор, в 100 г. которого содержится 20 г. соли и 80 г. воды.
Молярная концентрация выражается количеством молей растворённого вещества, содержащимся в 1 л. раствора. Раствор, содержащий 1 моль растворённого вещества в литре, называется одномолярным (1 М раствор), содержащий 0,1 моля, называется децимолярным (0,1 М раствор).
Моляльная концентрация – концентрация растворённого вещества в молях на 1000 г. растворителя.
Нормальная концентрация выражается числом грамм-эквивалентов растворённого вещества, содержащимся в 1 л. 1 г-экв. растворённого вещества, называется одномолярным (1 н. раствор), содержащий 0,1 г-экв. в 1 л. называется децинормальным (0,1 н. раствор).
|
|
|
Вопросы для закрепления теоретического материала
- Объясните, в чём сущность процесса растворения?
- Почему процесс растворения бывает эндотермическим?
- Чем насыщенный раствор отличается от:
а) разбавленного;
б) концентрированного;
в) пересыщенного;
г) ненасыщенного?
- Перечислите известные вам способы выражения концентрации раствора.
- Что такое нормальность и молярность раствора?
Задание
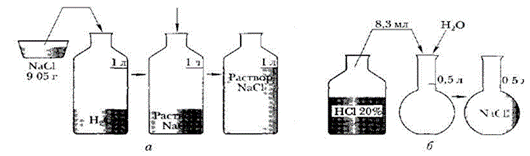
Приготовить 1 л раствора хлорида натрия с молярной концентрацией 0,155 М.
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. Рассчитайте массу хлорида натрия. Для расчетов используйте формулы:
3. C = ν : V; ν = C *V; m = ν *M; m = C *V* M
4. Взвесьте на весах рассчитанную навеску.
5. Перенести навеску соли в мерную колбу.
6. Прилейте в колбу немного воды и перемешать стеклянной палочкой до полного растворения соли.
7. Налейте в мерную колбу воды до метки.
Образец отчёта
Практическое занятие № 1 Приготовление растворов заданной концентрации.
Цель: научиться готовить раствор с заданной молярной концентрацией.
|
|
|
| Номер и содержание задачи | Что делали | Расчёты | Наблюдения |
Вывод в соответствии с целью работы.
ЛитератураО – 1 , с 52 – 58
Тема 1.5Классификация неорганических соединений и их свойства
Лабораторная работа № 3
Химические свойства кислот и оснований
Цель:отработать навыкисоставления уравнений химических реакций в молекулярном и ионном видах.
Обеспеченность занятия
1. Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
2. Таблица «Растворимость кислот, солей и оснований в воде».
3. Растворы: серной кислоты, гидроксида натрия; индикатора метилоранж; нитрат бария, оксид кальция; кювета для капельного анализа, пипетка, стеклянная палочка, универсальная индикаторная бумага, синий лакмус
Теоретический материал
Химические свойства неорганических кислот
1. Изменяют окраску индикаторов: лакмус-красный, метилоранж-красный (только для растворимых кислот).
2. Взаимодействие с металлами, стоящими до водорода
H2SO4 + Ca = CaSO4 + H2 2HCl + Ca = CaCl2 + H2
3. Взаимодействие с основными оксидами
H2SO4 + CaO = CaSO4 + H2O 2HCl + CaO = CaCl2 + H2O
4. Взаимодействие с основаниями
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O 2HCl + Ca(OH)2 = CaCl2 + 2H2O
5. Взаимодействие с амфотерными оксидами
H2SO4 + ZnO = ZnSO4 + H2O 2HCl + ZnO = ZnCl2 + H2O
6. Взаимодействие с солями, если образуется малорастворимое, летучее или
|
|
|
малодиссоциирующее вещество
H2SO4 + BaCl2 = BaSO4 + 2HCl 2HCl + Na2CO3 = 2NaCl + H2O + CO2
7. При нагревании слабые кислоты легко разлагаются
H2SiO3 = H2O + SiO2 H2S = H2 + S
Получение неорганических кислот
Кислородсодержащие
1. Кислотный оксид + вода
SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4
2. Металл + сильный окислитель
3P + 5HNO3+ 2H2O = 3H3PO4 + 5NO
3. Cоль + менее летучая кислота
Бескислородные
1. Водород + неметалл
H2 + Cl2 = 2HCl
2. Cоль + менее летучая кислота
NaCl + H2SO4 = HCl + NaHSO4
NaNO3 + H2SO4 = HNO3 + NaHSO4
Химические свойства оснований
1. Диссоциация:
КОН + nН2О  К+×mН2О + ОН–×dН2О или сокращенно: КОН
К+×mН2О + ОН–×dН2О или сокращенно: КОН  К+ + ОН–.
К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням: Fe(OH)2  FeOH+ + OH– (1 ступень);
FeOH+ + OH– (1 ступень);
|
|
|
FeOH+  Fe2+ + OH– (2 ступень).
Fe2+ + OH– (2 ступень).
2. Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь)  окрашенное соединение.
окрашенное соединение.
3. Разложение с образованием оксида и воды (см. таблицу). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C). Zn(OH)2  ZnO + H2O.
ZnO + H2O.
Таблица температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4. Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 2OH– + 6H2О = 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O  2NaAlО2 + 3H2.
2NaAlО2 + 3H2.
5. Взаимодействие щелочей с неметаллами: 6NaOH + 3Cl2  5NaCl + NaClO3 + 3H2O.
5NaCl + NaClO3 + 3H2O.
6. Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2 = Na2CO3 + H2O 2OH– + CO2 = CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O = Na2[Zn(OH)4] 2OH– + ZnO + H2О = [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO  Na2ZnO2 + H2O.
Na2ZnO2 + H2O.
7. Взаимодействие оснований с кислотами
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O 2H+ + SO42– + Ca2+ +2OH– = CaSO4 + 2H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O 2H+ + Zn(OH)2 = Zn2+ + 2H2O.
8. Взаимодействие щелочей с амфотерными гидроксидами:
В растворе: 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] 2OH– + Zn(OH)2 = [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2  Na2ZnO2 + 2H2O.
Na2ZnO2 + 2H2O.
9. Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH = Na2SO4 + Cu(OH)2 Cu2+ + 2OH– = Cu(OH)2.
Получение оснований
1. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью: 2NaOH + ZnSО4 = Na2SO4 + Zn(OH)2 Zn2+ + 2OH– = Zn(OH)2
2.Взаимодействием оксида металла с водой:
Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2.
3. Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O = 2NaOH + H2 Ca + 2H2O = Ca(OH)2 + H2.
4.Электролизом растворов солей: 2NaCl + 2H2O  H2 + 2NaOH + Cl2.
H2 + 2NaOH + Cl2.
5. Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми
солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2 + Na2CO3 = 2NaOH + BaCO3¯ Ba2+ + CO32– = BaCO3¯.
Вопросы для закрепления теоретического материала
1. Какие вещества называют кислотами?
2. С какими из перечисленных веществ взаимодействует соляная кислота: MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
3. Укажите валентность кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4; Na2CО3; AlPO4; CuSO4; Fe(NO3)3; Al2S3; PbCl4; KI.
4. С какими из перечисленных веществ взаимодействует гидроксид калия: MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
5. От чего зависит число гидроксильных групп в основаниях?
Задание
- Экспериментально исследуйте свойства кислот и оснований капельным методом.
- Составьте соответствующие уравнения химических реакций в молекулярном и ионно-молекулярном виде.
- Сделать вывод
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. Выполните опыты.
3. Результаты внесите в таблицу
Опыт №1 Свойства кислот
В семь кювет для капельного анализа внести по 4 капли серной кислоты .
Внести в кювету в соответствии с указанным номером следующие реактивы:
№ 1 индикатор метиловый оранжевый;
№ 2 индикатор лакмус синий;
№ 3 индикатор универсальный;
№ 4 стружку магния;
№ 5 оксид кальция;
№ 6 индикатор метиловый оранжевый;
№ 7 соль бария.
Запишите наблюдаемые явления в таблицу
Опыт №2 Свойства оснований
В пять кювет для капельного анализа внесите по 2 капли щёлочи.
Внести в кювету в соответствии с указанным номером следующие реактивы :
№ 1. индикатор метиловый оранжевый
№ 2. индикатор лакмус синий
№ 3. индикатор универсальный
№ 4. индикатор фенолфталеин
№ 5. индикатор метиловый оранжевый.
Запишите наблюдаемые явления в таблицу
Образец отчёта
Лабораторная работа № 3 Химические свойства кислот и оснований.
Цель: отработать навыки составления уравнений химических реакций в молекулярном и ионном виде.
| Название опыта | Что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Испытание растворов кислот индикаторами. | Цвет фенолфталеина- Цвет лакмуса - Цвет метилоранжа- | ||
| Испытание растворов щелочей индикаторами. | Цвет метилоранжа Цвет синего лакмуса- Цвет фенолфталеина- | ||
| Взаимодействие металлов с кислотами. | |||
| Взаимодействие кислот с оксидами металлов. | |||
| Взаимодействие кислот с основаниями. | |||
| Взаимодействие кислот с солями. |
Вывод в соответствии с целью работы.
Литература О-4 с.29 - 35
Лабораторная работа № 4
Гидролиз солей
Цель: отработать навыкисоставления уравнений химических реакций в молекулярном и ионном видах.
Обеспеченность занятия
1. Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
2. Таблица «Растворимость кислот, солей и оснований в воде».
3. Растворы солей: карбонат калия, карбонат натрия, нитрат калия, сульфат алюминия, сульфат железа (III), сульфат меди (II), хлорид железа (III), хлорид натрия, хлорид цинка, гидроксид натрия.
4. Оборудование: штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка.
Теоретический материал
Различают средние, кислые и основные соли. Существуют также двойные соли, образованные разными металлами и одним кислотным остатком KAl(SO4)2. Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или гидроксогрупп основания кислотными остатками: NaCl, K2SO4, AlPO4.
| Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит. [H+] = [OH-] - среда нейтральная, [H+] > [OH-] - среда кислая, [OH-] > [H+] - среда щелочная. | Классификация электролитов
| ||||||||||||||||||||||||||
В зависимости от своего состава соли по–разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей.
| 1.Соль образована катионом слабого основания и анионом сильной кислоты (CuCl2, NH4Cl, Fe2(SО4)3 гидролиз по катиону) CuCl2D Cu+2 + 2Сl- Н2О D Н+ + ОН- Cu+2 + 2Сl- + Н+ + ОН-D CuОН+ + Н++ 2Сl- Выводы: [ Н+] > [ОН-] _ pH < 7 _ среда раствора кислая _ окраска индикаторов изменяется | 2.Соль образована катионом сильного основания и анионом слабой кислоты. (К2СО3, Na2S — гидролиз по аниону) К2СО3D 2К+ + СО3-2 Н2О D Н+ + ОН- 2К++СО3-2+Н++ОН -DНСО-3 + 2К+ + ОН- Выводы: [ Н+] < [ОН-] _ pH > 7 _ среда раствора щелочная _ окраска индикаторов изменяется |
| 3. Соль образована катионом слабого основания и анионом слабой кислоты (CH3COONH4, AlCl3 , (NH4)2CO3— гидролиз по катиону и по аниону) Fe2 (CО3)3D 2Fe +3 + 3CО3-2 Н2О D Н+ + ОН- 2Fe +3 + 3CО3-2+ Н+ + ОН-D Fe (ОН)3$+ CО2#+Н2О идёт до конца Выводы: Характер среды определяется относительной силой кислоты и основания. | 4. Соль образована катионом сильного основания и анионом сильной кислоты. (гидролизу не подвергаются (NaCl, К2SО4, Ba(NО3)2). NaCl D Na+ + Сl- Н2О D Н+ + ОН- Na+ +Сl- +Н+ +ОН- D Na+ +Сl- +Н+ +ОН Выводы: [ Н+] = [ОН-] _ pH = 7 _ среда раствора нейтральная _ окраска индикаторов не изменяется |
Вопросы для закрепления теоретического материала
1. С какими из перечисленных веществ взаимодействует хлорид бария: MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
2. Составьте уравнения реакций гидролиза солей ZnCl2, CuSO4, AgNO3
3. Составьте формулы кальциевых солей бромоводородной, угольной и фосфорной кислот.
Задание
1. Повторить теоретический материал
2. Ответить на вопросы для закрепления теоретического материала.
3. Провести эксперимент, соблюдая правила техники безопасности.
4. Оформить отчет.
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. Исследуйте растворы солей.
На полоску универсальной индикаторной бумаги нанесите пипетками по одной капле раствора каждой соли (из списка реактивов).
Результаты наблюдений занесите в таблицу. (Примечание: среда раствора в таблице и цвет индикатора должны соответствовать друг другу.)
3. Составьте уравнения реакций гидролиза солей. С помощью уравнений реакций объясните происходящие реакции.
Образец отчёта
Лабораторная работа № 4 Гидролиз солей.
Цель: отработать навыки составления уравнений химических реакций в молекулярном и ионном видах.
|
Формула соли
| Цвет универсального индикатора | Какими основаниями и кислотами сильными (#) или слабыми ($) соль образована:
| ||
| Нейтральная | Кислая | Щелочная | ||
| 1. К2СО3 | синий | kt # основания и an $ кислоты | ||
| 2. | ||||
| 3. | ||||
| 4. | ||||
| 5. | ||||
| 6. | ||||
| 7. | ||||
| 8. | ||||
| 9. | ||||
Вывод в соответствии с целью работы
Литература О – 4 ,35 -38
Тема 1.6 Химические реакции
Лабораторная работа № 5
Дата добавления: 2018-04-15; просмотров: 3017; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
