Цель: научиться составлять электронные и электронно-графические схемы строения атомов химических элементов по предложенному образцу.
Обеспеченность занятия
Сборник методических указаний для студентов по выполнению практических заданий и лабораторных работ по учебной дисциплине «Химия».
Таблица «Периодическая система химических элементов Д.И. Менделеева».
Вопросы для закрепления теоретического материала
1. Сформулируйте закон периодичности.
2. Почему число элементов в периодах соответствует ряду чисел 2-8-18-32
3. Как изменяются металлические свойства элементов главных подгрупп
4. Как изменяются неметаллические свойства элементов главных подгрупп
5. Сравните неметаллические свойства элементов в ряду Ge – As – Se
Задание…………..
К Вашему порядковому номеру в учебном журнале прибавить 20. Полученный результат соответствует порядковому номеру химического элемента в периодической системе Д.И. Менделеева. Для выбранного атома составьте схему строения по предложенному образцу.
Инструкция по выполнению
1. С помощью простого карандаша, линейки и ручки, покажите какую информацию можно получить о данном химическом элементе из таблицы «Периодическая система химических элементов Д.И. Менделеева».
2. Определите: период, ряд, группу и подгруппу для данного химического элемента.
3. Составьте электронно – графическую схему строения атома данного химического элемента.
4. Составьте электронную схему строения атома данного химического элемента.
|
|
|
Образец отчёта
Лабораторная работа №1 Структура таблицы химических элементов.
Цель:научиться составлять электронные и электронно-графические схемы строения атомов химических элементов по предложенному образцу.
Рубидий.
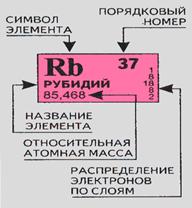
1.
- Период 5
Ряд 6
Группа I
Подгруппа а
- 1s2 ; 2s2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 5s1
| Кв.числа | 5s1 |
| n | 5 |
| l | 0 |
| m | 0 |
| ms |
5п. ↑
4п. ↑↓ ↑↓ ↑↑ ↑↓
3п. ↑↓ ↑↓ ↑↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
2п. ↑↓ ↑↓ ↑↑ ↑↓
1п. ↑↓
4. Составить таблицу квантовых чисел для валентных электронов.
5. Определить валентности атома в нормальном и возбужденном состоянии
6. в выводе указать валентные электроны, валентности атома и суммарное значение спинового квантового числа
ЛитератураО – 1 , с 34 – 38
Тема 1.3Строение вещества.
Лабораторная работа № 2
Дисперсные системы и их свойства
Цель: напрактике познакомиться со свойствами и способами приготовления суспензий и эмульсий.
Задание:
- Ознакомиться с теоретическим материалом.
- Ответить на контрольные вопросы.
- Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ
- Выполнить опыты в соответствии с инструкцией и записать данные в таблицы.
- Сделать вывод.
|
|
|
Обеспеченность занятия
1. Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
- Оборудование: химический стакан, мерная ложка, фарфоровая ступка.
- Реактивы: Вода, моторное масло, мел ( карбонат кальция), ПАВ (эмульгатор).
Теоретический материал
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе
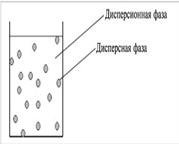
| Размер частиц дисперсной фазы характеризуется дисперсностью. В зависимости от неё дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные). Размер частиц низкодисперсных систем составляет 10–3 мм. и больше. Размер частиц высокодисперсных систем лежит в интервале 10–6–10–4 мм (от 1 до 100 нм), что, как минимум, на порядок больше размера частиц в истинных растворах (10–7 мм). |
Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности).
|
|
|
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. При диспергировании, или измельчении, вещества происходит значительное увеличение площади поверхности частиц (при постоянном суммарном их объеме).
Поэтому область химии дисперсных систем (и коллоидных растворов) считают химией поверхностных явлений.
Свойства вещества в раздробленном, или дисперсном, состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии, т.е. в виде куска твердого тела или некоторого объема жидкости.
Классификация дисперсных систем
| Дисперсная фаза | Дисперсионная среда | Название системы | Примеры | ||
| Газ | Газ | (Дисперсная система не образуется) | - | ||
| Жидкость | Пена | Пена газированной воды, пузырьки газа в жидкости, мыльная пена | |||
| Твердое тело | Твердая пена | Пенопласт, микропористая резина, пемза, хлеб, сыр | |||
| Жидкость
| Газ | Аэрозоль | Туман, облака, струя из аэрозольного баллона | ||
| Жидкость | Эмульсия | Молоко, сливочное масло, майонез, крем, мазь | |||
| Твердое тело | Твердая эмульсия | Жемчуг, опал | |||
| Твердое тело | Газ | Аэрозоль, порошок | Пыль, дым, мука, цемент | ||
| Жидкость | Суспензия, золь (коллоидный раствор) | Глина, паста, ил, жидкие смазочные масла с добавкой графита или MoS | |||
| Твердое тело | Твердый золь | Сплавы, цветные стекла, минералы |
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц. Интенсивность светорассеяния усиливается при коротковолновом излучении и при значительном отличии показателей преломления дисперсной и дисперсионной фаз. С уменьшением диаметра частиц максимум поглощения смещается в коротковолновую часть спектра, и высокодисперсные системы рассеивают более короткие световые волны и поэтому имеют голубоватую окраску.
На спектрах рассеяния света основаны методы определения размера и формы частиц.
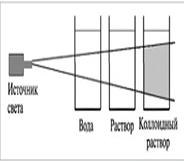
| Методы исследования дисперсных систем (определение размера, формы и заряда частиц) основаны на изучении их особых свойств, обусловленных гетерогенностью и дисперсностью, в частности оптических. Коллоидные растворы обладают оптическими свойствами, отличающими их от настоящих растворов, – они поглощают и рассеивают проходящий через них свет. При боковом рассматривании дисперсной системы, через которую проходит узкий световой луч, внутри раствора на темном фоне виден светящийся голубоватый так называемый конус Тиндаля. |
Суспензия иначе взвесь (англ. suspension) — дисперсная система, в которой твердые частицы дисперсной фазы находятся во взвешенном состоянии в жидкой дисперсионной среде.
Суспензии подразделяют на грубодисперсные (размер частиц — от 1 мкм до долей миллиметра) и мелкодисперсные (от 100 до 1000 нм). Первые неустойчивы и склонны к коагуляции. Суспензии, в которых частицы двигаются свободно, называют золями; если же частицы дисперсной фазы связаны в пространственную структуру, суспензию называют гелем. Суспензии получают методом диспергирования (измельчение твердых тел в жидкости) или конденсации (выделение твердой фазы из пересыщенных растворов). Суспензии имеют ряд общих свойств с порошками, они подобны по дисперсности. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензия снова превращается в порошок. Поэтому способы получения суспензий и порошков одинаковы, лишь при получении суспензий появляется дополнительная технологическая стадия – смешивание порошка с дисперсионной средой. Концентрированные суспензии (пасты) могут быть получены как в результате оседания более разбавленных суспензий, так и непосредственно растиранием порошков или массивных твердых тел с жидкостями.
Коагуляция иначе агрегация; флокуляция (англ. coagulation) — слипание коллоидных частиц друг с другом и образование из них более сложных агрегатов.
Коагуляция представляет собой процесс укрупнения частиц, а седиментация является конечным результатом этого процесса, однако термин «коагуляция» часто используют для обозначения данного явления в целом.
Золь иначе лиозоль; аэрозоль; коллоидный раствор (англ. sol) — высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсионной средой, в объеме которой распределена другая (дисперсная) фаза в виде мелких твердых частиц, капелек жидкости или пузырьков газа.
Примером аэрозоля на основе жидкости является туман — взвесь капель воды в воздухе; находящийся в воздухе дым или пыль — пример твердотельного аэрозоля.
Гель(англ. gel) — (от лат. gelo - застываю или gelatus - замороженный, неподвижный): Гель представляет собой студенистое тело, способное сохранять форму и обладающее упругостью и эластичностью. Примеры веществ, образующих гели: аморфный (гелеобразный) гидроксид алюминия переменного состава Al2O3·nH2O, гидрогели кремниевых кислот (nSiO2·mH2O). При их высушивании получают, соответственно, алюмогель и силикагель — пористые вещества, используемые в качестве сорбентов и носителей для катализаторов.
Эму́льсия (новолат. emulsio, от лат. emulgeo — дою, выдаиваю) — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде).
Эмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (жидкие углеводороды, жиры). Например, молоко — одна из первых изученных эмульсий: в нём капли молочного жира распределены в водной среде.
Эмульсии относятся обычно к грубодисперсным системам, поскольку капельки дисперсной фазы имеют размеры от 1 до 50 мкм. Эмульсии низкой концентрации — неструктурированные жидкости. Высококонцентрированные эмульсии — структурированные системы.
Тип эмульсии зависит от состава и соотношения ее жидких фаз, от количества и химической природы эмульгатора, от способа эмульгирования и некоторых других факторов.
Прямые, с каплями неполярной жидкости в полярной среде (типа «масло в воде»)
Для эмульсих типа м/в хорошими эмульгаторами могут служить растворимые в воде мыла (натриевые и калиевые соли жирных кислот).
Обратные, или инвертные (типа «вода в масле»). Для эмульсии типа в/м хорошими эмульгаторами могут быть нерастворимые в воде мыла (кальциевые, магниевые и алюминиевые соли жирных кислот).
Так же эмульсии разделяются на лиофильные и лиофобные:
Лиофильные эмульсии образуются самопроизвольно и термодинамически устойчивы.
Лиофобные эмульсии возникают при механическом, акустическом или электрическом эмульгировании (диспергировании), а также вследствие конденсационного образования капель дисперсной фазы в пересыщенных растворах или расплавах. Они термодинамически неустойчивы и длительно существуют лишь в присутствии эмульгаторов — веществ, облегчающих диспергирование и препятствующих коалесценции (слипанию).
Эмульсии широко используют в различных отраслях промышленности:
· Пищевая промышленность (сливочное масло, маргарин);
· Мыловарение;
· Переработка натурального каучука;
· Строительная промышленность (битумные материалы, пропиточные композиции);
· Автомобильная промышленность (получение смазочно-охлаждающих жидкостей);
· Сельское хозяйство (пестицидные препараты);
· Медицина (производство лекарственных и косметических средств);
· Живопись.
· Нефтехимия
Вопросы для закрепления теоретического материала
- Чем насыщенный раствор отличается:
а) от разбавленного;
б) от концентрированного;
в) от пересыщенного;
г) от ненасыщенного?
- Назовите составные части дисперсной системы и их отличия друг от друга.
- Назовите основной признак, отличающий коллоидные системы от других видов дисперсных систем.
- Поясните, чем гели отличаются от золей; приведите по одному примеру таких коллоидных систем.
- Что такое коагуляция, назовите её виды, приведите по одному примеру различных видов коагуляции.
- Какова роль эмульсий в нефтяной промышленности.
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. В ступке из кусочка мела приготовить порошок.
3. В стакан насыпать ложку порошка мела и постепенно при помешивании стеклянной палочкой добавить воды.
4. Запишите наблюдения в таблицу
- В пробирку налейте ¼ часть воды и столько же масла. Тщательно перемешайте.
- Добавьте каплю ПАВ (эмульгатора) и перемешайте ещё раз.
- Сравните результаты. Запишите наблюдения в таблицу
- Изучите образцы дисперсных систем
- Заполните таблицу
Образец отчёта
Лабораторная работа № 2 Дисперсные системы и их свойства.
Цель: на практике познакомиться со свойствами и способами приготовления
суспензий и эмульсий.
| Название опыта | что делаете | Наблюдения и их объяснения |
| Приготовление суспензии карбоната кальция в воде. | ||
| Получение эмульсии моторного масла. |
Вывод в соответствии с целью работы.
ЛитератураО–4 , с 51- 60
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
Практическая работа № 1
Дата добавления: 2018-04-15; просмотров: 648; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
